Masse molaire
À propos de ce écoles sélection Wikipedia
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
Masse molaire, symbole M, est la masse d'un en moles d'une substance ( de l'élément chimique ou un composé chimique ). C'est un propriété physique qui est caractéristique de chaque substance pure. La base Unité SI de masse est le kg , mais, pour des raisons pratiques et historiques, les masses molaires sont presque toujours indiqués en grammes par mole (g / mol ou g mol -1), en particulier dans la chimie .
Masse molaire est étroitement liée au poids de formule (FW) ou un parent masse molaire (M r) d'un composé, et à la masses atomiques relatives ou la poids atomiques standard de ses éléments constitutifs. Cependant, il doit être distingué de la masse moléculaire , qui est la masse d'une molécule (de ne importe quelle composition isotopique unique) et ne est pas directement liée à la masse atomique, la masse d'un atome (isotope de toute seule). Le daltons, symbole Da, est également parfois utilisée comme unité de masse molaire, en particulier dans la biochimie , de la définition 1 Da = 1 g / mole, en dépit du fait qu'il est strictement une unité de masse moléculaire (Da = 1 1,660 538 782 (83) × 10 -27 kg).
Masses molaires ne sont presque jamais mesurées directement. Ils peuvent être calculées à partir de poids atomiques standard et sont souvent inscrites dans les catalogues chimiques et sur fiches de données de sécurité (FDS). Masses molaires varient typiquement entre:
- 1 à 238 g / mol pour des atomes d'éléments d'origine naturelle;
- 10-1000 g / mol pour les composés chimiques simples;
- 1000-5,000,000 g / mol pour des polymères, des protéines , ADN , fragments, etc.
Masses molaires des éléments
La masse molaire des atomes d'un élément est donnée par la poids atomique niveau de l'élément multiplié par le constante masse molaire, M u = 1 × 10 -3 kg / mol = 1 g / mol:
- M (H) = 1,007 97 (7) 1 × g / mol = 1,007 94 (7) g / mol
- M (S) = 32,065 (5) × 1 g / mol = 32,065 (5) g / mol
- M (Cl) = 35,453 (2) x 1 g / mol = 35,453 (2) g / mol
- M (Fe) = 55,845 (2) x 1 g / mol = 55,854 (2) g / mol
En multipliant par la constante masse molaire assure que le calcul est dimensions correctes: poids atomiques sont des grandeurs sans dimension (ce est à dire, des chiffres purs), tandis que des masses molaires ont des unités (dans ce cas, g / mol).
Certains éléments sont habituellement rencontrés en tant que molécules , par exemple un atome d'hydrogène (H 2), soufre (S 8), chlore (Cl 2). La masse molaire des molécules de ces éléments est la masse molaire des atomes multiplié par le nombre d'atomes dans chaque molécule:
- M (H 2) = 1,007 × 97 2 (7) 1 × g / mol = 2,015 88 (14) g / mol
- M (S 8) = 32,065 x 8 (5) × 1 g / mol = 256,52 (4) g / mol
- M (Cl 2) = 2 × 35,453 (2) x 1 g / mol = 70,906 (4) g / mol
Masses molaires des composés
La masse molaire d'un composé est donnée par la somme de la poids atomiques standard des atomes qui forment le composé multiplié par le constante masse molaire, M u:
- M (NaCl) = [769 22,989 28 (2) + 35,453 (2)] × 1 g / mol = 58,443 (2) g / mol
- M (C 12 H 22 O 11) = ([12 × 12,0107 (8)] + [1,007 × 22 94 (7)] + [x 15,9994 11 (3)]) x 1 g / mol = 486,424 (10) g / mol
Une masse molaire moyenne peut être définie pour les mélanges de composés. Ceci est particulièrement important dans la science des polymères, où les molécules de polymère peuvent contenir différents nombres différents de des unités monomères (polymères non uniformes).
Propriétés connexes
Poids moléculaire (MW) et le poids de formule (FW) sont des termes plus âgés pour ce qui est maintenant plus correctement appelé le rapport masse molaire (M r). C'est un quantité sans dimension (à savoir, un nombre pur, sans unités) égale à la masse molaire divisée par le constante masse molaire.
Masse moléculaire
La masse moléculaire (m) est la masse d'une molécule donnée: il est mesuré à daltons (Da) ou unités de masse atomique (u), où 1 = 1 u Da = 1,660 538 782 (83) × 10 -27 kg). Les différentes molécules du même composé peuvent avoir des masses moléculaires différentes, car ils contiennent des isotopes d'un élément. La masse molaire est une mesure de la masse moléculaire moyenne de toutes les molécules dans un échantillon, et est habituellement la mesure plus appropriée lorsqu'il se agit de quantités macroscopiques (pesables) d'une substance.
Les masses moléculaires sont calculées à partir de la masses atomiques relatives de chaque nucléide, tandis que les masses molaires sont calculées à partir de la poids atomiques de chaque élément . Le poids atomique tient compte de la répartition isotopique de l'élément dans un échantillon donné (généralement supposée être "normal"). Par exemple, l'eau a une masse molaire de 18,0153 (3) g / mol, mais les molécules d'eau individuels ont des masses moléculaires comprises entre 18,010 564 6,863 (15) u (1 H 2 16 O) et 22,027 7,364 (9) u (2 18 H 2 O).
La distinction entre la masse molaire et la masse moléculaire est important parce que les masses moléculaires relatives peuvent être mesurés directement par spectrométrie de masse , souvent à une précision de quelques parties par million. Ce est suffisamment précis pour déterminer directement la formule chimique d'une molécule.
Précision et incertitudes
La précision d'une masse molaire qui est connu dépend de la précision de la poids atomiques à partir de laquelle il a été calculé. La plupart des poids atomiques sont connues avec une précision d'au moins une partie à dix-mille, souvent bien meilleure (le poids atomique du lithium est un notable, et grave, exception). Ce est suffisant pour pratiquement toutes les utilisations normales de la chimie: il est plus précis que la plupart des analyses chimiques , et dépasse la pureté de la plupart des réactifs de laboratoire.
La précision de Atomics poids, et donc des masses molaires, est limitée par la connaissance de la répartition isotopique de l'élément. Si une valeur plus précise de la masse molaire est requise, il est nécessaire de déterminer la distribution isotopique de l'échantillon en question, qui peut être différente de la distribution standard utilisée pour calculer le poids atomique standard. Les distributions isotopiques des différents éléments dans un échantillon ne sont pas nécessairement indépendantes l'une de l'autre: par exemple, un échantillon qui a été distillée sera enrichi dans le briquet isotopes de tous les éléments présents. Cela complique le calcul de la incertitude type de la masse molaire.
Une convention utile pour les travaux de laboratoire normale est de citer des masses molaires à deux décimales pour tous les calculs. Ce est plus précise que ce qui est habituellement exigé, mais évite erreurs d'arrondi lors des calculs. Lorsque la masse molaire est supérieure à 1000 g / mol, il est rarement approprié d'utiliser plus d'une décimale. Ces conventions sont respectées dans les valeurs les plus sous forme de tableaux de masses molaires.
Mesures
Bien que les masses molaires sont presque toujours, en pratique, calculée à partir des poids atomiques, ils peuvent aussi être mesurées dans certains cas. Ces mesures sont beaucoup moins précis que modernes spectrométrie de masse mesures de poids atomiques et des masses moléculaires, et sont d'un intérêt essentiellement historique. Toutes les procédures se appuient sur propriétés colligatives et toute dissociation du composé doit être prise en compte.
Densité de vapeur
La mesure de la masse molaire par la densité de vapeur repose sur le principe, d'abord par énonça Amadeo Avogadro, que des volumes égaux de gaz dans des conditions identiques contiennent un nombre égal de particules. Ce principe est inclus dans le l'équation des gaz parfaits:
où n est le quantité de substance. La densité de la vapeur (ρ) est donnée par
 .
.
La combinaison de ces deux équations donne une expression de la masse molaire en termes de la densité de vapeur pour des conditions de connue la pression et la température .
Cryoscopie
Le point de congélation d'une solution est inférieur à celui de la pur solvant , et la dépression du point de congélation (T Δ) est directement proportionnelle à la concentration de quantité pour les solutions diluées. Lorsque la concentration en teneur est exprimée en tant que molalité, la constante de proportionnalité est connu comme le constante cryoscopique (K f) et est caractéristique pour chaque solvant. Si w représente le fraction massique du soluté dans la solution, et en l'absence de dissociation du soluté, la masse molaire est donnée par
 .
.
Point d'ébullition élévation
Le point d'ébullition d'une solution non volatile d'un soluté est supérieur à celui de la pur solvant , et l'élévation de point d'ébullition (Δ T) est directement proportionnelle à la concentration de quantité pour les solutions diluées. Lorsque la concentration en teneur est exprimée en tant que molalité, la constante de proportionnalité est connu comme le ébullioscopique constante (K b) et est caractéristique de chaque solvant. Si w représente le fraction massique du soluté dans la solution, et en l'absence de dissociation du soluté, la masse molaire est donnée par
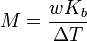 .
.