
Bioquímica
Acerca de este escuelas selección Wikipedia
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
Bioquímica (de Griego : βίος, bios, "vida" y Kēme egipcio, "Tierra") es el estudio de los químicos en los procesos que viven los organismos . Se trata de la la estructura y función de los componentes celulares, tales como proteínas , hidratos de carbono , lípidos , ácidos nucleicos, y otra biomoléculas. Biología química pretende dar respuesta a muchas preguntas que surge de la bioquímica mediante el uso de herramientas desarrolladas dentro síntesis química.
Aunque hay un gran número de diferentes biomoléculas, muchos son moléculas complejas y grandes (llamados polímeros) que se componen de subunidades de repetición similares (llamados monómeros). Cada clase de biomoléculas polimérico tiene un conjunto diferente de los tipos de subunidades. Por ejemplo, una proteína es un polímero formado por 20 o más aminoácidos . Bioquímica estudia las propiedades químicas de importantes moléculas biológicas, como proteínas, en particular la química de enzima catalizadas reacciones .
La bioquímica de la célula metabolismo y la sistema endocrino se ha descrito ampliamente. Otras áreas de la bioquímica incluyen el código genético ( ADN , RNA), síntesis de proteínas, membrana celular de transporte , y transducción de señales.
Este artículo sólo se discute la bioquímica terrestre ( carbono - y agua basado), ya que todas las formas de vida que conocemos están en la Tierra . Desde las formas vivas de la vida hoy en día son la hipótesis por la mayoría que descienden de la misma ancestro común, tienen bioquímicas similares, incluso para los asuntos que parecen ser esencialmente arbitraria, como uso de las manos de varias biomoléculas. Se desconoce si bioquímicas alternativas son posible o práctico.
Historia

Originalmente, se creía generalmente que la vida no estaba sujeto a las leyes de la ciencia de la forma en que no era la vida. Se pensaba que los seres vivos sólo podían producir las moléculas de la vida (de otras biomoléculas, previamente existentes). Luego, en 1828, Friedrich Wöhler publicó un documento sobre la síntesis de la urea , lo que demuestra que orgánicos compuestos pueden ser creados artificialmente.
El amanecer de la bioquímica puede haber sido el descubrimiento de la primera enzima, diastasa (hoy amilasa), en 1833 por Anselme Payen. Eduard Buchner contribuyó la primera demostración de un complejo proceso bioquímico exterior de una célula en 1896: fermentación alcohólica en extractos de células de levadura. Aunque el término "bioquímica" parece haber sido utilizado por primera vez en 1882, en general se acepta que la moneda oficial de la bioquímica se produjo en 1903 por Carl Neuberg, un alemán químico. Anteriormente, esta área habría sido referido como la química fisiológica . Desde entonces, la bioquímica ha avanzado, especialmente desde la mitad del siglo 20, con el desarrollo de nuevas técnicas como la cromatografía , Difracción de rayos X, Espectroscopía de RMN, marcaje con radionúclidos, microscopía electrónica y simulaciones de dinámica molecular. Estas técnicas permitieron el descubrimiento y análisis detallado de muchas moléculas y vías metabólicas de la célula , tales como la glucólisis y la Ciclo de Krebs (ciclo de ácido cítrico).
Otro acontecimiento histórico significativo en la bioquímica es el descubrimiento de la gen y su papel en la transferencia de información en la célula. Esta parte de la bioquímica se llama a menudo biología molecular. En la década de 1950, James D. Watson , Francis Crick , Rosalind Franklin, y Maurice Wilkins fueron clave en la solución de la estructura del ADN y sugiriendo su relación con la transferencia genética de la información. En 1958, George Beadle y Edward Tatum recibió el Premio Nobel por el trabajo en los hongos que muestran que un gen produce una enzima. En 1988, Colin Pitchfork fue la primera persona declarada culpable de asesinato con ADN pruebas, lo que llevó al crecimiento de ciencia forense. Más recientemente, Andrew Z. Fire y Craig C. Mello recibió el Premio Nobel 2006 por descubrir el papel de ARN de interferencia ( RNAi), en el silenciamiento de la expresión génica.
Hoy en día, hay tres tipos principales de bioquímica establecidos por Michael E. Azúcar. Bioquímica de las plantas implica el estudio de la bioquímica de organismos autótrofos tales como la fotosíntesis y otros vegetales específicas bioquímicas procesos. Bioquímica general abarca tanto la bioquímica vegetal y animal. La bioquímica humana / médica / medicinal se centra en la bioquímica de los seres humanos y enfermedades médicas.
Los hidratos de carbono
La función de los hidratos de carbono incluye almacenamiento de energía y proporcionar estructura. Los azúcares son carbohidratos, pero no todos los carbohidratos son azúcares. Hay más hidratos de carbono en la Tierra que cualquier otro tipo conocido de biomolécula.
Los monosacáridos
El tipo más simple de hidratos de carbono es una monosacárido, que entre otras propiedades contiene carbono, hidrógeno , y oxígeno , principalmente en una proporción de 1: 2: 1 (generalizada fórmula C n H 2 n O n, donde n es al menos 3). La glucosa , uno de los más importantes hidratos de carbono, es un ejemplo de un monosacárido. Asi es fructosa, el azúcar que da frutos su sabor dulce. Algunos carbohidratos (especialmente después la condensación de oligo- y polisacáridos) contiene menos carbono con respecto a H y O, que todavía están presentes en 2: 1 (H: O) ratio. Los monosacáridos se pueden agrupar en aldosas (que tiene una grupo aldehído en el extremo de la cadena, por ejemplo, glucosa) y cetosas (que tiene un ceto grupo en su cadena; por ejemplo, fructosa). Ambos aldosas y cetosas se producen en un equilibrio entre las formas de cadena abierta y (empezando con longitudes de cadena de C4) formas cíclicas. Estos son generados por la formación del enlace entre uno de los grupos hidroxilo de la cadena de azúcar con el carbono del grupo aldehído o ceto para formar una enlace hemiacetal. Esto conduce a saturado de cinco miembros (en furanosas) o seis miembros (en piranosas) anillos heterocíclicos que contienen uno O como heteroátomo.
Los disacáridos

Dos monosacáridos se pueden unir juntos utilizando síntesis de la deshidratación, en el que se elimina un átomo de hidrógeno desde el extremo de una molécula y una grupo hidroxilo (-OH) se retira de la otra; los residuos restantes se adjuntan en los sitios de los que se retiraron los átomos. El H-OH o H 2 O se libera entonces como una molécula de agua , de ahí el término deshidratación. La nueva molécula, que consiste en dos monosacáridos, se denomina disacárido y está unido entre sí por un glicosídico o enlace éter . También se puede producir la reacción inversa, usando una molécula de agua para dividir un disacárido y romper el enlace glicosídico; esto se denomina hidrólisis. El disacárido más conocido es la sacarosa , ordinario de azúcar (en contextos científicos, llamada azúcar de mesa o azúcar de caña para diferenciarlo de otros azúcares). La sacarosa se compone de una molécula de glucosa y una molécula de fructosa unidas entre sí. Otro disacárido es importante lactosa, que consiste en una molécula de glucosa y una molécula de galactosa. Como la mayoría de los seres humanos de edad, la producción de lactasa, la enzima que hidroliza la lactosa en glucosa y galactosa, típicamente disminuye. Esto da lugar a deficiencia de lactasa, también llamada intolerancia a la lactosa.
Polímeros de azúcar se caracterizan por tener la reducción o extremos no reductores. La la reducción final de un hidrato de carbono es un átomo de carbono que puede estar en equilibrio con la cadena abierta aldehído o forma ceto. Si la unión de monómeros tiene lugar en un átomo de carbono tales, el grupo hidroxi libre de la piranosa o forma de furanosa se intercambia con una cadena-OH lado de otro azúcar, produciendo una completa acetal. Esto impide la apertura de la cadena a la forma aldehído o ceto y hace que el residuo modificado no reductor. La lactosa contiene un extremo reductor en su resto de glucosa, mientras que el resto de galactosa formar un acetal completo con el grupo C4-OH de la glucosa. Sacarosa no tiene un extremo reductor a causa de la formación de acetal completo entre el carbono aldehído de glucosa (C1) y la ceto de carbono de la fructosa (C2).
Los oligosacáridos y polisacáridos
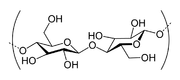
Cuando unos pocos (alrededor de tres a seis) monosacáridos se unen entre sí, que se llama una oligosacáridos (oligo significa "pocos"). Estas moléculas tienden a ser utilizados como marcadores y señales, así como tener algunos otros usos.
Muchos monosacáridos unidos juntos hacen una polisacárido. Ellos se pueden unir en una cadena lineal larga, o pueden ser ramificados. Dos de los más comunes son polisacáridos celulosa y glucógeno, tanto consiste en la repetición de la glucosa monómeros.
- La celulosa es hecho por las plantas y es un componente estructural importante de su paredes celulares. Los humanos no pueden fabricar ni digerirla.
- El glucógeno, por otro lado, es un animal de hidratos de carbono; los seres humanos y otros animales lo utilizan como una forma de almacenamiento de energía.
Proteínas

Al igual que los hidratos de carbono, algunas proteínas cumplen funciones en gran medida estructurales. Por ejemplo, los movimientos de las proteínas actina y miosina en última instancia, son responsables de la contracción del músculo esquelético. Una propiedad muchas proteínas tienen es que se unen específicamente a una molécula o clase de cierta moléculas que pueden ser muy selectivos en lo que se unen. Los anticuerpos son un ejemplo de las proteínas que se unen a un tipo específico de molécula. De hecho, la ensayo de inmunoabsorción ligado a enzimas (ELISA), que utiliza anticuerpos, es actualmente una de las pruebas más sensibles medicina moderna utiliza para detectar diversas biomoléculas. Es probable que las proteínas más importantes, sin embargo, son los enzimas. Estas moléculas sorprendentes reconocen moléculas reaccionantes específicas llamadas sustratos; A continuación, catalizan la reacción entre ellos. Al disminuir la energía de activación , la enzima que acelera la reacción por una tasa de 10 11 o más: una reacción que normalmente tomar más de 3.000 años para completar de forma espontánea puede tardar menos de un segundo con una enzima. La enzima en sí no se utiliza en el proceso, y es libre para catalizar la misma reacción con un nuevo conjunto de sustratos. Utilizando diversos modificadores, la actividad de la enzima puede ser regulada, lo que permite el control de la bioquímica de la célula como un todo.
En esencia, las proteínas son cadenas de aminoácidos . Un aminoácido consiste en un átomo de carbono unido a cuatro grupos. Uno es un amino grupo, -NH 2, y uno es un ácido carboxílico grupo, -COOH (aunque éstos existen como -NH 3 + y -COO - en condiciones fisiológicas). El tercero es un simple hidrógeno átomo. El cuarto es comúnmente denotado "-R" y es diferente para cada aminoácido. Hay veinte aminoácidos estándar. Algunos de estos tienen funciones por sí mismos o en una forma modificada; por ejemplo, funciones de glutamato como un importante neurotransmisor.
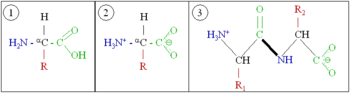
Los aminoácidos se pueden unir a través de una enlace peptídico. En esta síntesis de la deshidratación, se elimina una molécula de agua y el enlace peptídico conecta el nitrógeno del grupo amino de un aminoácido con el carbono del grupo ácido carboxílico de la otra. La molécula resultante se llama una dipéptidos y cortos tramos de aminoácidos (por lo general, menos de alrededor de treinta) se denominan péptidos o polipéptidos. Tramos más largos merecen las proteínas título. Como un ejemplo, la sangre importante proteína de suero albúmina contiene 585 residuos de aminoácidos.
La estructura de las proteínas se describe tradicionalmente en una jerarquía de cuatro niveles. La estructura primaria de una proteína consiste simplemente en su secuencia lineal de aminoácidos; por ejemplo, "alanina-glicina-triptófano-serina-glutamato-asparagina-glicina-lisina ...". Estructura secundaria se ocupa de la morfología local. Algunas combinaciones de aminoácidos tienden a acurrucarse en una bobina llamada α-hélice o en una hoja llamada una β-hoja; algunos α-hélices se pueden ver en el esquema de hemoglobina por encima. La estructura terciaria es la totalidad de la forma tridimensional de la proteína. Esta forma está determinada por la secuencia de aminoácidos. De hecho, un solo cambio puede cambiar toda la estructura. La cadena alfa de la hemoglobina contiene 146 residuos de aminoácidos; sustitución de la residuo de glutamato en la posición 6 con una residuo de valina cambia el comportamiento de la hemoglobina tanto que resulta en la enfermedad de células falciformes . Finalmente estructura cuaternaria se refiere a la estructura de una proteína con múltiples subunidades peptídicas, como la hemoglobina, con sus cuatro subunidades. No todas las proteínas tienen más de una subunidad.
Proteínas ingeridas por lo general se dividen en aminoácidos individuales o dipéptidos en el intestino delgado, y luego absorbida. Entonces se pueden unir para hacer nuevas proteínas. Los productos intermedios de la glucólisis, el ciclo del ácido cítrico, y el vía del fosfato de pentosa puede ser utilizado para hacer los veinte aminoácidos, y la mayoría de las bacterias y plantas poseen todas las enzimas necesarias para sintetizar ellos. Los seres humanos y otros mamíferos, sin embargo, sólo pueden sintetizar medio de ellos. Ellos no pueden sintetizar isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano, y valina. Estos son los aminoácidos esenciales, ya que es esencial para ingerirlos. Los mamíferos poseen las enzimas para sintetizar alanina, asparagina, aspartato, cisteína, glutamato, glutamina, glicina, prolina, serina, y tirosina, los aminoácidos no esenciales. Mientras que pueden sintetizar arginina y histidina, que no puede producirla en cantidades suficientes para los jóvenes, los animales en crecimiento, y por lo que estos son a menudo considerados los aminoácidos esenciales.
Si el grupo amino se retira de un aminoácido, que deja tras de un esqueleto de carbono llamado un α- cetoácido. Enzimas llamadas transaminasas pueden transferir fácilmente el grupo amino de un aminoácido (lo que es un ácido α-ceto) a otro ácido α-ceto (lo que es un aminoácido). Esto es importante en la biosíntesis de aminoácidos, como para muchas de las vías, los compuestos intermedios de otras rutas bioquímicas se convierten en el esqueleto de ácido α-ceto, y después se añade un grupo amino, a menudo a través transaminación. Los aminoácidos pueden entonces ser unidos entre sí para formar una proteína.
Un proceso similar se utiliza para descomponer las proteínas. Se hidroliza primero en sus aminoácidos componentes. Libre de amoniaco (NH 3), existente como ion amonio (NH4 +) en la sangre, es tóxico para las formas de vida. Un método adecuado para excretar por lo tanto, debe existir. Diferentes estrategias han evolucionado en diferentes animales, dependiendo de las necesidades de los animales. Los organismos unicelulares, por supuesto, simplemente liberar el amoníaco en el medio ambiente. Del mismo modo, peces óseos pueden liberar el amoniaco en el agua donde se diluye rápidamente. En general, los mamíferos convierten el amoníaco en urea, a través de la ciclo de la urea.
Lípidos
El término lípido comprende una amplia gama de moléculas y en cierta medida es un cajón de sastre para relativamente insoluble en agua o los compuestos no polares de origen biológico, incluyendo ceras, ácidos grasos , derivados de ácidos grasos fosfolípidos, esfingolípidos, glicolípidos y terpenoides (por ejemplo. retinoides y esteroides). Algunos lípidos son lineales moléculas alifáticos, mientras que otros tienen estructuras de anillo. Algunos son aromáticos, mientras que otros no lo son. Algunos son flexibles, mientras que otros son rígidos.
La mayoría de los lípidos tienen algún carácter polar, además de ser en gran parte no polar. En general, la mayor parte de su estructura es no polar o hidrofóbico ("temeroso de agua"), lo que significa que no interactúa bien con solventes polares como el agua. Otra parte de su estructura es polar o hidrofílico ("amante del agua") y tenderá a asociarse con solventes polares como el agua. Esto les hace moléculas anfifílicas (que tiene tanto porciones hidrófobas e hidrófilas). En el caso de colesterol, el grupo polar es un mero -OH ( hidroxilo o alcohol). En el caso de los fosfolípidos, los grupos polares son considerablemente más grandes y más polar, como se describe a continuación.
Los lípidos son una parte integral de nuestra dieta diaria. Más aceites y los productos lácteos que usamos para cocinar y comer como la mantequilla , el queso , ghee, etc., se componen de grasas. Los aceites vegetales son ricos en varios ácidos grasos poliinsaturados (PUFA). Alimentos que contienen lípidos se someten a la digestión en el cuerpo y se rompen en ácidos grasos y glicerol, que son los productos de degradación finales de grasas y lípidos.
Ácidos nucleicos
Un ácido nucleico es una, bioquímica de alto peso molecular del complejo macromolécula compuesta de cadenas de nucleótidos que transmiten la información genética. Los ácidos nucleicos más comunes son el ácido desoxirribonucleico (ADN) y ácido ribonucleico ( RNA). Los ácidos nucleicos se encuentran en todas las células vivas y virus. Aparte del material genético de la célula, los ácidos nucleicos a menudo desempeñan un papel como segundos mensajeros, así como la formación de la molécula base de trifosfato de adenosina , la molécula de portador de energía primaria encuentran en todos los organismos vivos.
Ácidos nucleicos, llamada así por su prevalencia en celular núcleos, es el nombre genérico de la familia de biopolímeros. Los monómeros se denominan nucleótidos, y cada uno consta de tres componentes: un heterocíclico nitrogenado base (ya sea una purina o una pirimidina), una pentosa de azúcar , y una grupo fosfato. Los diferentes tipos de ácidos nucleicos difieren en el azúcar específica que se encuentra en su cadena (por ejemplo, ADN o ácido desoxirribonucleico contiene 2- desoxirribosas). Además, las bases nitrogenadas posibles en los dos ácidos nucleicos son diferentes: adenina, citosina, y guanina se producen tanto en el ARN y el ADN, mientras timina se produce sólo en el ADN y uracilo se produce en el ARN.
Relación con otras ciencias biológicas "a escala molecular"
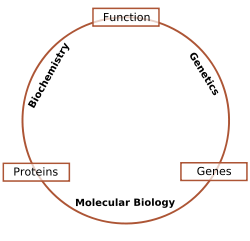
Los investigadores en bioquímica utilizan técnicas específicas propias de la bioquímica, pero cada vez se combinan éstos con técnicas e ideas de la genética , biología molecular y biofísica. Nunca ha habido una línea dura entre estas disciplinas en cuanto a contenido y técnica, pero los miembros de cada disciplina en el pasado han sido muy territorial; hoy los términos de biología molecular y bioquímica son casi intercambiables. La siguiente figura es un esquema que representa una posible visión de la relación entre los campos:
- La bioquímica es el estudio de las sustancias químicas y los procesos vitales que ocurren en que viven los organismos . Los bioquímicos se centran en gran medida en el papel, la función y la estructura de biomoléculas. El estudio de la química detrás de los procesos biológicos y la síntesis de moléculas biológicamente activas son ejemplos de la bioquímica.
- La genética es el estudio del efecto de las diferencias genéticas en los organismos. A menudo, esto se puede deducir por la ausencia de un componente normal (por ejemplo, una gen). El estudio de " mutantes "- organismos que carecen de uno o más componentes funcionales con respecto a la llamada" tipo salvaje "o normal fenotipo. Interacciones genéticas ( epistasis) a menudo puede confundir interpretaciones simples de este tipo de estudios "knock-out".
- La biología molecular es el estudio de las bases moleculares del proceso de replicación, transcripción y traducción de la material genético. La dogma central de la biología molecular en que el material genético se transcribe en ARN y luego traduce en proteína, a pesar de ser una imagen simplificada de la biología molecular, todavía ofrece un buen punto de partida para comprender el campo. Esta imagen, sin embargo, se halla en revisión a la luz de nuevos roles para los emergentes RNA.
- Biología Química busca desarrollar nuevas herramientas basadas en pequeñas moléculas que permiten la perturbación mínima de los sistemas biológicos mientras que proporciona información detallada acerca de su función. Además, biología química emplea sistemas biológicos para crear híbridos no naturales entre biomoléculas y dispositivos sintéticos (por ejemplo vaciado cápsides virales que pueden ofrecer terapia génica o moléculas de fármaco).


