
Staphylococcus aureus
Sabías ...
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. Madres SOS cada aspecto después de un una familia de niños apadrinados .
| Staphylococcus aureus | |
|---|---|
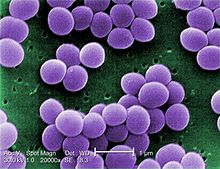 | |
| Micrografía electrónica de barrido de S. aureus; falso color agregó. | |
| Clasificación científica | |
| Dominio: | Bacterias |
| Reino: | Eubacterias |
| Filo: | Firmicutes |
| Clase: | Bacilos |
| Orden: | Bacillales |
| Familia: | Staphylococcaceae |
| Género: | Estafilococo |
| Especie: | S. aureus |
| Nombre binomial | |
| Staphylococcus aureus Rosenbach 1884 | |
Staphylococcus aureus es una bacteria que es un miembro de la Firmicutes, y se encuentra frecuentemente en el tracto respiratorio humano y en la piel. Aunque S. aureus no es siempre patógena, es una causa común de infecciones de la piel (por ejemplo, forúnculos), enfermedades respiratorias (por ejemplo, sinusitis), y comida envenenada. Cepas Enfermedades asociadas a menudo promueven las infecciones mediante la producción de proteína potente toxinas, y que expresan proteínas de la superficie celular que unirse e inactivar los anticuerpos. La aparición de formas resistentes a los antibióticos de patógenos S. aureus (por ejemplo, MRSA) es un problema en todo el mundo en la medicina clínica.
Staphylococcus se identificó por primera vez en Aberdeen , Escocia (1880) por la cirujano Sir Alexander Ogston en pus de un absceso, en una articulación de la rodilla. Este nombre más tarde se anexó a Staphylococcus aureus por Rosenbach que fue acreditado por el sistema oficial de nomenclatura en el tiempo. Se estima que 20% de la población humana son portadores a largo plazo de S. aureus que se puede encontrar como parte de la normal de flora de la piel y en las fosas nasales anteriores de los pasajes nasales. S. aureus es la especie más común de Staphylococcus para causar Las infecciones por estafilococos y es un patógeno éxito debido a una combinación de transporte nasal y estrategias inmuno-evasiva bacterianas. S. aureus puede causar una variedad de enfermedades, desde leves de la piel infecciones , tales como espinillas, impétigo, forúnculos (forúnculos), foliculitis celulitis, ántrax, síndrome de la piel escaldada, y abscesos, a las enfermedades que amenazan la vida tales como la neumonía , la meningitis , osteomielitis, endocarditis, El síndrome de shock tóxico (SST), bacteriemia y sepsis. Su incidencia varía de piel, tejidos blandos, respiratorias, huesos, articulaciones, endovascular para infecciones de la herida . Sigue siendo una de las cinco causas más comunes de infecciones nosocomiales y es a menudo la causa de las infecciones de heridas postquirúrgicas. Cada año, unos 500.000 pacientes en los hospitales estadounidenses contraen una infección estafilocócica.
| Staphylococcus aureus | |
|---|---|
| Clasificación y recursos externos | |
| CIE- 9 | 041,11 |
Microbiología

S. aureus (pron .: / ˌ s t æ F ɨ l ɵ k ɒ k ə s ɔr yo ə s /, griego σταφυλόκοκκος, "baya de la uva-cluster", América aureus, "de oro") es un anaerobio facultativo Gram-positivo cocos bacteria , también conocida como "estafilococo dorado" y Oro staphira.
En la literatura médica las bacterias se refiere a menudo como S. aureus o estafilococo aureus. Staphylococcus no se debe confundir con el nombre similar y médicamente relevante género Streptococcus. S. aureus aparece como racimos de uva-como cuando se ve a través de un microscopio, y tiene grandes, redondas, colonias de color amarillo dorado, a menudo con hemólisis, cuando se cultivan en placas de agar sangre. S. reproduce aureus asexualmente por fisión binaria. Las dos células hijas no se separan completamente y permanecen unidos el uno al otro. Es por ello que se observan las células en racimos.
S. aureus es catalasa-positivos (lo que significa que se puede producir la enzima catalasa), por lo que es capaz de convertir peróxido de hidrógeno (H 2 O 2) en agua y oxígeno. Esta prueba se utiliza a veces para distinguir estafilococos de enterococos y estreptococos. Anteriormente S. aureus fue diferenciarse de otros estafilococos por el prueba de la coagulasa. Sin embargo, ahora se sabe que no todos S. aureus son coagulasa positivo y que la identificación de especies incorrecto puede afectar las medidas de tratamiento y de control eficaces.
Papel en la enfermedad

S. aureus es responsable de muchas infecciones pero también puede ocurrir como comensal. La presencia de S. aureus no siempre indica infección. S. aureus puede sobrevivir de horas a semanas o incluso meses, en superficies ambientales secas, dependiendo de la cepa.
S. aureus puede infectar los tejidos cuando la piel o las barreras mucosas han sido violados. Esto puede conducir a muchos tipos diferentes de infecciones, incluyendo forúnculos y ántrax (una colección de forúnculos). En los bebés, S. aureus infección puede causar una enfermedad grave - síndrome de la piel escaldada estafilocócica (SSSS).
Infecciones por S. aureus se pueden propagar a través del contacto con el pus de una herida infectada, el contacto piel a piel con una persona infectada por la producción hialuronidasa que destruye los tejidos, y el contacto con objetos como toallas, sábanas, ropa o equipo deportivo utilizado por una persona infectada. Profundamente penetrante S. infecciones por S. aureus pueden ser graves. Prótesis articulares poner a una persona en riesgo particular de artritis séptica, y estafilococos endocarditis (infección de las válvulas del corazón) y la neumonía . S. aureus puede albergar fagos, tales como Panton-Valentine leucocidina, que aumentan su virulencia.
Dermatitis atópica
S. aureus es extremadamente frecuente en pacientes con dermatitis atópica. Se encuentra sobre todo en lugares fértiles activos, incluyendo las axilas, el pelo y el cuero cabelludo. Granos grandes que aparecen en esas áreas pueden exacerbar la infección si lacerado. Esto puede conducir a síndrome de la piel escaldada estafilocócica (SSSS). Una forma grave de esto, Enfermedad de Ritter, se puede observar en los recién nacidos.
Infecciones en animales
S. aureus puede sobrevivir en perros, gatos y caballos, y puede causar Bumblefoot en pollos. S. aureus es uno de los agentes causales de mastitis en lácteos vacas . Su gran cápsula de polisacáridos protege el organismo de reconocimiento por parte de las defensas inmunológicas de la vaca.
Los factores de virulencia
Enzimas
Se produce varias enzimas tales como coagulasa (atado y coagulases libres) que coagula el plasma y abrigos de la célula bacteriana que probablemente prevenir fagocitosis. Hialuronidasa también conocido como factor de ensanchamiento que la degradación de ácido hialurónico y ayuda en la difusión de Staphylococcus aureus. S. aureus también produce DNAsa ( desoxirribonucleasa) que desglose el ADN.
Toxinas
Dependiendo de la cepa, S. aureus es capaz de secretar varias exotoxinas, que pueden clasificarse en tres grupos. Muchas de estas toxinas están asociados con enfermedades específicas.
- Superantígenos
- (PTSAgs) tienen superantígeno actividades que inducen El síndrome de shock tóxico (SST). Este grupo incluye la toxina TSST-1, que causa TSS asociado con el uso de tampones. Este se caracteriza por fiebre, erupción eritematosa, hipotensión, shock, insuficiencia orgánica múltiple, y la piel descamación. La falta de anticuerpo para TSST-1 desempeña un papel en la patogénesis del síndrome de choque tóxico. Otras cepas de S. aureus puede producir una enterotoxina que es el agente causante de S. gastroenteritis aureus. Esta gastroenteritis es autolimitada, caracterizada por vómitos y diarrea una a seis horas después de la ingestión de la toxina con la recuperación de cada ocho a 24 horas. Los síntomas incluyen náuseas, vómitos, diarrea y dolor abdominal importante.
- Toxinas exfoliativa
- EF toxinas están implicados en la enfermedad estafilocócica Síndrome de la piel escaldada (SSSS), que se presenta con mayor frecuencia en bebés y niños pequeños. También puede ocurrir que las epidemias en los viveros del hospital. La actividad de la proteasa de las toxinas exfoliativas causa descamación de la piel observado con SSSS.
- Otras toxinas
- Toxinas estafilocócicas que actúan sobre las membranas celulares incluyen toxina alfa, toxina beta, toxina delta, y varias toxinas de dos componentes. La toxina bicomponente Panton-Valentine leucocidina (PVL) se asocia con neumonía necrotizante grave en los niños. Los genes que codifican los componentes de PVL se codifican en una bacteriófago que se encuentra en la comunidad asociada resistente a la meticilina S. aureus (MRSA) cepas.
Otras estrategias immunoevasive
- Proteína A
La proteína A es anclado a estafilocócica puentes pentaglicina peptidoglicano (cadenas de cinco residuos de glicina) por el transpeptidasa sortase A. Proteína A, una Proteína de unión a IgG, se une a la Región Fc de un anticuerpo . De hecho, los estudios que implican la mutación de genes que codifican para la proteína A dio como resultado una virulencia reducida de S. aureus, medida por la supervivencia en la sangre, lo que ha llevado a la especulación de que la proteína A-contribuido virulencia requiere la unión de las regiones Fc de anticuerpos.
Proteína A en diversas formas recombinantes ha sido utilizado durante décadas para atar y purificar una amplia gama de anticuerpos por cromatografía de inmunoafinidad. Transpeptidasas, como los sortases responsables de factores como la proteína A anclaje al peptidoglicano estafilocócica, se están estudiando con la esperanza de desarrollar nuevos antibióticos para apuntar Las infecciones por SARM.
- Pigmentos estafilococos
Algunas cepas de S. aureus son capaces de producir estafiloxantina - de color un oro carotenoide pigmento . Este pigmento actúa como una factor de virulencia, principalmente por ser un bacteriana antioxidante que ayuda al microbio evadir la especies de oxígeno reactivo que el sistema inmune del huésped utiliza para matar los patógenos.
Cepas mutantes de S. aureus modificarse para carecer de estafiloxantina tienen menos probabilidades de sobrevivir incubación con una sustancia química oxidante, tal como peróxido de hidrógeno que las cepas pigmentadas. Colonias mutantes mueren rápidamente cuando se expone a humana los neutrófilos, mientras que muchas de las colonias pigmentadas sobreviven. En ratones, las cepas pigmentadas causar persistente abscesos cuando se inocula en las heridas, mientras que las heridas infectadas con las cepas no pigmentadas se curan rápidamente.
Estas pruebas sugieren que las cepas de Staphylococcus utilizan estafiloxantina como una defensa contra el sistema inmunológico humano normal. Los medicamentos diseñados para inhibir la producción de estafiloxantina puede debilitar la bacteria y renovar su susceptibilidad a los antibióticos. De hecho, debido a las similitudes en las vías para la biosíntesis de estafiloxantina y humana colesterol, un fármaco desarrollado en el contexto de la terapia reductora del colesterol fue mostrado para bloquear S. aureus pigmentación y progresión de la enfermedad en una modelo de ratón de infección.
Diagnóstico Clásica

Dependiendo del tipo de infección presente, una muestra adecuada se obtiene en consecuencia y se envía al laboratorio para la identificación definitiva mediante el uso de pruebas bioquímicas o basados en enzimas. La Tinción de Gram se realiza primero para guiar el camino, que debe mostrar típica Las bacterias gram-positivos, cocos, en racimos. En segundo lugar, el aislado es cultivaron en agar sal manitol, que es un medio selectivo con 7-9% de NaCl que permite S. aureus para crecer, la producción de colonias de color amarillo como resultado de la fermentación de manitol y la posterior caída en el medio de pH.
Por otra parte, para la diferenciación a nivel de especies, catalasa (positivo para todas las especies de Staphylococcus), coagulasa ( la formación de coágulos de fibrina, positivo para S. aureus), DNAsa (espacio libre en agar DNasa), lipasa (una de color amarillo y olor rancio olor), y fosfatasa (una de color rosa) las pruebas se puede hacer todo. Para la intoxicación alimentaria estafilocócica, tipificación de fagos se puede realizar para determinar si los estafilococos recuperado de la comida eran la fuente de infección.
El diagnóstico rápido y escribiendo
Los laboratorios de microbiología de diagnóstico y laboratorios de referencia son la clave para la identificación de los brotes y las nuevas cepas de S. aureus. Avances genéticos recientes han permitido técnicas fiables y rápidos para la identificación y caracterización de aislados clínicos de S. aureus en tiempo real. Estas estrategias de apoyo herramientas de control de infecciones para limitar la propagación de bacterias y garantizar el uso adecuado de los antibióticos. PCR en tiempo real se está empleando cada vez más en los laboratorios clínicos como una técnica para la identificación de los brotes.
Tratamiento y resistencia a los antibióticos
El tratamiento de elección para S. aureus es la infección penicilina; en la mayoría de los países, sin embargo, la resistencia a la penicilina es muy común, y la terapia de primera línea es más comúnmente una β-lactámicos antibióticos penicilinasa-resistentes (por ejemplo, oxacilina o flucloxacillin). La terapia de combinación con gentamicina puede ser utilizado para tratar infecciones graves, tales como endocarditis, pero su uso es controvertido, debido al alto riesgo de daño a los riñones. La duración del tratamiento depende del sitio de la infección y de la gravedad.
Resistencia a antibióticos en S. aureus era raro cuando la penicilina se introdujo por primera vez en 1943. De hecho, el plato original de Petri en la que Alexander Fleming de Imperial College de Londres observó la actividad antibacteriana de la Hongo Penicillium crecía un cultivo de S. aureus. En 1950, el 40% de los hospitales S. aureus eran resistentes a la penicilina; y, en 1960, esta cifra había aumentado a 80%.
Resistente a la meticilina S. aureus, abreviado MRSA y, a menudo pronunciado / m ɜr s ə / O / ɛ m ɑː ɛ s eɪ /, Es una de una serie de cepas grandemente temidos de S. aureus que se han vuelto resistentes a la mayoría de los antibióticos β-lactámicos. Cepas de SARM se encuentran más frecuentemente asociados con instituciones como hospitales, pero son cada vez más frecuentes en las infecciones adquiridas en la comunidad. Un estudio reciente de la Traslacional Genomics Research Institute mostró que casi la mitad (47%) de la carne y las aves de corral en los Estados Unidos las tiendas de comestibles estaban contaminados con S. aureus, con más de la mitad (52%) de las bacterias resistentes a los antibióticos.
| Wikinoticias tiene noticias relacionadas: Muertes Supergerm disparan, superan el SIDA en los Estados Unidos |
- El artículo Staphylococcus aureus resistente a la meticilina contiene información relacionada sobre este tema
Investigadores italianos han identificado un bacteriófago activo contra S. aureus, incluyendo cepas resistentes a la meticilina (MRSA), en ratones y, posiblemente, los seres humanos.
Mecanismos de resistencia a los antibióticos

La resistencia a la penicilina estafilocócica está mediada por penicilinasa (una forma de β-lactamasa) producción: una enzima que escinde las anillo de β-lactama de la molécula de penicilina, haciendo que el antibiótico ineficaz. Antibióticos β-lactámicos penicilinasa-resistentes, tales como meticilina, nafcilina, oxacilina, cloxacilina, dicloxacilina, flucloxacilina y, son capaces de resistir la degradación por penicilinasa estafilocócica.
La resistencia a la meticilina está mediada a través de la mec operón, parte de la casete estafilocócica cromosoma mec (SCC mec). La resistencia se confiere por el gen mecA, que codifica una alterados proteína de unión a penicilina (o PBP2a PBP2 ') que tiene una menor afinidad por la unión β-lactámicos (penicilinas, cefalosporinas, y carbapenems). Esto permite que para la resistencia a todos los antibióticos β-lactámicos, y evita su uso clínico durante las infecciones por SARM. Como tal, el glucopeptídico vancomicina es frecuentemente usado contra MRSA.
Los antibióticos aminoglucósidos, tales como kanamicina, gentamicina, estreptomicina, etc., una vez fueron efectivos contra las infecciones por estafilococos hasta cepas desarrollaron mecanismos para inhibir la acción de los aminoglucósidos, que se produce a través de amina protonada y / o interacciones con el hidroxilo ARN ribosomal de la bacteriana Subunidad 30S ribosomal Hay tres mecanismos principales de mecanismos de resistencia a los aminoglucósidos que se aceptan actualmente y ampliamente: las enzimas aminoglucósidos modificar, mutaciones ribosomal, y activa eflujo del fármaco fuera de la bacteria.
Enzimas modificadoras de aminoglucósidos inactivar el aminoglucósido por la unión covalente ya sea una fosfato, de nucleótidos, o acetil resto a cualquiera de la amina o el grupo funcional clave alcohol (o ambos grupos) del antibiótico. Esto cambia la carga o dificulta estéricamente el antibiótico, disminuyendo su afinidad de unión ribosomal. En S. aureus, la enzima aminoglucósido modificadores mejor caracterizada es aminoglucósidos adeniltransferasa 4 'IA (ANT (4') IA). Esta enzima ha sido resuelto por cristalografía de rayos x. La enzima es capaz de adjuntar una resto ciclasa para el grupo hidroxilo 4 'de muchos aminoglucósidos, incluyendo kamamycin y gentamicina.
Resistencia a glicopéptidos es mediada por la adquisición del gen vanA. El gen vanA origina a partir de la enterococos y códigos para una enzima que produce una alternativa peptidoglicano a la cual vancomicina no se unirá.
Hoy en día, S. aureus se ha convertido resistentes a muchos antibióticos usados comúnmente. En el Reino Unido, sólo el 2% de todos los S. aureus aislados son sensibles a la penicilina, con una imagen similar en el resto del mundo. Las penicilinas β-lactamasas resistentes (meticilina, oxacilina, cloxacilina y la flucloxacilina) fueron desarrollados para tratar resistente a la penicilina S. aureus, y todavía se utiliza como tratamiento de primera línea. Meticilina fue el primer antibiótico en esta clase a utilizar (que se introdujo en 1959), pero, sólo dos años después, se reportó el primer caso de MRSA en Inglaterra.
A pesar de esto, el SARM en general sigue siendo un hallazgo poco común, incluso en el ámbito hospitalario, hasta la década de 1990, cuando se produjo una explosión en la prevalencia de SARM en los hospitales, donde está ahora endémica.
Infecciones por SARM en el hospital y entorno de la comunidad se tratan comúnmente con antibióticos no β-lactámicos, tales como clindamicina (a lincosamine) y cotrimoxazol (también conocido comúnmente como trimetoprima / sulfametoxazol). La resistencia a estos antibióticos también ha llevado al uso de antibióticos nuevos, de amplio espectro anti-Gram-positivas, tales como linezolid, debido a su disponibilidad como un medicamento oral. El tratamiento de primera línea para las infecciones invasivas graves por SARM es actualmente antibióticos glicopéptidos ( vancomicina y teicoplanina). Hay una serie de problemas con estos antibióticos, tales como la necesidad de la administración intravenosa (no hay una preparación oral disponible), la toxicidad y la necesidad de controlar los niveles de fármaco regularmente por análisis de sangre. También hay preocupación antibióticos glicopéptidos no penetran muy bien en los tejidos infectados (esta es una preocupación particular con infecciones del cerebro y meninges y en endocarditis). Los glucopéptidos no deben ser utilizados para tratar la meticilina sensible S. aureus (MSSA), ya que los resultados son inferiores.
Debido al alto nivel de resistencia a las penicilinas y debido a la posibilidad de MRSA para desarrollar resistencia a la vancomicina, la Centros para el Control y la Prevención de Enfermedades han publicado pautas para el uso adecuado de la vancomicina. En situaciones donde se sabe que la incidencia de las infecciones por SARM a ser alta, el médico tratante puede elegir usar un glicopéptido de antibióticos hasta que se conozca la identidad del organismo infectante. Después de la infección se confirmó que se debe a una cepa sensible a meticilina de S. aureus, el tratamiento se puede cambiar a flucloxacilina o incluso penicilina, según sea apropiado.
Resistente a la vancomicina S. aureus (VRSA) es una cepa de S. aureus que se ha vuelto resistente a los glicopéptidos. El primer caso de vancomicina intermedia S. aureus (VISA) se informó en Japón en 1996; pero el primer caso de S. aureus verdaderamente resistentes a glucopéptidos antibióticos sólo se informó en 2002. Tres casos de infección EARV había sido reportado en los Estados Unidos a partir de 2005.
Transporte de Staphylococcus aureus
El transporte de Staphylococcus aureus es una fuente importante de infección nosocomial y resistente a la meticilina adquirido en la comunidad S. aureus (MRSA). Aunque S. aureus puede estar presente en la piel del huésped, una gran proporción de su carro es a través de las fosas nasales anteriores de los pasajes nasales. La capacidad de los pasajes nasales para albergar S. aureus resulta de una combinación de una inmunidad del huésped debilitada o defectuoso y capacidad de las bacterias para evadir anfitrión inmunidad innata.
Control de infección
Propagación de S. aureus (incluyendo MRSA) en general es a través del contacto humano a humano, aunque recientemente algunos veterinarios han descubierto que la infección se puede propagar a través de los animales domésticos, con la contaminación ambiental cree que desempeñan un papel relativamente poco importante. Énfasis en la base técnicas de lavado de manos son, por lo tanto, eficaz en la prevención de su transmisión. El uso de delantales y guantes desechables por el personal reduce el contacto de piel a piel y, por lo tanto, reduce aún más el riesgo de transmisión. Por favor, consulte el artículo sobre control de infecciones para más detalles.
Recientemente, se han miríada de casos de S. informó aureus en los hospitales en todo Estados Unidos. El patógeno ha tenido el transporte facilitado en las instalaciones médicas, principalmente debido a insuficiente higiene de los trabajadores de la salud. S. aureus es una bacteria muy resistente, como se demostró en un estudio donde sobrevivió en poliéster para poco menos de tres meses; poliéster es el principal material utilizado en cortinas de privacidad hospital.
Las bacterias son transportadas en las manos de los trabajadores de la salud, que pueden recogerlos de un paciente aparentemente sano que lleva una cepa benigna o comensal de S. aureus y luego pasarlo a la siguiente paciente está siendo tratado. Introducción de las bacterias en el torrente sanguíneo puede conducir a diversas complicaciones, incluyendo, pero no limitado a, endocarditis, meningitis, y, si es generalizada, sepsis.
El etanol ha demostrado ser un desinfectante tópico eficaz contra MRSA. De amonio cuaternario puede ser usado en conjunción con etanol para aumentar la duración de la acción desinfectante. La prevención de la infecciones nosocomiales implica la rutina y limpieza terminal. Vapor de alcohol inflamable en CO 2 Sistemas NAV-CO2 tienen una ventaja, ya que no atacan los metales o plásticos que se utilizan en entornos médicos, y no contribuyen a la resistencia a los antibacterianos.
Un medio importante y no reconocido previamente de la colonización MRSA asociado a la comunidad y la transmisión es durante el contacto sexual.
El personal o los pacientes que se encuentran para llevar a cepas resistentes de S. aureus puede ser obligado a someterse a la "terapia de erradicación", que puede incluir lavados antisépticos y champús (tal como clorhexidina) y la aplicación de ungüentos antibióticos tópicos (tales como mupirocina o neomicina) a la anterior fosas nasales de la nariz.
S. aureus es asesinado en 1 minuto a 78 ° C y 10 minutos a 64 ° C
El aminoácido L-homoarginina no proteico es un inhibidor del crecimiento de S. aureus, así como Candida albicans. Se supone que es una antimetabolito de arginina.
El control biológico puede ser una nueva forma posible controlar Staphylococcus aureus en las superficies del cuerpo. La colonización de las superficies del cuerpo (especialmente en la nariz) por Staphylococcus epidermidis (cepa inhibitoria JK16) perjudica el establecimiento de S. aureus.
A 2011 estudio apunta a esta nueva manera posible para controlar S. aureus. Este estudio se realizó a partir de observaciones de la flora microbiana nasales de un grupo diverso de personas. Se descubrió que hay dos cepas diferentes de S. epidermidis, uno que inhibe la formación de biopelículas de S. aureus, S. epidermidis cepa JK16 (tipo inhibidor), y uno que no lo hace (tipo no inhibidor) S. epidermidis cepa JK11 . En este estudio se observó que hubo algunos pacientes que no fueron afectadas por el Staphylococcus aureus; esto era debido a que estos pacientes tenían S. aureus, junto con S. epidermis (tipo inhibitorio), en sus flora microbiana nasales. Esto es debido a una relación amensalistic entre estos microorganismos, la cepa de S. inhibidora epidermidis y Staphylococcus aureus.
Estos resultados abren el camino a una terapia de control biológico para ayudar en el tratamiento de las infecciones por S. aureus que se están convirtiendo en una amenaza cada vez mayor debido al aumento de la resistencia a los tratamientos antibióticos convencionales.

