
Peróxido de hidrógeno
Sabías ...
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?
| Peróxido de hidrógeno | |
|---|---|
 | 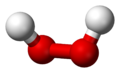 |
Dióxido de dihidrógeno | |
Otros nombres μ-1κO, 2κO'-Dioxidodihydrogen | |
| Identificadores | |
| CAS | 7722-84-1 |
| Número RTECS | MX0900000 |
| Propiedades | |
| Fórmula molecular | H 2 O 2 |
| Masa molar | 34,0147 g · mol · -1. |
| Apariencia | De color azul muy pálido; incoloro en solución |
| Densidad | 1,4 g / cm 3, líquidos |
| Punto de fusion | -11 ° C (262,15 K) |
| Punto de ebullicion | 150.2 ° C (423.35 K) |
| Solubilidad en agua | Miscible |
| Acidez (p K a) | 11.65 |
| Viscosidad | 1.245 c P a 20 ° C |
| Momento bipolar | 2.26 D |
| Peligros | |
| MSDS | 30% de peróxido de hidrógeno MSDS 60% MSDS peróxido de hidrógeno |
| Frases R | R5, R8, R20, R22, R35 |
| Frases S | (S1), (S2), S17, S26, S28, S36, S37, S39, S45 |
| Principal peligros | Oxidante, corrosivo |
| NFPA 704 |  0 3 1 OX |
| Punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
| Compuestos relacionados | Agua Ozono La hidrazina |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El peróxido de hidrógeno (H 2 O 2) es un líquido de color azul muy pálido que aparece sin color en una solución diluida, un poco más viscoso que el agua. Es un débil ácido . Tiene fuerte por lo tanto propiedades oxidantes y es un poderoso agente blanqueador que se utiliza sobre todo para el blanqueo de papel, sino que también ha encontrado uso como una desinfectante, como una oxidante, como una antiséptico, y en cohetes (particularmente en altas concentraciones como peróxido de alta-test (HTP)) como una monopropelente, y en sistemas bipropelente. La capacidad oxidante del peróxido de hidrógeno es tan fuerte que el producto químico se considera un altamente especies reactivas al oxigeno.
Historia
El peróxido de hidrógeno fue aislado por primera vez en 1818 por Louis Jacques Thénard por reacción de peróxido de bario con ácido nítrico . Una versión mejorada de este proceso se utiliza ácido clorhídrico , seguido de ácido sulfúrico para precipitar el subproducto sulfato de bario. Proceso de Thénard se utilizó desde el final del siglo 19 hasta mediados del siglo 20a. Los métodos de producción modernos se discuten a continuación.
Usos
Aplicaciones industriales
Se utilizó el 50% de la producción mundial de peróxido de hidrógeno en 1994 para pulp- y papel-blanqueo. Otras aplicaciones de blanqueo son cada vez más importantes como el peróxido de hidrógeno es visto como una alternativa ambientalmente benigno a cloro blanqueadores basados. Es altamente corrosivo para los metales.
Otras aplicaciones industriales importantes para el peróxido de hidrógeno incluyen la fabricación de percarbonato de sodio y perborato de sodio, utilizado como blanqueadores leves en lavandería detergentes. Se utiliza en la producción de cierta peróxidos orgánicos tales como peróxido de dibenzoilo, utilizado en polimerizaciones y otros procesos químicos. El peróxido de hidrógeno también se utiliza en la producción de epóxidos tales como óxido de propileno. La reacción con ácidos carboxílicos produce una correspondiente peroxiácido. El ácido peracético y ácido meta-cloroperoxibenzoico (mCPBA comúnmente abreviado) se preparó a partir de ácido acético y ácido clorobenzoico meta, respectivamente. El último se hace reaccionar habitualmente con alquenos para dar el correspondiente epóxido.
En el proceso de fabricación de PCB, se utilizó peróxido de hidrógeno mezclado con ácido sulfúrico como el producto químico para MicroEtch superficie de cobre rugosidad preparación.
Una combinación de un polvo a base de metal precioso del catalizador, peróxido de hidrógeno, metanol y agua puede producir vapor sobrecalentado en uno o dos segundos, liberando sólo CO 2 y vapor de alta temperatura para una variedad de propósitos ..
Los usos domésticos
- Diluido H 2 O 2 (alrededor de 15%) se utiliza para blanquear humana pelo, de ahí la frase "peróxido rubia". Se absorbe por la piel al contacto y crea un local de la piel capilar embolia que aparece como un blanqueamiento temporal de la piel. Se utiliza para blanquear los huesos que se van a poner en pantalla. La fuerza de una solución puede ser descrito como un porcentaje o volumen, donde el peróxido de hidrógeno 1% libera 3,3 volúmenes de oxígeno durante decomposition.Thus, una solución al 3% es equivalente a 10 volumen y una solución de 6% a 20 volumen, etc.
- 3% de H 2 O 2 se utiliza médicamente para la limpieza de heridas, eliminación de tejido muerto, y como por vía oral agente de desbridamiento. Peróxido detiene lenta (pequeña embarcación) sangrado de la herida / supuración, también. La mayoría de las soluciones de peróxido de over-the-counter no son adecuadas para la ingestión.
- 3% de H 2 O 2 es eficaz en el tratamiento frescas (rojo) manchas de sangre en la ropa y en otros artículos. Se debe aplicar a la ropa antes de manchas de sangre pueden ser accidentalmente "set" con agua climatizada. El agua fría y jabón se utilizan entonces para eliminar el peróxido de sangre tratada.
- La Food and Drug Administration (FDA) ha clasificado el peróxido de hidrógeno como prioridad Regulatoria (PRL) de medicamentos de baja para su uso en el control de hongos en el pescado y los huevos. (Ver ectoparásito.)
- Algunos jardineros y los usuarios de hidroponía abogan por el uso de peróxido de hidrógeno en soluciones de riego. Afirman que su descomposición espontánea libera oxígeno que mejora el desarrollo radicular de la planta y ayuda a tratar pudrición de la raíz (root muerte celular debido a la falta de oxígeno).
- Las pruebas de laboratorio realizadas por los piscicultores en los últimos años han demostrado que el peróxido de hidrógeno común de la casa se puede utilizar de forma segura para proporcionar oxígeno para los peces pequeños. El peróxido de hidrógeno libera oxígeno por la descomposición cuando se expone a los catalizadores tales como dióxido de manganeso.
- El peróxido de hidrógeno es un fuerte oxidante eficaz en el control de sulfuro y los olores relacionados orgánicos en los sistemas de recolección y tratamiento de aguas residuales. Se aplica típicamente a un sistema de aguas residuales, donde hay un tiempo de retención de 30 minutos a 5 horas antes de la liberación de sulfuro de hidrógeno. El peróxido de hidrógeno oxida el sulfuro de hidrógeno y promueve la bio-oxidación de olores orgánicos. El peróxido de hidrógeno se descompone en oxígeno y agua, la adición de oxígeno disuelto en el sistema negando así parte de la demanda biológica de oxígeno (DBO).
- El peróxido de hidrógeno se utiliza con éster de oxalato de fenilo y un apropiado teñir en luces químicas como agente oxidante. Reacciona con el éster para formar una inestable CO 2 dímero que excita el colorante a una estado excitado; el tinte emite un fotón (luz) cuando espontáneamente se relaja de nuevo a la estado fundamental.
Almacenamiento
Las regulaciones varían, pero las concentraciones bajas, como el 2,5% están ampliamente disponibles y legal para comprar para uso médico. Pequeñas cantidades de muchas concentraciones y grados diferentes pueden ser almacenados y utilizados con pocas regulaciones legalmente.
El peróxido de hidrógeno se debe almacenar en un recipiente hecho de un material que no reacciona con y no cataliza su descomposición. Numerosos materiales y procesos están disponibles, algunos aceros inoxidables, muchos plásticos, vidrios y algunas aleaciones de aluminio son compatibles.
El peróxido es un oxidante fuerte y debe ser almacenado lejos de fuentes y fuentes de contaminación catalítico de combustible (ver sección de descomposición ). Aparte de los riesgos evidentes de fuego, vapor de peróxido puede reaccionar con hidrocarburos y alcoholes para formar explosivos de contacto. Dado que el oxígeno se forma durante la descomposición natural del peróxido, el aumento resultante en la presión puede causar un recipiente (por ejemplo, de vidrio) se rompa. Peróxido debe mantenerse fresco, en forma de vapor de peróxido puede detonar encima de 70 ° C. Las muertes han ocurrido desde el almacenamiento en contenedores etiquetados adecuadamente debido a su aparente similitud con agua.
Utilice como propulsor
H 2 O 2 puede ser utilizado ya sea como una monopropelente (no mezclado con combustible) o como el componente oxidante de un cohete bipropelente. Uso como un monopropelente se aprovecha de la descomposición del peróxido de hidrógeno concentración de 70-98% + en vapor y oxígeno. El propelente se bombea en una cámara de reacción donde un catalizador, por lo general una pantalla de plata o platino, provoca la descomposición, la producción de vapor en más de 600 ° C que es expulsado a través de una boquilla, generación empuje. H 2 O 2 monopropelente produce un máximo impulso específico (I sp) de 161 s (1,6 kN · s / kg), lo que lo convierte en un monopropelente bajo rendimiento. Peróxido genera mucho menos empuje que tóxico hidrazina, pero no es tóxico. La Campana Rocket Belt utiliza monopropelente peróxido de hidrógeno.
Como bipropelente H 2 O 2 se descompone para quemar un combustible como oxidante. Impulsos específicos de hasta 350 s (3.5 kN · s / kg) se pueden alcanzar, dependiendo del combustible. El peróxido utilizado como oxidante da una sp algo inferior I de oxígeno líquido, pero es denso, almacenable, noncryogenic y se puede usar más fácilmente para conducir turbinas de gas para dar altas presiones. También se puede utilizar para la refrigeración regenerativa de los motores de cohetes. El peróxido se utiliza con mucho éxito como oxidante en cohetes alemanes Mundial-Guerra-II (por ejemplo, T-Stoff para el Me-163), y por el bajo costo británica Caballero Negro y Flecha lanzadores negros.
En los años 1940 y 1950 los Walter turbina utiliza peróxido de hidrógeno para su uso en submarinos mientras está sumergido; que se encontró que era demasiado ruidoso y requieren demasiado mantenimiento en comparación con sistemas de energía diesel-eléctricos. Algunos torpedos utilizan peróxido de hidrógeno como oxidante o propulsor, pero esto era peligroso y se ha interrumpido por más armadas. Fugas de peróxido de hidrógeno fueron culpados de los hundimientos de HMS Sidon y el Submarino ruso Kursk. Se descubrió, por ejemplo, por la Marina japonesa en los ensayos de torpedos, que la concentración de H 2 O 2 en las curvas en ángulo recto en tuberías HTP a menudo puede conducir a explosiones en submarinos y torpedos. El peróxido de hidrógeno se utiliza todavía en Soyuz para la conducción de las turbinas de gas para turbobombas de energía, sin embargo. SAAB Underwater Systems es la fabricación de la Torpedo 2000. Este torpedo, usado por la marina sueca, está propulsado por un motor de pistón impulsado por HTP como oxidante y queroseno como combustible en un sistema bipropelente.
Aunque rara vez se utiliza ahora como un monopropelente para grandes motores, peróxido de hidrógeno pequeña control de actitud propulsores están todavía en uso en algunos satélites. Son fáciles de estrangular, y más seguro para alimentar y manejar antes del lanzamiento de los propulsores de hidracina. Sin embargo, hidrazina se utiliza más a menudo en las naves espaciales debido a su mayor impulso específico y menor tasa de descomposición.
Recientemente H 2 O 2 / propileno ha sido propuesta como un enfoque para barato Una sola etapa a la órbita: un tanque de combustible que contiene propileno tiene una vejiga flotando en ella contiene H 2 O 2. Esta combinación ofrece un 15% superiores que sp a O2 / RP4 (un queroseno utilizado como carburante de cohetes), no necesita o turbinas almacenamiento criogénico o hardware, y reduce considerablemente el costo de la dosis de refuerzo. El potencial de este y otros sistemas alternativos se discute en detalle en Ingeniería Dunn.
El uso terapéutico
El peróxido de hidrógeno es generalmente reconocido como seguro (GRAS) como una agente antimicrobiano, un agente oxidante y para otros fines por los EE.UU. Administración de Alimentos y Drogas.
El peróxido de hidrógeno se ha utilizado como una agente antiséptico y anti-bacteriana durante muchos años debido a su efecto oxidante. Aunque su uso ha disminuido en los últimos años con la popularidad de mejor olor y más fácilmente disponible a través de los productos de venta libre, que todavía es utilizado por muchos hospitales, médicos y dentistas en la esterilización, limpieza y tratamiento de todo, desde plantas a procedimientos del conducto radicular.
- Como muchos antisépticos oxidantes, hidrógeno perioxide causa daño leve al tejido en heridas abiertas, pero también es efectivo para detener rápidamente capilar sangrado (exudación de sangre lenta de pequeños vasos en abrasiones), y, a veces se utiliza con moderación para este fin, así como la limpieza .
- El peróxido de hidrógeno se pueden usar como una pasta de dientes cuando se mezcla con las cantidades correctas de bicarbonato de sodio y la sal.
- El peróxido de hidrógeno y peróxido de benzoilo a veces se usa para tratar el acné .
- El peróxido de hidrógeno se utiliza como una emético en la práctica veterinaria.
- usos "Alternativas"
- Algunas personas han tratado de usar peróxido como un tratamiento para el cáncer. La Sociedad Americana del Cáncer afirma que "no hay evidencia científica de que el peróxido de hidrógeno es un tratamiento del cáncer seguro, eficaz o útil", y aconseja a los pacientes de cáncer a "permanecer bajo el cuidado de médicos calificados que utilizan métodos de tratamiento probado y aprobado los ensayos clínicos de prometedor nuevos tratamientos ".
- Otro procedimiento médico alternativo polémico es inhalación de peróxido de hidrógeno a una concentración de aproximadamente 1%. El uso interno de peróxido de hidrógeno tiene un historial de causar fatal trastornos de la sangre, y su reciente uso como tratamiento terapéutico se ha relacionado con varias muertes .
Propiedades físicas

Mientras que la contra confórmero sería minimizar repulsiones estéricas, un ángulo de 90 ° de torsión sería optimizar la mezcla entre el de tipo p lleno orbital del oxígeno (uno de los pares solitarios) y la LUMO de la vínculo vecinal OH. Reflejando un compromiso entre las dos interacciones, peróxido de hidrógeno gaseoso y líquido adopta una anticlinal forma "sesgada". Esta conformación de rotación es un compromiso entre el confórmero anti, que pueda minimizar la repulsión estérica, y entre el confórmero syn que asocia con enlaces OH de pares libres en los átomos de oxígeno. A pesar del hecho de que el enlace OO es un enlace sencillo, la molécula tiene una notablemente alta barrera para completar la rotación de 29,45 kJ / mol (en comparación con 12,5 kJ / mol para la barrera de rotación de etano ). El aumento de la barrera también se atribuye a la repulsión entre un par solitario y otros pares solitarios. La ángulos de enlace se ven afectados por el enlace de hidrógeno, que es pertinente a la diferencia estructural entre gaseoso y formas cristalinas; de hecho, una amplia gama de valores se ve en cristales que contienen H 2 O 2 molecular.
Propiedades químicas
H 2 O 2 es uno de los más poderosos oxidantes conocidos - más fuerte que el cloro , dióxido de cloro, y permanganato de potasio . También, a través de la catálisis, H 2 O 2 se puede convertir en radicales hidroxilo (· OH) con reactividad segunda sólo a flúor.
| Oxidante | Potencial de oxidación, V |
|---|---|
| Flúor | 3.0 |
| Radical hidroxilo | 2.8 |
| Ozono | 2.1 |
| Peróxido de hidrógeno | 1.8 |
| Permanganato de potasio | 1.7 |
| El dióxido de cloro | 1.5 |
| Cloro | 1.4 |
El peróxido de hidrógeno puede descomponerse espontáneamente en agua y oxígeno. Por lo general, actúa como una agente oxidante, pero hay muchas reacciones donde actúa como una agente reductor, liberando oxígeno como un subproducto.
También forma fácilmente tanto inorgánicos como orgánicos peróxidos.
Descomposición
El peróxido de hidrógeno se descompone siempre (desproporciona) exotérmicamente en agua y oxígeno gas espontáneamente:
- 2 H 2 O 2 → 2 H2O + O2
Este proceso es muy favorable; tiene un Δ H o de -98,2 kJ · mol -1 y un Δ G o de -119,2 kJ · mol -1 y un? S de 70,5 J · mol -1 · K -1. La velocidad de descomposición depende de la temperatura y la concentración del peróxido, así como el pH y la presencia de impurezas y estabilizantes. El peróxido de hidrógeno es incompatible con muchas sustancias que catalizan su descomposición, incluyendo la mayoría de los metales de transición y sus compuestos. Catalizadores comunes incluyen dióxido de manganeso, y la plata . La misma reacción es catalizada por la enzima catalasa, que se encuentra en el hígado, cuya principal función en el cuerpo es la eliminación de los subproductos tóxicos de metabolismo y la reducción de estrés oxidativo. La descomposición se produce más rápidamente en alcalino, por lo que el ácido se añade a menudo como un estabilizador.
La liberación de oxígeno y energía en la descomposición tiene efectos secundarios peligrosos. Derramar peróxido de alta concentración de una sustancia inflamable puede causar un fuego inmediato, que se ve agravada por el oxígeno liberado por la descomposición de peróxido de hidrógeno. Peróxido de alta resistencia (también llamado peróxido de alta-test, o HTP) debe almacenarse en un recipiente ventilado adecuado para evitar la acumulación de gas oxígeno, que de otro modo conducir a la eventual rotura del recipiente.
En presencia de ciertos catalizadores, tales como Fe 2+ o 3+ Ti, la descomposición puede tomar un camino diferente, con los radicales libres, tales como HO · ( hidroxilo) y HOO · están formando. Una combinación de H 2 O 2 y Fe 2+ se conoce como El reactivo de Fenton.
Una concentración común para el peróxido de hidrógeno es "20 volumen", lo que significa que cuando se descompone 1 volumen de peróxido de hidrógeno, que produce 20 volúmenes de oxígeno. Un 20 concentración "volumen" de peróxido de hidrógeno es equivalente a 1,67 mol / dm 3 ( Solución molar) o aproximadamente 6%.
El peróxido de hidrógeno disponible en las farmacias es de tres por ciento la solución. En tales concentraciones pequeñas, es menos estable y se descompone más rápido. Por lo general, se estabiliza con acetanilida, una sustancia que tiene efectos secundarios tóxicos en cantidades significativas.
Las reacciones redox
En solución acuosa, peróxido de hidrógeno puede oxidar o reducir una variedad de iones inorgánicos. Cuando actúa como un agente reductor, oxígeno también se produce gas. En ácido solución Fe 2+ se oxida a Fe 3+,
- 2 Fe 2+ (ac) + H 2 O 2 + 2 H + (ac) → 2 Fe 3+ (ac) + 2H 2 O (l)
y sulfito (SO 3 2-) se oxida a sulfato (SO 4 2-). Sin embargo, el permanganato de potasio se reduce a Mn 2+ por H 2 O 2 ácida. Bajo condiciones alcalinas, sin embargo, algunas de estas reacciones inversas; por ejemplo, Mn 2+ se oxida a Mn 4+ (como MnO 2).
Otro ejemplo de peróxido de hidrógeno que actúa como agente reductor es la reacción con hipoclorito de sodio, este es un método conveniente para la preparación de oxígeno en el laboratorio.
- NaOCl + H 2 O 2 → O2 + NaCl + H2O
El peróxido de hidrógeno se utiliza con frecuencia como una agente oxidante en química orgánica. Una aplicación es para la oxidación de tioéteres a sulfóxidos. Por ejemplo, metilo sulfuro de fenilo se oxida a sulfóxido de metilo fenilo con un rendimiento del 99% en metanol en 18 horas (o 20 minutos usando una TiCl 3 catalizador):
- Ph-S-CH 3 + H 2 O 2 → Ph-S (O) CH 3 + H 2 O
Peróxido de hidrógeno alcalino se utiliza para epoxidación de alquenos deficientes en electrones, tales como ácidos acrílicos, y también para la oxidación del alquilboranos a alcoholes , el segundo paso de hidroboración-oxidación.
La formación de compuestos de peróxido
El peróxido de hidrógeno es un ácido débil, y puede formar hidroperóxido o peróxido sales o derivados de muchos metales.
Por ejemplo, en la adición de una solución acuosa de ácido crómico (CrO3) o soluciones ácidas de sales de dicromato, que formarán un CrO peróxido azul inestable (O 2) 2. En solución acuosa que se descompone rápidamente para formar gas oxígeno y sales de cromo.
También puede producir peroxoanions por reacción con los aniones ; por ejemplo, la reacción con bórax conduce a perborato de sodio, un blanqueador utilizado en los detergentes de lavandería:
- Na 2 B 4 O 7 + 4 H 2 O 2 + 2 NaOH → 2 Na 2 B 2 O 4 (OH) 4 + H 2 O
H 2 O 2 convierte los ácidos carboxílicos (RCOOH) en peroxiácidos (RCOOOH), que a su vez se utilizan como agentes oxidantes. El peróxido de hidrógeno reacciona con acetona para formar peróxido de acetona, y que interactúa con ozono para formar trióxido de hidrógeno. La reacción con urea produce peróxido de carbamida, que se utiliza para blanquear los dientes. Un aducto ácido-base con óxido de trifenilfosfina es un útil "portador" de H 2 O 2 en algunas reacciones.
El peróxido de hidrógeno reacciona con el ozono para formar Trioxidano.
Alcalinidad
El peróxido de hidrógeno es un mucho más débil base de que el agua, pero todavía puede formar aductos con ácidos muy fuertes. La superácido HF / SBF 5 formas compuestos inestables que contienen la [H 3 O 2] + iones.
Manufactura
El peróxido de hidrógeno se fabrica hoy casi exclusivamente por el autooxidación de 2-etil-9,10-dihidroxiantraceno (C 16 H 14 O 2) a 2-etilantraquinona (C 16 H 12 O 2) y peróxido de hidrógeno usando el oxígeno del aire.

En esta reacción, los grupos hidroxi en el anillo medio de antraceno se desprotona y se convierten en cetonas , mientras que dos enlaces dobles se pierden desde el anillo central y sustituidos, C = O dobles enlaces en los grupos cetona. La derivado de antraquinona es entonces extraída y reducida en el compuesto dihidroxi usando hidrógeno gas en presencia de un metal catalizador . La ecuación general para el proceso es engañosamente simple:
- H 2 + O 2 → H 2 O 2
Sin embargo la economía del proceso dependen de reciclaje eficaz de los disolventes de quinona y extracción, y de la hidrogenación del catalizador .
Se utilizaron procesos Previamente inorgánicas, empleando la electrólisis de una solución acuosa de ácido sulfúrico o ácido bisulfato de amonio (NH 4 HSO 4), seguido de hidrólisis del peroxidisulfato ((SO 4) 2) 2- que se forma.
En 1994, la producción mundial de H 2 O 2 fue de alrededor de 1,9 millones toneladas y aumentó a 2,2 millones en 2006, la mayoría de las cuales fue a una concentración de 70% o menos. En ese año mayor de 30% de H 2 O 2 se vendió por alrededor de US $ 0,54 por kg , equivalente a US $ 1.50 por kg (US $ 0,68 por libras) en un "100% base".
Concentración
El peróxido de hidrógeno que funciona mejor como un propulsor en extremadamente alta concentrations-- aproximadamente más del 70%. Aunque cualquier concentración de peróxido generará un poco de gas caliente (oxígeno además de algunos de vapor), a concentraciones por encima de aproximadamente 67%, el calor de descomposición de peróxido de hidrógeno se vuelve lo suficientemente grande como para vaporizar por completo todo el líquido a temperatura estándar. Esto representa un punto de seguridad y la utilización de inflexión, ya que la descomposición de cualquier concentración por encima de esta cantidad es capaz de transformar el líquido por completo a gas calentado (cuanto mayor sea la concentración, más caliente esté el gas resultante). Esta mezcla muy caliente vapor / oxígeno se puede utilizar para generar empuje máximo, el poder, o el trabajo, sino que también hace una descomposición explosiva del material mucho más peligrosos.
Por lo tanto, las concentraciones normales de grado propelente varían desde 70 hasta 98%, con grados comunes de 70, 85, 90, y 98%. Muchos de estos grados y variaciones se describen en detalle en el número de especificación propelente Estados Unidos MIL-P-16005 Revisión F, que está disponible actualmente. Los proveedores disponibles de peróxido de hidrógeno al propulsor de alta concentración son generalmente una de las grandes empresas comerciales que hacen otros grados de peróxido de hidrógeno; Incluyendo Solvay Interox, FMC, Degussa y Peróxido de Propulsión. Otras empresas que han hecho de peróxido de hidrógeno propulsor en el pasado reciente incluyen Air Liquide y DuPont. DuPont recientemente vendió su negocio de fabricación de peróxido de hidrógeno para Degussa.
Peróxido de hidrógeno del grado del propulsor está disponible para compradores calificados. Normalmente este químico sólo se vende a empresas comerciales o instituciones gubernamentales que tienen la capacidad para manejar y utilizar el material. No profesionales han comprado 70% o peróxido de hidrógeno concentración más baja (el 30% restante es agua con trazas de impurezas y materiales estabilizadores, tales como sales de estaño, fosfatos, nitratos, y otros aditivos químicos), y el aumento de su concentración sí mismos. Muchos aficionados tratan de destilación , pero esto es extremadamente peligroso con peróxido de hidrógeno; vapor de peróxido puede encender o detonar dependiendo de las combinaciones específicas de temperatura y presión. En general, cualquier masa de ebullición de peróxido de hidrógeno de alta concentración a presión ambiente producirá el peróxido de hidrógeno en fase de vapor que pueda detonar. Este riesgo se ve mitigado, pero no totalmente eliminada con la destilación de vacío. Otros enfoques para el peróxido de hidrógeno para concentrarse son burbujeo y cristalización fraccionada.
Peróxido de hidrógeno de alta concentración es fácilmente disponible en 70, 90, y 98% en las concentraciones de tamaños de 1 galón, de 30 galones, y los volúmenes de camiones cisterna a granel. Peróxido de hidrógeno grado propelente se utiliza en los sistemas militares actuales y se encuentra en numerosos programas de defensa y aeroespacial de investigación y desarrollo. Muchas compañías de cohetes con fondos privados están utilizando el peróxido de hidrógeno, en particular Blue Origin, y algunos grupos de aficionados han expresado su interés en la fabricación de su propio peróxido, para su uso y para la venta en pequeñas cantidades a los demás.
Peligros
El peróxido de hidrógeno, ya sea en forma pura o diluida, pueden plantear varios riesgos:
- Por encima de las concentraciones de aproximadamente el 10%, el peróxido de hidrógeno se pueden desprender vapores que pueden detonar encima de 50 ° C (158 ° F), a presión atmosférica normal. Esto puede causar una explosión de vapor del líquido en ebullición en expansión ( BLEVE) del líquido restante. Destilación de peróxido de hidrógeno a presiones normales es por lo tanto muy peligroso.
- Vapores de peróxido de hidrógeno pueden formar explosivos de contacto mecánico con hidrocarburos tales como grasas. Reacciones peligrosas que van desde el encendido en la explosión han sido reportados con alcoholes , cetonas , ácidos carboxílicos (especialmente ácido acético ), aminas y fósforo . La palabra es 'peróxidos matan farmacias.
- El peróxido de hidrógeno, en caso de derrame en la ropa (u otros materiales inflamables), preferentemente se evaporará el agua hasta que la concentración alcanza una resistencia suficiente, entonces la ropa de forma espontánea se encenderá. ;
- Peróxido de hidrógeno concentrado (> 50%) es corrosivo, e incluso soluciones resistencia interna puede causar irritación en los ojos, membranas mucosas y la piel. La ingestión de soluciones de peróxido de hidrógeno es particularmente peligroso, ya que la descomposición en el estómago libera grandes cantidades de gas (10 veces el volumen de una solución al 3%) que conduce a una hemorragia interna. La inhalación de más del 10% puede causar irritación pulmonar grave.
- Las bajas concentraciones de peróxido de hidrógeno, del orden de 3% o menos, se blanquear químicamente muchos tipos de ropa que entra en contacto con a un tono rosado. Se debe tener precaución al utilizar productos comunes que pueden contener peróxido de hidrógeno, como limpiador facial o solución para lentes de contacto, que SALPICADURA fácilmente a otras superficies.
El peróxido de hidrógeno se produce naturalmente como un subproducto del metabolismo del oxígeno, y prácticamente todos los organismos poseen enzimas conocidas como peroxidasas, que se descompone aparentemente inofensiva catalíticamente bajas concentraciones de peróxido de hidrógeno en agua y oxígeno (véase la descomposición arriba).
En un incidente, varias personas resultaron heridas después de un derrame de peróxido de hidrógeno a bordo Northwest Airlines vuelo 957 porque lo confundió con agua.
Durante la Segunda Guerra Mundial algunos campos de exterminio experimentalmente mataron a personas con inyecciones de peróxido de hidrógeno.
El peróxido de hidrógeno también fue parte de los ingredientes de las bombas del metro de Londres 21 de julio 2005, que no explotaron.
Una MSDS contiene más información sobre los riesgos de trabajar con este producto químico.

