
El cloruro de zinc
Acerca de este escuelas selección Wikipedia
SOS Children, una organización benéfica educación , organizó esta selección. Apadrina un niño para hacer una diferencia real.
| El cloruro de zinc | |
|---|---|
 | |
El cloruro de zinc | |
Otros nombres Zinc (II), cloruro de | |
| Identificadores | |
| CAS | 7646-85-7 |
| Número RTECS | ZH1400000 |
| Propiedades | |
| Fórmula molecular | ZnCl2 |
| Masa molar | 136.315 g / mol |
| Apariencia | Sólido cristalino blanco. |
| Densidad | 2,907 g / cm³, sólido |
| Punto de fusion |
275 ° C (548 K) |
| Punto de ebullicion | 756 ° C (1029 K) |
| Solubilidad en agua | 432 g / 100 ml (25 ° C) |
| Estructura | |
| Estructura cristalina | Cuatro formas conocidas Hexagonal compacta (δ) es la única forma estable cuando anhidro. |
| Coordinación geometría | Tetraédrica , de 4 de coordenadas, lineal en la fase de gas. |
| Peligros | |
| MSDS | MSDS externa |
| Clasificación de la UE | Irritante (I), Corrosivo (C). |
| Frases R | R34, R50, R53 |
| Frases S | S7 / 8, S28, S45, S60, S61 |
| Compuestos relacionados | |
| Otros aniones | Fluoruro de cinc, bromuro de zinc, yoduro de zinc |
| Otros cationes | Cobre (II) cloruro , cloruro de cadmio |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El cloruro de zinc es el nombre del compuesto químico con la fórmula Zn Cl 2 y sus hidratos. Cloruros de zinc, de los que se conocen nueve formas cristalinas, son incoloros o blancos y altamente soluble en agua. ZnCl2 en sí es higroscópico e incluso delicuescente. Por lo tanto, las muestras deben protegerse de las fuentes de humedad, como el vapor de agua presente en el aire ambiente. El cloruro de zinc se encuentra una amplia aplicación en la materia textil de procesamiento, flujos metalúrgicos y síntesis química.
Estructura y propiedades básicas
Cuatro formas cristalinas, denominadas polimorfos, de ZnCl2 son conocidos, y en cada caso los iones Zn 2+ se tetraédricamente coordinados para cuatro ligandos de cloruro. El enfriamiento rápido de ZnCl $ fundido 2 da un vaso, es decir, un sólido amorfo rígido. Adicionalmente ZnCl2 formas hidratos y al menos un hidróxido mixto, ZnClOH.
La carácter covalente es del material anhidro se indica por su relativamente bajo punto de fusión de 275 ° C. Otra prueba de covalencia es proporcionada por la alta solubilidad de la dicloruro en etherial disolventes tales como el que se forma aductos con la fórmula ZnCl2 2 L, donde L = ligando tal como O (C 2 H 5) 2. En consonancia con la Acidez de Lewis de Zn 2+, soluciones acuosas de ZnCl2 son soluciones ácidas: a 6 Solución acuosa de M tiene una pH de 1.
Se conocen cuatro hidratos de cloruro de zinc. ZnCl2 (H 2 O) 4 cristaliza a partir de soluciones acuosas de cloruro de zinc. También caracterizados son ZnCl2 (H 2 O) n, donde n = 1, 1,5, 2,5, y 3. Cuando el cloruro de cinc hidratado se calienta, se obtiene un residuo de ZnOHCl.
En solución acuosa, el cloruro de zinc se disocia completamente en Zn 2+. Por lo tanto, aunque muchas sales de zinc tienen diferentes fórmulas y diferente estructuras cristalinas, estas sales se comportan de manera muy similar en solución acuosa. Por ejemplo, las soluciones preparadas a partir de cualquiera de los polimorfos de ZnCl2, así como otros haluros (bromuro, yoduro) y el sulfato de frecuencia se pueden utilizar indistintamente para la preparación de otros compuestos de zinc. Ilustrativo es la preparación de carbonato de zinc:
- ZnCl2 ( aq) + Na 2 CO 3 (ac) → ZnCO 3 (s) + 2 NaCl (aq)
Preparación y purificación
ZnCl2 anhidro puede prepararse a partir de zinc y cloruro de hidrógeno.
- Zn + 2 HCl → ZnCl2 + H 2
Las formas hidratadas y soluciones acuosas se pueden preparar fácilmente por tratamiento de piezas de Zn metálico con ácido clorhídrico concentrado. El óxido de zinc y sulfuro de zinc reacciona con HCl:
A diferencia de muchos otros elementos, zinc existe esencialmente en un solo estado de oxidación, 2+, lo que simplifica la purificación.
Muestras comerciales de cloruro de zinc suelen contener agua y productos de producto de hidrólisis. Tales muestras se pueden purificar por extracción en caliente dioxano, el cual se filtró en caliente y el filtrado se enfría para dar un precipitado de ZnCl2. Muestras anhidras se pueden purificar por sublimación en una corriente de gas cloruro de hidrógeno, seguido de calentamiento a 400 ° C en una corriente de seca de nitrógeno gas. Finalmente, el método más simple se basa en el tratamiento de cloruro de zinc con cloruro de tionilo.
Aplicaciones
Como un flujo metalúrgica
Cloruro de zinc tiene la capacidad de atacar óxidos metálicos (MO) para dar derivados de la fórmula MZnOCl 2. Esta reacción es relevante para la utilidad de ZnCl2 como una fundente para soldadura - se disuelve capas de óxido exponiendo la superficie del metal limpio. Típicamente este flujo se preparó disolviendo lámina de zinc en diluida de ácido clorhídrico hasta que el líquido que cesó el desprendimiento de hidrógeno; por esta razón, tal flujo fue una vez conocida como espíritus muertos . Debido a su naturaleza corrosiva, este flujo no es adecuado para situaciones en las que los residuos no se puede limpiar de distancia, como el trabajo electrónico. Esta propiedad también conduce a su uso en la fabricación de magnesia cementos para empastes dentales y seguro enjuagues bucales como un ingrediente activo.
En síntesis orgánica
En el laboratorio, cloruro de zinc encuentra un amplio uso, principalmente como una fuerza moderada Ácido de Lewis. Se puede catalizar (A) el La síntesis de Fischer indol, y también (B) Reacciones de acilación de Friedel-Crafts que involucran activados anillos aromáticos
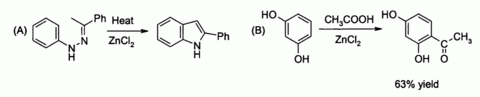
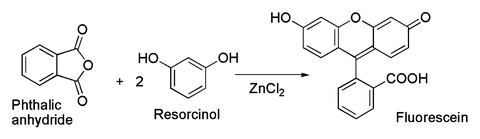
En relación con este último es la preparación clásica del colorante fluoresceína desde anhídrido ftálico y resorcinol, que implica una Acilación de Friedel-Crafts. Esta transformación ha sido efectivamente realizada utilizando incluso el hidratada ZnCl2 ejemplo que se muestra en la imagen de arriba.
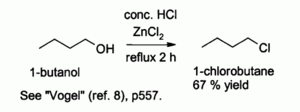
El ácido clorhídrico solo reacciona pobremente con alcoholes primarios y alcoholes secundarios , pero una combinación de HCl con ZnCl2 (conocido juntos como la " Lucas reactivo ") es eficaz para la preparación de cloruros de alquilo. Las reacciones típicas se llevan a cabo a 130 ° C. Esta reacción procede probablemente a través de una S N 2 con mecanismo de alcoholes primarios pero S N 1 vía con alcoholes secundarios.
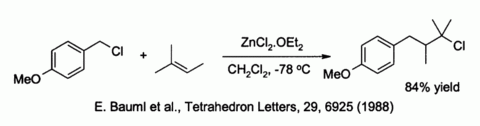
El cloruro de zinc también activa bencílico y haluros alílicos hacia sustitución por débil nucleófilos tales como alquenos :
De manera similar, ZnCl2 promueve selectiva NaBH 3 CN reducción de haluros terciarios, alílicos o bencílicos de los hidrocarburos correspondientes.
El cloruro de zinc es también un reactivo de partida útil para la síntesis de muchos organozinc reactivos, tales como los utilizados en el catalizada por paladio Acoplamiento de Negishi con haluros de arilo o haluros de vinilo. En tales casos, el compuesto orgánico de zinc se prepara normalmente por transmetalación a partir de una organolitio o una Reactivo de Grignard, por ejemplo:
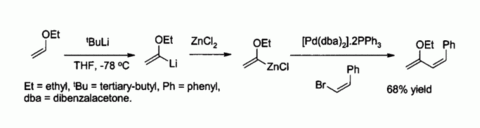
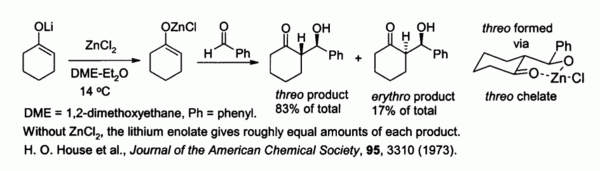
Zinc enolatos, preparado a partir de enolatos de metales alcalinos y ZnCl2, proporcionar un control de estereoquímica en reacciones de condensación aldólica debido a quelación en el zinc. En el ejemplo se muestra a continuación, la treo producto fue favorecido sobre el eritro por un factor de 5: 1 cuando ZnCl2 en DME / éter se utilizó. El quelato es más estable cuando el grupo fenilo es voluminoso pseudo- ecuatorial en lugar de pseudo axial, es decir, en lugar de treo eritro.
En el procesamiento de textiles
Soluciones acuosas concentradas de cloruro de zinc (más de 64% de cloruro de zinc peso / peso en agua) tiene la interesante propiedad de disolver almidón, seda, y celulosa. Por lo tanto, dichas soluciones no se pueden filtrar a través de papeles de filtro estándar. Relevante a su afinidad por estos materiales, ZnCl2 se utiliza como agente ignífugo y en tela "refresheners" tales como Febreze
Consideraciones de seguridad
Las sales de zinc son relativamente no tóxicos. Precauciones que se aplican a ZnCl $ anhidro 2 son los aplicables a otros haluros metálicos anhidro, es decir, la hidrólisis puede ser exotérmica y el contacto debe evitarse. Las soluciones concentradas son ácidos y corrosivo y atacar específicamente celulosa y la seda como Ácidos de Lewis. Consultar la HS en la tabla.

