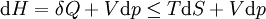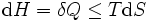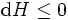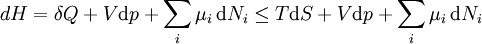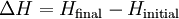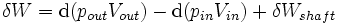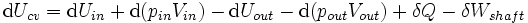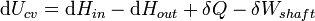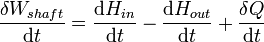Enthalpie
Saviez-vous ...
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Mécanique statistique |
|---|
 |
|
Statistiques de particules
|
Ensembles
|
|
Modèles
|
Potentiels
|
Dans la thermodynamique et la chimie moléculaire , l'enthalpie ou de chaleur contenu (notée H, 'h', ou rarement comme χ) est un quotient ou la description de potentiel thermodynamique d'un système qui peut être utilisé pour calculer le travail "utile" pouvant être obtenue à partir d'un fermé système thermodynamique sous pression constante.
Le terme enthalpie est composé de l'en- préfixe, ce qui signifie de «mettre en» et le grec mot -thalpein, qui signifie «chaleur», bien que la définition originale est pensé pour avoir découlé du mot, "enthalpos" (ἐνθάλπος). Il est souvent calculé comme une somme différentielle, décrivant les changements au sein de exo- et endo thermiques réactions, qui minimisent à l'équilibre.
Histoire
Au dessus de l'histoire de la thermodynamique, plusieurs termes ont été utilisés pour désigner ce qui est maintenant connu comme l'enthalpie d'un système. À l'origine, on pensait que le mot "enthalpie" a été créé par Émile Clapeyron et Rudolf Clausius par la publication de la Formule de Clapeyron dans "Les Tables de vapeur Mollier et diagrammes" en 1827 , mais il a ensuite été publié que le premier enregistrement de la parole était encore dans 1875 , par Josiah Willard Gibbs dans la publication «Chimie physique: un Traité avancée", bien qu'il ne est pas référencé dans Gibbs travaille directement. En 1909 , Keith Landler discuté de travail sur la «Gibbs fonction de la chaleur pour une pression constante» et a noté que Heike Kamerlingh Onnes avait inventé son nom moderne de la Grèce mot «enthalpos" (ενθαλπος) signifiant "mettre la chaleur dans."
Définition originale
Ce est le changement de chaleur qui se produit lorsque 1 mole d'une substance réagit complètement avec de l'oxygène pour former des produits à 298 K et 1 atm. La fonction H a été introduit par le physicien néerlandais Heike Kamerlingh Onnes en début du 20ème siècle sous la forme suivante:
où E représente l'énergie du système. En l'absence d'un champ extérieur, l'enthalpie peut être définie, comme il est généralement connu, par:
où (toutes les unités indiquées dans SI)
- H est l'enthalpie ( joules)
- U est la énergie interne, (joules)
- p est la la pression du système, ( pascals)
- V est le volume de ( mètres cubes)
Application et formule étendue
Vue d'ensemble
En termes de thermodynamique, enthalpie peut être calculé en déterminant les besoins pour créer un système de «néant»; le travail mécanique requis,  diffère, en fonction de la constance des conditions présentes à la création de la système thermodynamique.
diffère, en fonction de la constance des conditions présentes à la création de la système thermodynamique.
L'énergie interne, 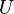 , Doivent être fournis pour enlever les particules d'une environnant afin de laisser un espace pour la création d'un système, à condition que des variables environnementales, comme la pression (
, Doivent être fournis pour enlever les particules d'une environnant afin de laisser un espace pour la création d'un système, à condition que des variables environnementales, comme la pression ( 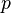 ) Restent constants. Cette énergie interne comprend également l'énergie nécessaire à l'activation et la coupure de composés liés en espèces gazeuses.
) Restent constants. Cette énergie interne comprend également l'énergie nécessaire à l'activation et la coupure de composés liés en espèces gazeuses.
Ce processus est calculée dans les calculs que enthalpie 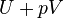 , D'étiqueter la quantité d'énergie ou de travail nécessaire pour "mettre de côté l'espace pour" et "créer" le système; décrivant le travail accompli à la fois par la réaction ou la formation de systèmes, et les environs. Pour les systèmes à pression constante, le changement d'enthalpie est la chaleur reçue par le système ainsi que le travail non-mécanique qui a été fait.
, D'étiqueter la quantité d'énergie ou de travail nécessaire pour "mettre de côté l'espace pour" et "créer" le système; décrivant le travail accompli à la fois par la réaction ou la formation de systèmes, et les environs. Pour les systèmes à pression constante, le changement d'enthalpie est la chaleur reçue par le système ainsi que le travail non-mécanique qui a été fait.
Par conséquent, le changement d'enthalpie peut être conçu ou représenté sans la nécessité pour les mécaniciens de compression ou d'expansion; pour un système simple, avec un nombre constant de particules, la différence d'enthalpie est la quantité maximale d'énergie thermique obtenue à partir d'un processus thermodynamique dans lequel la pression est maintenue constante.
Le terme 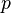
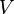 est le travail nécessaire pour déplacer l'atmosphère environnante afin de libérer l'espace qui sera occupé par le système.
est le travail nécessaire pour déplacer l'atmosphère environnante afin de libérer l'espace qui sera occupé par le système.
Relations
Comme une extension de la première loi de la thermodynamique , enthalpie peut être liée à plusieurs autres formules thermodynamiques. Comme avec la définition originale de la première loi;
- Lorsque, tel que défini par la loi;
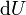 représente l'augmentation de la infinitésimale énergie systématique ou interne.
représente l'augmentation de la infinitésimale énergie systématique ou interne. 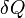 représente la quantité infinitésimale de l'énergie attribuée ou ajoutée au système.
représente la quantité infinitésimale de l'énergie attribuée ou ajoutée au système. 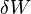 représente la quantité infinitésimale d'énergie agi par le système sur les environs.
représente la quantité infinitésimale d'énergie agi par le système sur les environs.
Par expression de différenciation, la valeur de H peut être définie comme
Où
|
|
|
|
|
|
|
|
Pour un processus qui ne est pas réversible, la deuxième loi de la thermodynamique affirme que l'augmentation de la chaleur 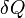 est inférieur ou égal au produit
est inférieur ou égal au produit 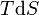 de la température
de la température  et l'augmentation de l' entropie
et l'augmentation de l' entropie 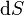 ; ainsi
; ainsi
On voit que, si un processus thermodynamique est isobarique (ie, se produit à pression constante), puis 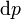 est zéro et ainsi
est zéro et ainsi
La différence d'enthalpie est le atteignable d'énergie thermique maximale du système dans un processus isobarique. Cela explique pourquoi il est parfois appelé le contenu de chaleur. Autrement dit, l'intégrale de 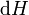 sur toute isobar dans l'espace de l'Etat est le atteignable d'énergie thermique maximale du système.
sur toute isobar dans l'espace de l'Etat est le atteignable d'énergie thermique maximale du système.
Si, en outre, l' entropie est maintenu constant aussi bien, ce est à dire, 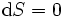 , L'équation ci-dessus devient:
, L'équation ci-dessus devient:
avec l'égalité tenant à l'équilibre. On voit que l'enthalpie d'un système général de façon continue à diminuer sa valeur minimale, ce qui maintient à l'équilibre.
Dans une forme plus générale, la première loi décrit l'énergie interne des conditions supplémentaires impliquant la potentiel chimique et le nombre de particules de différents types. La déclaration différentiel pour 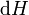 est alors:
est alors:
où 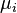 est le potentiel chimique d'une particule de type i, et
est le potentiel chimique d'une particule de type i, et 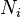 est le nombre de telles particules. On voit que, non seulement le
est le nombre de telles particules. On voit que, non seulement le 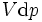 terme être mis à zéro en obligeant la pression des états initiaux et finaux de la même, mais la
terme être mis à zéro en obligeant la pression des états initiaux et finaux de la même, mais la 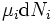 termes doivent être zéro ainsi, en exigeant que les numéros de particules restent inchangées. Toute autre généralisation va ajouter encore plus de termes dont le mandat différentiel est considérable doit être mis à zéro pour que l'interprétation de l'enthalpie à tenir.
termes doivent être zéro ainsi, en exigeant que les numéros de particules restent inchangées. Toute autre généralisation va ajouter encore plus de termes dont le mandat différentiel est considérable doit être mis à zéro pour que l'interprétation de l'enthalpie à tenir.
Chaleurs de réaction
L'enthalpie totale d'un système ne peut pas être mesuré directement; la variation d'enthalpie d'un système est mesuré à la place. Variation d'enthalpie est définie par l'équation suivante:
où
- Δ H est le changement d'enthalpie
- H est l'enthalpie finale finale du système, mesurée en joules. Dans une réaction chimique, H est l'enthalpie finale des produits.
- H est l'enthalpie initiale initiale du système, mesurée en joules. Dans une réaction chimique, H est l'enthalpie initiale des réactifs.
Pour un exothermique réaction constants la pression, le changement d'enthalpie dans le système est égale à l'énergie libérée lors de la réaction, y compris l'énergie retenue dans le système et perdu par l'expansion par rapport à ses environs. D'une manière similaire, pour une réaction endothermique, le changement d'enthalpie dans le système est égale à l'énergie absorbée dans la réaction, y compris l'énergie perdue par le système de compression et obtenu à partir de son environnement. Une manière relativement facile de déterminer si oui ou non une réaction est exothermique ou endothermique est de déterminer le signe de Δ H. Si Δ est positif H, la réaction est endothermique, ce est la chaleur est absorbée par le système en raison des produits de la réaction ayant une plus grande enthalpie de réactifs. D'autre part, si Δ H est négatif, la réaction est exothermique, ce est la diminution de l'enthalpie globale est obtenue par la génération de chaleur.
Bien enthalpie est couramment utilisé dans l'ingénierie et la science, il est impossible de mesurer directement, comme enthalpie a aucune donnée (point de référence). Par conséquent enthalpie précision ne peut être utilisé dans un système fermé. Cependant, quelques applications du monde réel existent dans l'isolement fermé, et ce est pour cette raison que deux ou plusieurs systèmes fermés ne peuvent pas être comparés à l'aide enthalpie de base, bien que parfois cela se fait tort.
Les systèmes ouverts
En thermodynamique des systèmes ouverts, la matière peut se écouler dans et hors des limites du système. La première loi de la thermodynamique pour les systèmes ouverts qui suit: l'augmentation de l'énergie interne d'un système est égale à la quantité d'énergie ajoutée au système par les matières se écoulant dans et par chauffage, moins la quantité perdue par la matière qui se écoule et dans la forme . des travaux effectués par le système La première loi pour les systèmes ouverts est donnée par:
où U est l'énergie interne moyenne à l'entrée du système et U out est l'énergie interne moyenne laissant le système

La région de l'espace délimitée par les frontières entre systèmes ouverts est généralement appelé un volume de contrôle, et il peut ou peut ne pas correspondre aux murs physiques. Si l'on choisit la forme du volume de commande de telle sorte que tout écoulement avant ou arrière se produit perpendiculairement à sa surface, puis l'écoulement de la matière dans le système exécute un travail comme si ce était un piston de fluide masse poussant dans le système, et le système effectue travaux sur le flux de la matière comme se il était au volant d'une piston du fluide. Il ya alors deux types de travaux effectués: Travaux de flux décrit ci-dessus, qui est effectuée sur le fluide (ce est également souvent appelé  travail) et l'arbre de travail qui peut être effectué sur un certain dispositif mécanique.
travail) et l'arbre de travail qui peut être effectué sur un certain dispositif mécanique.
Ces deux types de travaux sont exprimés dans l'équation:
Remplacement dans l'équation ci-dessus pour les rendements cv de volume de commande:
La définition de l'enthalpie, H, nous permet d'utiliser ce potentiel thermodynamique pour tenir compte à la fois l'énergie et  travailler dans les fluides pour les systèmes ouverts:
travailler dans les fluides pour les systèmes ouverts:
Pendant fonctionnement en régime permanent d'un dispositif (voir turbine, pompe , et moteur), l'expression ci-dessus peut être réglé égal à zéro. On obtient une expression utile pour la la production d'énergie ou d'une exigence pour ces dispositifs en l'absence de réactions chimiques:
Cette expression est décrite par le schéma ci-dessus.
Variations d'enthalpie standard
Définitions
Changement d'enthalpie standard de la combustion
| " | Enthalpie standard de combustion est définie comme la variation d'enthalpie observé dans un système thermodynamique lorsque constituant une mole d'une substance brûle complètement en raison de l'oxygène sous des conditions standard. | " |
Changement d'enthalpie standard d'hydrogénation
| " | Enthalpie standard d'hydrogénation est la variation d'enthalpie observé dans un système thermodynamique constituant, quand une mole d'un composé insaturé réagit complètement avec un excès d'hydrogène dans des conditions classiques pour former un composé saturé. | " |
Changement d'enthalpie standard de formation
| " | Variation d'enthalpie standard de formation est définie comme la variation d'enthalpie observé dans un système thermodynamique lorsque constituant une mole d'un composé est formé à partir de ses antécédents élémentaires dans des conditions standard. | " |
Changement Enthalpie de réaction
| " | Variation d'enthalpie standard de réaction (noté H ° ou H | " |
Enthalpie Lattice
| " | Treillis enthalpie est l'enthalpie requise nécessaire pour séparer une mole d'un composé ionique en ions gazeux séparés à une distance infinie de l'autre (ce qui signifie aucune force d'attraction) dans des conditions standard. . | " |
Un changement de norme commune est l'enthalpie variation d'enthalpie standard de formation, qui a été déterminée pour un grand nombre de substances. La variation d'enthalpie de réaction dans toutes les conditions peut être calculée, étant donné la variation d'enthalpie standard de formation de tous les réactifs et produits.
D'autres types de changement enthalpie standard incluent la combustion ( changement norme enthalpie de combustion), la neutralisation ( changement norme enthalpie de neutralisation), de fusion / congélation ( changement enthalpie standard de la fusion), vaporisation / condensation ( changement norme enthalpie de vaporisation), atomisation ( changement norme enthalpie de pulvérisation), mélange ( changement norme enthalpie de mélange), la dissolution ( changement enthalpie standard de la solution), et dénaturation (de changement enthalpie standard de dénaturation).
Exemples: composés inorganiques (à 25 ° C)
| Composé chimique | Phase (matière) | Formule chimique | Δ H f 0 en kJ / mol |
|---|---|---|---|
| L'ammoniac (hydroxyde d'ammonium) | aq | NH 3 (NH 4 OH) | -80,8 |
| Ammoniac | g | NH 3 | -46,1 |
| Sulfate de cuivre (II) | aq | CuSO 4 | -769,98 |
| Le carbonate de sodium | s | Na 2 CO 3 | -1131 |
| Le chlorure de sodium (sel de table) | aq | NaCl | -407 |
| Le chlorure de sodium (sel de table) | s | NaCl | -411,12 |
| Le chlorure de sodium (sel de table) | l | NaCl | -385,92 |
| Le chlorure de sodium (sel de table) | g | NaCl | -181,42 |
| L'hydroxyde de sodium | aq | NaOH | -469,6 |
| L'hydroxyde de sodium | s | NaOH | -426,7 |
| Le nitrate de sodium | aq | NaNO 3 | -446,2 |
| Le nitrate de sodium | s | NaNO 3 | -424,8 |
| Le dioxyde de soufre | g | SO 2 | -297 |
| Acide sulfurique | l | H 2 SO 4 | -814 |
| Silice | s | SiO 2 | -911 |
| Le dioxyde d'azote | g | NO 2 | 33 |
| Le monoxyde d'azote | g | NO | 90 |
| Eau | l | H 2 O | -286 |
| Eau | g | H 2 O | -241,8 |
| Le dioxyde de carbone | g | CO 2 | -393,5 |
| Hydrogène | g | H 2 | 0 |
| Fluor | g | F 2 | 0 |
| Chlore | g | Cl 2 | 0 |
| Brome | l | Br 2 | 0 |
| Brome | g | Br 2 | 31 |
| Iode | s | Je ai 2 | 0 |
| Iode | g | Je ai 2 | 62 |
| Sulfate de zinc | aq | ZnSO 4 | -980,14 |
- (État: g = gazeux; l = liquide; s = solide; aq = aqueuse)
Enthalpie spécifique
L'enthalpie spécifique d'un masse de travail est une propriété de cette masse utilisé dans la thermodynamique , définie comme 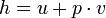 où u est l'énergie interne spécifique, p est la pression, et v est le volume spécifique. Autrement dit,
où u est l'énergie interne spécifique, p est la pression, et v est le volume spécifique. Autrement dit, 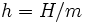 où
où  est la masse du système. Le Unité SI de enthalpie spécifique est joules par kilogramme.
est la masse du système. Le Unité SI de enthalpie spécifique est joules par kilogramme.

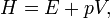
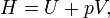
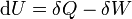
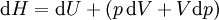
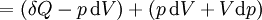
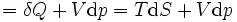
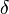 représente le différentielle inexacte.
représente le différentielle inexacte. 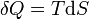 est l'énergie ajoutée par le chauffage au cours d'une processus réversible,
est l'énergie ajoutée par le chauffage au cours d'une processus réversible, 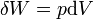 est le travail effectué par le système dans un processus réversible.
est le travail effectué par le système dans un processus réversible. 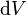 est un le volume infinitésimal
est un le volume infinitésimal