
Henipavirus
À propos de ce écoles sélection Wikipedia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. parrainage SOS enfant est cool!
| Henipavirus | |
|---|---|
| Classification des virus | |
| Groupe: | Groupe V ( (-) SsRNA) |
| Ordre: | Mononegavirales |
| Famille: | Paramyxoviridae |
| Genre: | Henipavirus |
| Espèce-type | |
| Hendravirus | |
| Espèce | |
Henipavirus est un genre de la famille Paramyxoviridae, ordre Mononegavirales contenant deux membres, Hendravirus et Nipahvirus. Les henipavirus sont naturellement hébergé par Pteropid chauves-souris frugivores (roussettes) et se caractérisent par une grande génome, une large gamme d'hôtes et de leur récente émergence en tant que agents pathogènes zoonotiques capables de causer la maladie et la mort dans animaux domestiques et les humains .
Structure de Virus
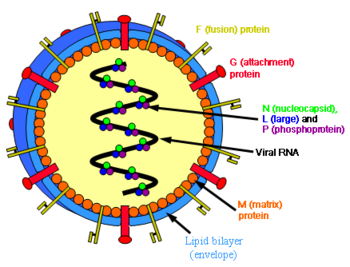

Henipavirus sont pléomorphe (forme variable), dont la taille varie de 40 à 600 nm de diamètre. Ils possèdent un lipide membrane recouvrant une coque virale protéine de la matrice. Au cœur est un simple brin hélicoïdale de génomique ARN étroitement liée à N (nucléocapside) et la protéine associée à la L (large) et les protéines (P) phosphoprotéine qui fournissent une activité de polymérase d'ARN pendant la réplication.
Ancrés dans la membrane lipidique des pointes de F (fusion) trimères de protéines et G (pièce jointe) tétramères de protéines. La fonction de la protéine G est d'attacher le virus à la surface d'une cellule hôte par l'intermédiaire éphrine B2, une protéine hautement conservée présente chez de nombreux mammifères. La protéine F fusionne la membrane virale avec la membrane de la cellule hôte, libérant le contenu du virion dans la cellule. Il provoque aussi des cellules infectées à fusionner avec les cellules voisines pour former grande, multinucléées syncytia.
la structure du génome
Comme tous les virus dans l'ordre Mononegavirales, le virus Hendra et Nipah génomes de virus sont non segmenté, simple brin ARN de sens négatif. Les deux génomes sont 18,2 kb et contiennent six gènes correspondant aux six protéines structurales.
En commun avec les autres membres de la sous-famille Paramyxovirinae, le nombre de nucléotides dans le génome de Henipavirus est un multiple de six, connue comme la «règle de six». Déviation de la règle de six, par mutation ou la synthèse du génome incomplet, conduit à la réplication virale inefficace, probablement en raison de contraintes structurelles imposées par la liaison entre l'ARN et la protéine N.
Henipavirus emploient un processus inhabituel appelé édition de l'ARN pour générer de multiples protéines à partir d'un seul gène. Le procédé implique l'insertion d'appoint résidus de guanosine dans le gène P ARNm avant traduction. Le nombre de résidus ajoutés détermine si le P, V ou W protéines sont synthétisées. Les fonctions des protéines V et W sont inconnues, mais elles peuvent être impliquées dans les mécanismes de perturber antiviraux hôte.
Virus Hendra
Émergence
Virus Hendra (à l'origine équine morbillivirus) a été découvert en Septembre 1994 quand il a causé la mort de quatorze chevaux , et un entraîneur à un complexe de formation Hendra, une banlieue de Brisbane en Queensland, Australie .
Le cas index, une jument, a été logé avec 23 autres chevaux après être tombé malade et est mort deux jours plus tard. Par la suite, 19 des chevaux restants succombé avec 13 mourants. Tant le formateur et une main stable ont été impliqués dans les soins infirmiers le cas index et les deux sont tombés malades dans la semaine suivant la mort du cheval avec une maladie de type grippal. La main stable récupéré alors que le formateur est mort d'insuffisance respiratoire et rénale. La source du virus était le plus susceptible écoulement nasal mousseuse du cas index.
Une seconde foyer est apparu en Août 1994 (précédant chronologiquement la première épidémie) dans Mackay 1000 km au nord de Brisbane entraînant la mort de deux chevaux et leur propriétaire. Le propriétaire a aidé à autopsies des chevaux et dans les trois semaines a été admis à l'hôpital souffrant d' une méningite . Il a récupéré, mais 14 mois plus tard développé des signes neurologiques et mourut. Ce foyer a été diagnostiqué rétrospectivement par la présence des virus Hendra dans le cerveau du patient.
Une enquête de la faune dans les aires grégarigènes a été menée et a identifié roussettes pteropid comme la source la plus probable de virus Hendra avec un séroprévalence de 47%. Tous les 46 autres espèces échantillonnées étaient négatifs. isolements de virus de l'appareil reproducteur et l'urine de chauves-souris sauvages ont indiqué que la transmission aux chevaux peut-être produite par une exposition à l'urine de chauve-souris ou fluides accouchement ..
Épidémies
Un total de huit foyers de virus Hendra ont eu lieu depuis 1994, toutes les infections impliquant des chevaux. Quatre de ces foyers se propager aux humains à la suite d'un contact direct avec des chevaux infectés.
- Août 1994, Mackay, Queensland: Mort de deux chevaux et une seule personne.
- Septembre 1994, Brisbane, Queensland: 14 chevaux sont morts sur un total de 20 infectées. Deux personnes infectées par un décès.
- Janvier 1999, Cairns, Queensland: Décès d'un cheval.
- Octobre 2004, Cairns, Queensland: Décès d'un cheval. Un vétérinaire impliqué dans l'autopsie du cheval a été infecté par le virus Hendra et a subi une maladie bénigne.
- Décembre 2004, Townsville, Queensland: Décès d'un cheval.
- Juin 2006, Sunshine Coast: Décès d'un cheval.
- Juillet 2008, Brisbane, Queensland: Infection de trois chevaux avec un décès. Un travailleur vétérinaire de la propriété touchée a été testé positif aux anticorps au virus Hendra.
- Juillet 2008 Cannonvale, Queensland: Décès d'un cheval.
La répartition des renards volants noir et lunettes couvre les sites de flambées, et le calendrier des incidents indique une tendance saisonnière des épidémies qui pourraient être liées à la saisonnalité de roussette accouchement. Comme il n'y a aucune preuve de transmission à l'homme directement à partir de chauves-souris, on pense que l'infection humaine se produit uniquement par l'intermédiaire d'un hôte intermédiaire.
Pathologie
Roussettes sont pas affectés par l'infection par le virus Hendra. Les symptômes de l'infection par le virus Hendra de l'homme peuvent être des voies respiratoires, y compris l'hémorragie et œdème des poumons, ou encéphalite entraînant la méningite . Chez les chevaux, l'infection provoque généralement un œdème pulmonaire et de la congestion.
Virus Nipah
Émergence

Virus Nipah a été identifié en 1999 quand il a causé une épidémie de maladie neurologique et respiratoire des élevages de porcs dans la péninsule de Malaisie , entraînant 105 décès humains et l'abattage d'un million de porcs. Dans Singapour , 11 cas, dont un décès se sont produits chez les travailleurs des abattoirs exposés à des porcs importés des fermes touchées malaisiens. Le virus Nipah a été classé par la CDC comme un agent de catégorie C ( http://www.bt.cdc.gov/agent/agentlist-category.asp).
Les symptômes de l'infection de l'épidémie de Malaisie étaient principalement encéphalite chez l'homme et respiratoire chez les porcs. Épidémies ultérieures ont causé des maladies respiratoires chez les humains, ce qui augmente le risque de transmission d'humain à humain et indiquant l'existence de souches plus dangereuses du virus.
Basé sur des données de séroprévalence et isolements de virus, le principal réservoir du virus Nipah a été identifié comme Pteropid roussettes dont Pteropus vampyrus (Malayan roussette) et Pteropus hypomelanus (Île de roussette), qui tous deux se produisent en Malaisie.
La transmission du virus Nipah de roussettes aux porcs est pensé pour être dû à un chevauchement croissant entre les habitats de chauves-souris et des porcheries dans la Malaisie péninsulaire. A la ferme de l'indice, les vergers étaient à proximité de la porcherie, permettant le déversement de l'urine, les fèces et les fruits partiellement mangé sur les porcs. Des études rétrospectives montrent que débordement virale en porcs peut avoir été pratiquée en Malaisie depuis 1996 sans détection. En 1998, la propagation virale a été facilitée par le transfert de porcs infectés à d'autres exploitations où de nouveaux foyers se sont déclarés.
Épidémies
Huit autres foyers de virus Nipah ont eu lieu depuis 1998 , le tout dans Bangladesh voisins et parties de l'Inde . Les sites de flambées se situent dans la gamme des espèces Pteropus (Pteropus giganteus). Comme par le virus Hendra, le calendrier des foyers indique un effet saisonnier.

- 31 Janvier 2001 - Février 23, Siliguri, Inde: 66 cas avec un taux de mortalité de 74%. 75% des patients étaient soit personnel de l'hôpital ou se il avait visité l'un des autres patients à l'hôpital, indiquant une transmission de personne à personne.
- 2001 Avril - mai District Meherpur, Bangladesh: 13 cas avec neuf décès (mortalité de 69%).
- Janvier 2003, District Naogaon, Bangladesh: 12 cas avec huit morts (mortalité de 67%).
- 2004 Janvier - Février Manikganj et Rajbari provinces, Bangladesh: 42 cas avec 14 décès (mortalité de 33%).
- 2004 19 Février - 16 Avril, District de Faridpur, Bangladesh: 36 cas avec 27 décès (mortalité de 75%). Les données épidémiologiques suggèrent fortement que cette épidémie impliqué transmission du virus Nipah, qui ne avait pas été confirmée de personne à personne. 92% des cas impliqué contact étroit avec au moins une autre personne infectée par le virus Nipah. Dans deux cas, une exposition de courte unique à un patient malade, y compris un conducteur de pousse-pousse qui a transporté un patient à l'hôpital. En outre, au moins six cas impliqués syndrome de détresse respiratoire aiguë qui n'a pas été signalé précédemment pour la maladie du virus Nipah chez l'homme. Ce symptôme est susceptible d'avoir aidé l'homme à homme transmission par grande dispersion de gouttelettes.
- Janvier 2005, Le district de Tangail, Bangladesh: 12 cas avec 11 décès (mortalité de 92%). Le virus a été probablement contracté partir de la date de boire du jus de palme contaminés par des excréments de chauves-souris de fruits ou de la salive.
- 2007 Février - mai Nadia District, Inde: jusqu'à 50 cas suspects avec 3-5 décès. Le site du foyer en périphérie du quartier du Bangladesh Kushtia où huit cas de virus Nipah encéphalite avec cinq décès ont eu lieu en Mars et Avril 2007. Elle avait été précédée par une épidémie dans Thakurgaon cours de Janvier et Février affecter sept personnes avec trois décès. Tous les trois épidémies ont montré des preuves de transmission de personne à personne.
- 2008 février-mars, et Manikganj Rajbari provinces, Bangladesh: Neuf cas avec huit morts.
Onze cas isolés d'encéphalite à virus Nipah ont également été documentés au Bangladesh depuis 2001.
Le virus Nipah a été isolé de la roussette de Lyle (Pteropus lylei) au Cambodge et de l'ARN viral dans l'urine et la salive de P. batte roundleaf de lylei et Horsfield (Hipposideros larvartus) en Thaïlande . Virus infectieux a également été isolé dans des échantillons environnementaux de chauve-souris de l'urine et des fruits partiellement mangé en Malaisie. Anticorps à henipavirus ont également été trouvés dans les roussettes (Pteropus rufus, Eidolon dupreanum) dans Madagascar indiquant une large répartition géographique des virus. Aucune infection des humains ou d'autres espèces ont été observées au Cambodge, en Thaïlande ou Madagascar.
Pathologie
Chez l'homme, l'infection présente comme la fièvre, des maux de tête et de la somnolence. Toux, douleurs abdominales, nausées, vomissements, faiblesse, problèmes de déglutition et une vision trouble sont relativement fréquentes. Environ un quart des patients avoir des convulsions et environ 60% deviennent comateux et pourrait avoir besoin d'une ventilation mécanique. Chez les patients avec une maladie grave, de leur état de conscience peut se détériorer et ils peuvent développer une hypertension sévère, la fréquence cardiaque rapide, et très haute température.
Le virus Nipah est également connu pour provoquer une encéphalite rechute. Dans la flambée malaisienne initiale, un patient se est présenté à la rechute de l'encéphalite de quelque 53 mois après son infection initiale. Il ne existe aucun traitement définitif pour Nipah encéphalite, en dehors des mesures de soutien, comme la ventilation mécanique et la prévention de l'infection secondaire. La ribavirine, un médicament antiviral, a été testé dans le déclenchement de la Malaisie et les résultats sont encourageants, même si d'autres études sont encore nécessaires.
Chez les animaux, en particulier chez les porcs, le virus provoque respiratoire porcin et le syndrome neurologique aussi connu comme aboyer syndrome de porc ou une toux mile.
Les causes de l'émergence
L'émergence de henipavirus parallèle l'émergence d'autres virus zoonotiques au cours des dernières décennies. Coronavirus du SRAS, Lyssavirus de chauve-souris australien, Menangle virus et probablement Virus Ebola et virus de Marburg sont également hébergé par les chauves-souris et sont capables d'infecter une variété d'autres espèces. L'émergence de chacun de ces virus a été lié à une augmentation de contact entre les chauves-souris et les humains, impliquant parfois un hôte intermédiaire d'un animal domestique. Le contact accru est entraîné à la fois par l'empiétement humain sur le territoire des chauves-souris (dans le cas de Nipah, porcheries spécifiquement dans ledit territoire) et par le mouvement des chauves-souris vers les populations humaines en raison de changements dans la distribution alimentaire et la perte de l'habitat.
Il est la preuve de la perte d'habitat pour les renards à la fois en Asie du Sud et en Australie voler (en particulier le long de la côte est) ainsi que l'empiètement des habitations humaines et de l'agriculture dans les habitats restants, créant plus grand chevauchement de l'humain et de vol distributions de renard.

