
Van der Waals
Saviez-vous ...
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. Visitez le site Web d'enfants SOS au http://www.soschildren.org/
- Le van der Waals est une équation équation d'état qui peut être dérivé d'une forme particulière du potentiel entre une paire de molécules (sphère dure répulsion et R -6 van der Waals attraction).
En chimie physique, le nom de van der Waals vigueur se réfère aux forces d'attraction ou de répulsion entre les molécules (ou entre des parties de la même molécule), autres que celles dues à ou des liaisons covalentes à la interaction électrostatique des ions entre eux ou avec des molécules neutres. Le terme comprend: dipôle-dipôle, dipôle induit-dipôle et Londres (dipôle induit dipolaire induites instantanées) forces. Il est aussi parfois utilisé abusivement comme synonyme de la totalité des forces intermoléculaires. Van der Waals sont relativement faibles par rapport aux liaisons chimiques normales, mais jouent un rôle fondamental dans des domaines aussi divers que la chimie supramoléculaire, la biologie structurale, la science des polymères, la nanotechnologie, la science des surfaces et la physique de la matière condensée .
Définition
Van der Waals comprennent attractions momentanées entre les molécules, éléments libres diatomiques, et des atomes individuels. Ils diffèrent covalente et une liaison ionique en ce qu'ils ne sont pas stables, mais sont provoqués par des particules de polarisation momentanée. Parce que les électrons ne ont pas de position fixe dans la structure d'un atome ou d'une molécule, mais sont distribuées de manière probabiliste sur la base de probabilité quantique, il ya une chance non négligeable que les électrons ne sont pas réparties uniformément et, partant, leurs charges électriques ne sont pas uniformément distribué. Voir Schrodinger équation pour les théories sur les fonctions d'onde et les descriptions de position et la vitesse des particules quantiques.
Pour expliquer cela, nous nous référons à l'article sur forces intermoléculaires, où il est parlé, et qui a une force intermoléculaire quatre contributions majeures. En général un potentiel intermoléculaire a une partie répulsive, interdisant l'effondrement de complexes moléculaires, et une partie attrayante. La partie intéressante, à son tour, se compose de trois contributions distinctes:
- Les interactions électrostatiques entre les charges (dans le cas des ions moléculaires), dipôles (dans le cas de molécules sans centre d'inversion), quadripôles (toutes les molécules à symétrie inférieur cube), et en général entre multipoles permanents. L'interaction électrostatique est parfois appelé Keesom interaction ou de force Keesom après Willem Hendrik Keesom.
- La seconde source d'attraction est l'induction (également connu sous le nom de polarisation), ce qui est l'interaction entre un permanent multipolaire sur une molécule avec une multipolaire induite sur l'autre. Cette interaction est parfois mesurée en Debye après Peter JW Debye.
- La troisième activité est généralement nommé d'après Fritz London qui se appelaient dispersion. Ce est la seule attraction subie par des atomes de gaz rares , mais il est actif entre ne importe quelle paire de molécules, indépendamment de leur symétrie.
De retour à la nomenclature: certains textes entendent par van der Waals forcer l'ensemble des forces (y compris répulsion), d'autres, toutes les forces attractives (et puis parfois distinguent van der Waals-Keesom, van der Waals-Debye, et van der Waals- Londres), et enfin certains utilisent le terme "force de van der Waals" uniquement comme un synonyme pour le / Forces de London. Donc, si vous tombez sur le terme "force de van der Waals», il est important de vérifier dans quelle école de pensée de l'auteur appartient.
Tous intermoléculaires / forces de van der Waals sont anisotrope (sauf ceux entre deux atomes de gaz rares), ce qui signifie qu'ils dépendent de l'orientation relative des molécules. Les interactions asynchrones et de dispersion sont toujours attrayante, quelle que soit l'orientation, mais l'interaction électrostatique change de signe lors de la rotation des molécules. Autrement dit, la force électrostatique peut être attractive ou répulsive, en fonction de l'orientation mutuelle des molécules. Quand les molécules sont en mouvement thermique, car ils sont dans la phase gazeuse et liquide, la force électrostatique est moyennée sur une grande mesure, parce que les molécules tournent thermiquement et ainsi les deux parties de sonde répulsives et attractives de la force électrostatique. Parfois, cet effet est exprimé par la déclaration que «mouvement thermique aléatoire autour de la température ambiante peut généralement surmonter ou les perturber» (qui renvoie à la composante électrostatique de la force de van der Waals). Il est clair que l'effet de moyennage thermique est beaucoup moins prononcée pour les forces d'induction et de dispersion attractifs.
Le Potentiel de Lennard-Jones est souvent utilisé comme un modèle approximatif pour la partie isotrope un total (répulsion, plus l'attraction) van der Waals en fonction de la distance.
Van der Waals sont responsables de certains cas d'élargissement de pression ( van der Waals élargissement) de raies spectrales et la formation de de van der Waals molécules.
Voir cette URL pour une description d'introduction de la force de van der Waals (comme une somme de composants attractifs seulement).
Forces de London
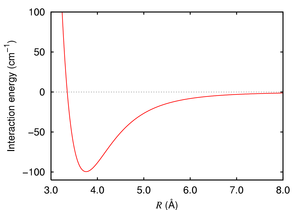
Londres forces de dispersion, nommé d'après le physicien germano-américain Fritz London, sont faible forces intermoléculaires qui découlent de la force d'attraction entre transitoire dipôles (ou supérieures) dans multipôles molécules sans permanent moments multipolaires. Les forces de dispersion de LONDON sont également connus en tant que forces de dispersion de London, de forces ou des forces dipôle-dipôle induit.
Forces de Londres peuvent être exposés par des molécules non polaires parce que la densité d'électrons se déplace une molécule probabiliste (voir la théorie de la mécanique quantique des forces de dispersion). Il ya de fortes chances que la densité électronique ne sera pas répartie uniformément dans une molécule non polaire. Quand une répartition inégale se produit, un multipolaire temporaire est créé. Ce multipolaire peut interagir avec d'autres multipoles proximité. Forces de Londres sont également présenter à polaires des molécules , mais ils sont généralement seulement un petite partie de la force d'interaction totale.
Densité électronique dans une molécule peut être redistribué par la proximité de l'autre multipolaire. Les électrons se réuniront sur le côté d'une molécule qui fait face à une charge positive et se retirer d'une charge négative. Par conséquent, une multipolaire transitoire peut être produit par une molécule polaire à proximité, ou encore par une multipolaire transitoire dans une autre molécule non polaire.
Dans le vide, les forces de Londres sont plus faibles que les autres des forces intermoléculaires telles que les interactions ioniques, une liaison hydrogène, ou des interactions dipôle-dipôle permanent.
Ce phénomène est la seule force intermoléculaire attractive à de grandes distances entre les atomes neutres (par exemple, hélium ), et est la force d'attraction majeure entre molécules non polaires, (par exemple, l'azote ou de méthane ). Sans forces de Londres, il n'y aurait pas force d'attraction entre gaz nobles atomes, et ils ne pouvaient alors être obtenu sous une forme liquide.
Londres forces deviennent plus forts que l'atome (ou molécule) en question devient plus grande. Cela est dû à la polarisabilité accrue des molécules avec des nuages d'électrons plus grandes et plus dispersés. Cette tendance est illustrée par les atomes d'halogène (du plus petit au plus grand: F 2, Cl 2, Br 2, I 2). Le fluor et le chlore sont des gaz à température ambiante, le brome est un liquide, et l'iode est un solide. Les forces de Londres deviennent également plus forte avec de plus grandes quantités de la surface de contact. Plus grand surface signifie une interaction plus étroite entre les différentes molécules.
Relation à l'effet Casimir
Les London-van der Waals est liée à l' effet Casimir pour les médias diélectriques, l'ancien de la description microscopique de la dernière propriété vrac. Les premiers calculs détaillés de cette ont été effectuées en 1955 par EM Lifshitz.
Pour plus d'enquête, on pourra consulter l'Université du travail de lévitation de St. Andrews dans un article populaire: Science Journal: Nouvelle façon de faire léviter des objets découverts, et dans une version plus savante: New Journal of Physics: la lévitation quantique par métamatériaux main gauche, qui se rapportent à l'effet Casimir le gecko et comment l'inversion de l'effet Casimir peut entraîner en lévitation physique des objets minuscules.
L'utilisation par les animaux

La capacité de geckos à grimper sur des surfaces abruptes a été attribuée à van der Waals. Une étude récente suggère que les molécules d'eau d'épaisseur environ monocouche (présent sur toutes les surfaces) jouent également un rôle .. Néanmoins, un gecko peut accrocher sur une surface de verre en utilisant un seul orteil. Les efforts se poursuivent pour créer un "ruban gecko" synthétique qui exploite cette connaissance. Jusqu'à présent, la recherche a produit des résultats prometteurs - la recherche a donné un début produit de ruban adhésif, qui ne obtient une fraction des forces mesurées à partir du matériau naturel, et de nouvelles recherches sont en cours d'élaboration avec l'objectif de 200 fois avec les forces d'adhérence de la matière naturelle. Les chercheurs du Rensselaer Polytechnic Institute et à l'Université d'Akron a annoncé dans un article publié dans le 18-22 Juin 2007 numéro des Actes de l'Académie nationale des sciences qu'ils ont créé un "ruban gecko" synthétique avec quatre fois la puissance de coller un pied de gecko naturel.
Des chercheurs de Université de Stanford et Université Carnegie Mellon a récemment développé un gecko-like robot qui utilise soies synthétiques d'escalader les murs.

