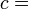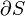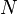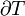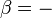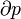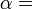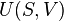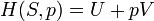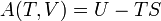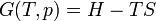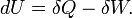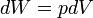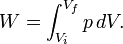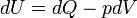Travail (thermodynamique)
Renseignements généraux
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Thermodynamique | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Le moteur thermique classique Carnot | |||||||||||||||||||||
Branches | |||||||||||||||||||||
Systèmes État: Équation d'état Idéal gaz · Gaz réel Phase de matière · Équilibre Contrôle du volume · Instruments Processus: Isobarique · Isochore · Isothermal Adiabatique · Isentropique · Isenthalpique Quasistatique · Polytropic Libre dilatation Réversibilité · Irréversibilité Endoreversibility Cycles: Les moteurs thermiques · Pompes à chaleur L'efficacité thermique | |||||||||||||||||||||
Propriétés système diagrammes de propriété Propriétés intensives et extensives Fonctions d'Etat: Température / entropie ( intro. ) † Pression / Volume † Potentiel chimique / Particule non. † († Variables conjuguées) La qualité de vapeur Propriétés réduits fonctions du processus: · Travail chaleur | |||||||||||||||||||||
Propriétés des matériaux
| |||||||||||||||||||||
Équations Le théorème de Carnot · Clausius théorème · Relation fondamentale · Loi des gaz parfaits · Relations de Maxwell · Relations réciproques Onsager · Équations thermodynamiques de Bridgman Table des équations thermodynamiques | |||||||||||||||||||||
Potentiels L'énergie gratuite · Entropie gratuit
| |||||||||||||||||||||
Histoire et culture Philosophie: Entropie et l'heure · Entropie et de la vie Cliquet brownien Le démon de Maxwell la mort de chaleur paradoxe Le paradoxe de Loschmidt Synergetics Histoire: Général · Chaleur · Entropy · lois de gaz Mouvement perpétuel Théories: Théorie du calorique · Vis viva Théorie de la chaleur Équivalent mécanique de la chaleur La force motrice Publications: " Un expérimentale ... Enquête sur l'Heat " " Sur l'équilibre des substances hétérogènes " "Réflexions sur la Motive Power of Fire " Échéanciers de: Thermodynamique · Les moteurs thermiques Art: Surface thermodynamique de Maxwell Éducation: Entropie dispersion d'énergie | |||||||||||||||||||||
Dans la thermodynamique , le travail effectué par un système est l' énergie transférée par le système à un autre qui est représenté par des changements dans les contraintes mécaniques généralisées externes sur le système. En tant que tel, le travail thermodynamique est une généralisation de la notion de travail mécanique en mécanique.
Les contraintes mécaniques généralisées externes peuvent être chimiques, électromagnétiques (y compris radiatif, comme dans la puissance du laser), gravitationnelle, ou la pression / volume ou d'autres contraintes mécaniques tout simplement, y compris momental, comme dans le transfert radiatif. Travail thermodynamique est défini pour être mesurable de la seule connaissance de ces variables de contraintes macroscopiques externes. Ces variables macroscopiques se produisent toujours par paires conjuguées, par exemple la pression et le volume, densité de flux magnétique et l'aimantation, fraction molaire et le potentiel chimique. Dans le Système de mesure SI, le travail est mesurée en joules (symbole: J). La vitesse à laquelle le travail est effectué est pouvoir.
Histoire
1824
Travail, ce est à dire "poids soulevé d'une hauteur", a été défini à l'origine en 1824 par Sadi Carnot dans ses célèbres Réflexions de papier sur la puissance motrice du feu. Plus précisément, selon Carnot:
- Nous utilisons ici la force motrice (de travail) pour exprimer l'effet utile qu'un moteur est capable de produire. Cet effet peut toujours être comparée à l'élévation d'un poids à une certaine hauteur. Il a, comme on le sait, à titre de mesure, le produit du coefficient de pondération multiplié par la hauteur à laquelle il est soulevé.
1845

En 1845, le physicien anglais James Joule a écrit un article sur l'équivalent mécanique de la chaleur pour la réunion de l'Association britannique de Cambridge . Dans ce travail, il a rapporté son expérience la plus connue, dans laquelle le travail libéré par l'action d'un "poids tombant d'une hauteur" a été utilisé pour transformer une roue à aubes dans un baril d'eau isolé.
Dans cette expérience, la friction et agitation de la roue à aubes sur l'étendue d'eau causées chaleur devant être générée, qui, à son tour, augmente la température de l'eau. Tant le changement de température AT de l'eau et la hauteur de la chute des Dh mg de poids ont été enregistrés. En utilisant ces valeurs, Joule a pu déterminer la équivalent mécanique de la chaleur. Joule estimé un équivalent mécanique de la chaleur pour être 819 pi • lbf / Btu (4,41 J / cal). Les définitions modernes de la chaleur, le travail, la température et l'énergie ont tout lien avec cette expérience.
Vue d'ensemble
La première loi de la thermodynamique concerne les changements dans l'énergie interne d'un système thermodynamique à deux formes de transfert d'énergie.
Le concept de travail thermodynamique est plus général que celui du travail mécanique simple car il comprend d'autres types de transferts d'énergie ainsi. Un fait extrêmement important de comprendre, ce est que le travail est strictement thermodynamique et entièrement définie par ses variables mécaniques généralisées externes. L'autre forme de transfert d'énergie est la chaleur. De la chaleur est mesurée par le changement de température d'une quantité connue de substance matérielle calorimétrique; il est de l'essence de chaleur qui ne est pas défini par les variables mécaniques généralisées externes qui définissent le travail. Cette distinction entre le travail et la chaleur est l'essence cruciale de la thermodynamique .
Travail se réfère à des formes de transfert d'énergie qui peuvent être pris en compte en termes de changements dans les contraintes physiques macroscopiques externes sur le système, par exemple l'énergie qui va dans l'expansion du volume d'un système contre une pression externe, en conduisant un piston-tête hors d'un cylindre contre une force externe. Les travaux d'électricité nécessaire pour déplacer une accusation contre un champ électrique externe peut être mesurée.
Ceci est en contraste à la chaleur , qui est l'énergie qui est porté dans ou hors du système sous forme de transferts thermiques dans les mouvements microscopiques de particules, ou par rayonnement thermique. Il ya seulement cinq formes de transfert de chaleur: conduction, rayonnement , diffusion, frottement, en vrac et de cisaillement viscosité, et changement de phase. Convection de l'énergie ne est pas, comme parfois à tort supposée (une relique de la la théorie calorique de la chaleur), une forme de transfert de chaleur, parce convection est pas en soi un mouvement microscopique des particules microscopiques ou des photons, mais est un flux essentiel de la matière pondérable avec son énergie interne. Parce que, selon la Principe zéro de la thermodynamique, il n'y a qu'un seul type de chaleur, il est également possible de définir une grandeur macroscopique conjugué à la température, à savoir l'entropie .
Définition formelle
Selon la première loi de la thermodynamique, toute augmentation nette de l'énergie interne U d'un système thermodynamique doit être pleinement pris en compte, en termes de AQ de chaleur entrant dans le système et l'Aw de travail effectué par le système:
La lettre d indique une différentielle exacte, exprime que l'énergie interne U est une propriété de l'état du système; ils ne dépendent que de l'état initial et l'état final, et non pas sur le chemin emprunté. En revanche, le grec (la δ 's) de delta dans cette équation reflète le fait que le transfert de chaleur et le transfert de travail ne sont pas des propriétés de l'état final du système. Étant donné que l'état initial et l'état final du système, on ne peut dire ce que la variation totale de l'énergie interne était, pas combien de l'énergie sous forme de chaleur sortit, et combien le travail. Cela peut se résumer en disant que la chaleur et le travail ne sont pas fonctions de l'État du système.
Travail pression-volume
Travail pression-volume, (ou au travail pV) se produit lorsque le volume (V) d'une œuvre des modifications du système. PV est souvent mesuré en unités de litres atmosphères (non SI), où 1 L · atm = 101,325 J. Travaux PV un sujet important dans thermodynamique chimique.
travaux de pV est représenté par la suivante équation différentielle :
où:
- W = travail effectué sur le système
- p = pression
- V = volume
L'équation de travail ci-dessus est valable pour tout processus réversible d'un système fermé.
La première loi de la thermodynamique peut donc être exprimée comme
path dependence
Comme toutes les fonctions de travail, en général PV travail est chemin-dépendante et est donc un thermodynamique fonction de processus. Toutefois, dans le cas particulier d'une réversible processus adiabatique, le travail ne dépend pas sur le chemin. La première loi de la thermodynamique affirme 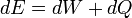 . Pour un processus adiabatique,
. Pour un processus adiabatique, 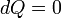 et donc le travail accompli doit être équivalent à un changement dans l'énergie interne, qui est proportionnelle à la variation nette de la température. Depuis les travaux ne dépend que de la variation de température, il ne est donc pas dépendante de la voie spécifique prise.
et donc le travail accompli doit être équivalent à un changement dans l'énergie interne, qui est proportionnelle à la variation nette de la température. Depuis les travaux ne dépend que de la variation de température, il ne est donc pas dépendante de la voie spécifique prise.
Si le processus a pris un autre chemin que le chemin adiabatique, le travail serait différent. Ce ne serait possible que si la chaleur coulait dans / sur le système, ce est à dire, il ne serait pas adiabatique. Dans un système donné, il existe de nombreux chemins entre deux températures, et il existe de nombreux chemins qui sont adiabatique. Mais il n'y a qu'une seule voie adiabatique entre deux températures. À partir de certains température initiale, chaque chemin adiabatique conduirait à une température finale différente. Mais entre deux températures données, il ya seulement une façon pour 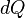 à zéro, mais il ya de nombreuses façons pour qu'il soit différent de zéro.
à zéro, mais il ya de nombreuses façons pour qu'il soit différent de zéro.
En termes mathématiques, l'écart 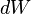 est un différentielle inexacte; Cependant dans le cas indépendante de chemin il peut être démontré être un différentielle exacte. Encore une fois à partir de la première loi,
est un différentielle inexacte; Cependant dans le cas indépendante de chemin il peut être démontré être un différentielle exacte. Encore une fois à partir de la première loi, 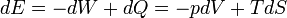 . Notez que
. Notez que 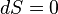 pour un processus réversible, donc
pour un processus réversible, donc 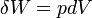 , Ce qui est exact. Étant donné que le différentiel de travail est exact, le travail peut être calculée d'une manière indépendante du chemin.
, Ce qui est exact. Étant donné que le différentiel de travail est exact, le travail peut être calculée d'une manière indépendante du chemin.
Pour être plus rigoureux, il doit être écrit DJW (avec une ligne passant par le d). En d'autres termes, ne est pas un DJW exact une forme. Le line-through est simplement un drapeau pour nous avertir il ya effectivement pas de fonction ( 0-forme)  qui est le potentiel des DJW. Se il y avait, en effet, cette fonction
qui est le potentiel des DJW. Se il y avait, en effet, cette fonction 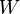 , Nous devrions être en mesure d'utiliser tout simplement Théorème de Stokes pour évaluer cette fonction putative, le potentiel de DJW, au limite de la voie, qui est, les points initial et final, et donc le travail serait une fonction d'état. Cette impossibilité est cohérent avec le fait qu'il n'a pas de sens de se référer aux travaux sur un point dans le diagramme pV; travail suppose un chemin.
, Nous devrions être en mesure d'utiliser tout simplement Théorème de Stokes pour évaluer cette fonction putative, le potentiel de DJW, au limite de la voie, qui est, les points initial et final, et donc le travail serait une fonction d'état. Cette impossibilité est cohérent avec le fait qu'il n'a pas de sens de se référer aux travaux sur un point dans le diagramme pV; travail suppose un chemin.
Énergie libre et exergie
La quantité de travail utile qui peut être extrait à partir d'un système thermodynamique est déterminée par la seconde loi de la thermodynamique . Dans le cadre de nombreuses situations pratiques, ce qui peut être représenté par la disponibilité thermodynamique, ou Exergy, fonction. Deux cas sont importantes: dans les systèmes thermodynamiques où la température et le volume sont maintenus constants, la mesure de atteignable utile de travail est le Fonction Énergie libre; et dans les systèmes où la température et la pression sont maintenus constants, la mesure de atteignable utile de travail est l' énergie libre de Gibbs .