
HIV
Fundo para as escolas Wikipédia
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.
| Vírus da imunodeficiência humana | |
|---|---|
 | |
| Micrografia eletrônica de varredura HIV-1 (em verde) brotamento do linfócito cultivado. As colisões redondas múltiplas na superfície da pilha representam locais de montagem e de brotação de viriões. | |
| Classificação Vírus | |
| Grupo: | Grupo VI ( ssRNA-RT) |
| Família: | Retroviridae |
| Género: | Lentivírus |
| Espécies | |
| |
Vírus da imunodeficiência humana (HIV) é um lentivírus (lentamente replicar retrovírus), que provoca a síndrome da imunodeficiência adquirida (SIDA), uma doença em seres humanos em que a insuficiência progressiva do sistema imune permite risco de vida infecções oportunistas e cânceres de prosperar. A infecção pelo HIV ocorre pela transferência de sangue , sémen, fluido vaginal, pré-ejaculatório, ou leite materno. Dentro destes fluidos corporais, o VIH está presente como partículas de vírus livres dentro e vírus infectado células do sistema imunológico.
O VIH infecta as células vitais no sistema imune humano, tais como células T auxiliares (especificamente As células T CD4 +), macrófagos, e células dendríticas. A infecção pelo HIV conduz a baixos níveis de As células T CD4 + através de um número de mecanismos, incluindo: apoptose de células vizinhas não infectadas, morte virai directa de células infectadas, e morte de células T CD4 + infectadas por Linfócitos citotóxicos CD8 que reconhecem as células infectadas. Quando o número de células T CD4 + diminuir abaixo de um nível crítico, Imunidade mediada por células é perdida, e o corpo torna-se progressivamente mais susceptível a infecções oportunistas.
Virologista
Classificação
| Espécies | Virulência | Infecciosidade | Predomínio | Deduzidos origem |
|---|---|---|---|---|
| HIV-1 | Alto | Alto | Global | Chimpanzé comum |
| HIV-2 | Diminuir | Baixo | África Ocidental | Sooty Mangabey |
O HIV é um membro do género Lentivírus, parte da família de Retroviridae. Lentivírus têm muitos morfologias e biológicas propriedades em comum. Muitas espécies são infectadas pelo lentivírus, que são caracteristicamente responsável por doenças de longa duração com uma longa período de incubação. Os lentivírus são transmitidos como de cadeia simples, positivo- sentido, envolto Vírus de ARN. Após a entrada na célula-alvo, a viral RNA genoma é convertido (transcrição reversa) em cadeia dupla de DNA por um codificada viralmente transcriptase que é transportada juntamente com o genoma viral na partícula de vírus reversa. O ADN viral resultante é então importado para o núcleo da célula e integrado no ADN celular por um codificada viralmente integrase e de acolhimento co-fatores. Uma vez integrado, o vírus pode ficar latente, permitindo que o vírus e a sua célula hospedeira para evitar a detecção pelo sistema imunológico. Alternativamente, o vírus pode ser transcrita, produzindo novos genomas de ARN e as proteínas virais que são empacotados e libertados a partir da célula como novas partículas virais que começam o ciclo de replicação de novo.
Dois tipos de VIH foram caracterizados: HIV-1 e HIV-2. HIV-1 é o vírus que foi inicialmente descoberto e denominado tanto LAV e HTLV-III. É mais virulento, mais infeccioso, e é a causa da maior parte das infecções de HIV a nível mundial. A infecciosidade inferior do HIV-2 em relação ao HIV-1 indica que menos de pessoas expostas ao HIV-2 serão infectados por exposição. Devido à sua relativamente fraca capacidade de transmissão, o HIV-2 é largamente confinado a África Ocidental .
Estrutura e genoma
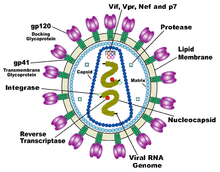
O HIV é diferente em estrutura de outros retrovírus. É mais ou menos esférica com um diâmetro de cerca de 120 nm, cerca de 60 vezes menor do que um células vermelhas do sangue, mas grande para um vírus. É composto de duas cópias de uma única cadeia positiva RNA que codifica para o vírus da nove genes fechados por uma cônica cápside composta de 2000 cópias da proteína virai p24. O ARN de cadeia simples está estreitamente relacionada com as proteínas da nucleocápside, P7, e enzimas necessárias para o desenvolvimento do virião tal como transcriptase reversa, proteases, ribonuclease e integrase. Uma matriz composta por p17 proteína virai envolve o capsídeo assegurar a integridade da partícula virião.
Este é, por seu turno, rodeada pela envelope viral que é composto por duas camadas de moléculas gordas chamadas fosfolípidos tomadas a partir da membrana de uma célula humana, quando um recém-formadas gemas de partículas de vírus a partir da célula. Incorporado no envelope virai são as proteínas da célula hospedeira e cerca de 70 cópias de uma proteína de HIV complexo que se projecta através da superfície da partícula do vírus. Esta proteína, denominada Env, consiste de um tampão feito de três moléculas chamadas glicoproteína (GP) 120, e uma haste que consiste em três moléculas gp41 que ancoram a estrutura dentro do envelope viral. O complexo glicoproteína do vírus permite a juntar-se e fundir-se com as células-alvo para iniciar o ciclo infeccioso. Ambas as proteínas de superfície, especialmente a gp120, têm sido considerados como alvos de futuros tratamentos ou vacinas contra o HIV.
O genoma de ARN é composta por, pelo menos, sete pontos de referência estruturais ( LTR, TAR, RRE, PE, SLIP, CRS, e INS), e nove genes (gag, pol, env e, tat, rev, nef, vif, vpr, vpu, e às vezes um décimo TEV, que é uma fusão de env tat e rev ), que codifica 19 proteínas. Três destes genes, gag, pol, env e, contêm informações necessárias para fazer as proteínas estruturais para novas partículas virais. Por exemplo, códigos de env para uma proteína chamada gp160 que é dividido por uma protease celular para formar a gp120 e gp41. A seis genes restantes, tat, rev, nef, vif, vpr, vpu e (ou vpx, no caso do HIV-2), são genes reguladores de proteínas que controlam a capacidade de HIV para infectar células, produzir novas cópias de vírus ( replicar), ou causar a doença.
As duas proteínas Tat (p16 e p14) são transactivadores transcrição para o promotor LTR agindo através da ligação ao elemento TAR RNA. O TAR também pode ser transformado em microRNAs que regulam a genes de apoptose ERCC1 e IER3. O Proteína Rev (p19) é envolvida em vaivém RNAs de o núcleo e o citoplasma pela ligação ao RRE elemento de ARN. A proteína Vif (p23) impede a acção de APOBEC3G (uma proteína celular que desamina ADN: híbridos de RNA e / ou interfere com a proteína Pol). O Proteína Vpr (p14) detenções divisão celular em G2 / M. A proteína Nef (p27) sub-regula CD4 (o principal receptor viral), bem como o De MHC de classe I e moléculas de classe II.
Nef também interage com Domínios SH3. A proteína Vpu (p16) influencia a liberação de novas partículas virais a partir de células infectadas. As extremidades de cada cadeia de ARN do VIH contêm uma sequência de ARN denominado repetição terminal longa (LTR). Regiões na LTR actuam como interruptores para controlar a produção de novos vírus e pode ser desencadeada por proteínas de HIV ou da célula hospedeira. O Psi elemento está envolvido na embalagem genoma viral e reconhecido por proteínas gag e rev. O elemento de deslizamento (TTTTTT) está envolvido na grelha de leitura no quadro de leitura de gag-pol necessária para fazer Pol funcional.
Tropismo

O termo tropismo viral refere-se a que infecta os tipos de células pelo HIV. O HIV pode infectar uma grande variedade de células imunes tais como As células T CD4 +, macrófagos, e células microgliais. HIV-1 entry para os macrófagos e células T CD4 + é mediado através da interacção das glicoproteínas do envelope do virião (gp120) com a molécula de CD4 nas células alvo e também com co-receptores de quimiocinas.
Macrófagos (M-trópicos) estirpes de HIV-1, ou não- estirpes de indução de sincícios (INE) usar o receptor β -chemokine CCR5 para a entrada e são, portanto, capazes de se replicar em macrófagos e células T CD4 +. Esta co-receptor CCR5 é usado por quase todos primário de HIV-1 isolados independentemente do subtipo genético virai. Com efeito, os macrófagos desempenham um papel chave em diversos aspectos críticos da infecção pelo HIV. Elas parecem ser as primeiras células infectadas por HIV e talvez a fonte de produção de VIH quando as células CD4 + se esgotam no paciente. Os macrófagos e células microgliais são as células infectadas pelo HIV no sistema nervoso central. Em amígdalas e adenóides de pacientes infectados pelo HIV, os macrófagos fundir em células gigantes multinucleadas que produzem enormes quantidades de vírus.
T-trópico isolados, ou de indução de sincícios (SI) estirpes de replicar em células T CD4 + primárias, bem como em macrófagos e utilizar o receptor -chemokine α, CXCR4, para a entrada. Dual-tropic HIV-1 estirpes estão pensados para serem estirpes de transição de HIV-1 e, assim, são capazes de utilizar tanto CCR5 e CXCR4 como co-receptores para a entrada viral.
O α -chemokine SDF-1, um ligando para o receptor CXCR4, suprime a replicação de T-trópico HIV-1 isolados. Ela faz isso por regulação negativa da expressão de CXCR4 na superfície destas células. VIH que utilizam apenas o receptor de CCR5 são denominados R5; aqueles que utilizam apenas CXCR4 são denominados X4, e aqueles que usam tanto, X4R5. No entanto, o uso de co-receptor por si só não explica tropismo viral, tal como todos os vírus R5 não são capazes de utilizar CCR5 em macrófagos para uma infecção produtiva e HIV também pode infectar um subtipo de células dendríticas mielóides, que constituem, provavelmente, um reservatório que mantém a infecção quando o número de células CD4 + T caíram para níveis extremamente baixos.
Algumas pessoas são resistentes a algumas estirpes de HIV. Por exemplo, pessoas com o Mutação CCR5-Δ32 são resistentes à infecção com o vírus R5, tal como a mutação do HIV pára de se ligar a esta co-receptor, reduzindo a sua capacidade para infectar as células-alvo.
A relação sexual é o principal modo de transmissão do HIV. Ambos X4 e R5 HIV estão presentes na fluido seminal, que é passada a partir de um macho para a sua parceiro sexual. Os virions podem infectar inúmeros alvos celulares e disseminar em todo o organismo. No entanto, um processo de selecção leva a uma transmissão predominante do vírus R5 por essa via. Como esse processo seletivo funciona ainda está sob investigação, mas um modelo é que espermatozóides podem transportar selectivamente R5 VIH uma vez que possuem tanto o CCR3 e CCR5, CXCR4, mas não na sua superfície e que genital células epiteliais preferencialmente sequestrar vírus X4. Em pacientes infectados com o subtipo B do HIV-1, não é muitas vezes um interruptor do co-receptor na doença de fase tardia e variantes de t-trópico apareça que pode infectar uma variedade de células T através de CXCR4. Estas variantes seguida, replicar de forma mais agressiva com virulência elevado que causa o esgotamento rápido de células T, o colapso do sistema imunológico, e infecções oportunistas que marcam o advento da AIDS. Assim, durante o curso da infecção, a adaptação viral para o uso de CXCR4 em vez do CCR5 pode ser um passo-chave para a progressão para SIDA. Um número de estudos com indivíduos infectados com o subtipo B ter determinado que entre 40 e 50 por cento de pacientes com SIDA podem conter vírus da SI e, presume-se, os fenótipos X4.
HIV-2 é muito menos patogénico do que o HIV-1 e se encontra limitada na sua distribuição mundial. A adoção de "genes acessórios" por HIV-2 e seu padrão de uso mais promíscuo co-receptor (incluindo CD4-independência) podem ajudar o vírus em sua adaptação para evitar fatores de restrição inatas presentes em células hospedeiras. Adaptação para utilizar máquinas celular normal para permitir a transmissão e infecção produtiva também tem ajudado o estabelecimento de HIV-2 replicação em humanos. A estratégia de sobrevivência para qualquer agente infeccioso não é matar seu hospedeiro, mas em última análise, tornar-se um bactéria comensal. Tendo alcançado uma patogenicidade baixa, ao longo do tempo, as variantes mais bem sucedidos em transmissão será selecionado.
Ciclo de replicação

A entrada para o celular
HIV entra e macrófagos CD4 + As células T por o adsorção de glicoproteínas na superfície aos receptores na célula alvo seguido por fusão do envelope virai com a membrana celular e a libertação da cápside do HIV na célula.
A entrada para a célula começa com a interação do complexo envelope trimérico ( gp160 espiga) e ambos CD4 e um dos receptores de quimioquinas (em geral, quer CCR5 ou CXCR4, mas outros são conhecidos por interagir) na superfície da célula. gp120 liga-se a integrina α 4 β 7 de activação LFA-1 da integrina central envolvida no estabelecimento de sinapses virológicos, que facilitam eficiente célula-a-célula espalhamento do HIV-1. O pico gp160 contém domínios de ligação de CD4 e receptores de quimiocinas.
O primeiro passo na fusão envolve a ligação de alta afinidade da ligação de CD4 domínios gp120 ao CD4. Uma vez que a gp120 é ligado com a proteína CD4, o complexo de envelope sofre uma mudança estrutural, expondo os domínios da gp120 de ligação de quimioquina e permitindo-lhes interagir com o receptor de quimiocina alvo. Isto permite uma ligação dupla mais estável, o que permite que o péptido de fusão N-terminal de gp41 para penetrar a membrana celular. Repetir sequências em gp41, HR1 e HR2 então interagir, causando o colapso da porção extracelular da gp41 para um gancho de cabelo. Esta estrutura em ansa traz as membranas de células de vírus e fechar em conjunto, permitindo a fusão de membranas e subsequente entrada da cápside viral.
Depois de HIV tem ligado à célula alvo, o HIV ARN e várias enzimas, incluindo a transcriptase reversa, a integrase, a ribonuclease, e de protease, são injectados para dentro da célula. Durante o transporte baseado em microtúbulo para o núcleo, o genoma viral de cadeia simples de RNA é transcrito em ADN de cadeia dupla, o qual é então integrado num cromossoma hospedeiro.
O HIV pode infectar células dendríticas (DCs) deste CD4- Rota CCR5, mas utilizando uma outra via de tipo C receptores de lectina específica de manose, tais como DC-SIGN pode também ser usado. DC são uma das primeiras células encontradas pelo vírus durante a transmissão sexual. Estão actualmente pensados para desempenhar um papel importante por transmissão do HIV para células T, quando o vírus é capturado na mucosa por DCs. A presença de FEZ-1, que ocorre naturalmente em neurónios, é acreditado para prevenir a infecção de células por HIV.
Replicação e transcrição
Pouco depois da cápside virai entra na célula, uma enzima chamada transcriptase reversa liberta o de cadeia simples (+) Genoma de RNA a partir das proteínas virais e copia ligados em um ADN complementar (ADNc) molécula. O processo de transcrição reversa é extremamente propensa a erros, e as mutações resultantes podem causar resistência a drogas ou permitir que o vírus para escapar do sistema imunológico do corpo. A transcriptase reversa tem também actividade de ribonuclease que degrada o ARN virai durante a síntese de cDNA, bem como a actividade da polimerase de ADN dependente de ADN, que cria um sentido do ADN a partir do ADNc anti-sentido. Juntos, o ADNc e o seu complemento formar um ADN de cadeia dupla viral que é então transportada para o núcleo da célula. A integração do ADN virai no hospedeiro de célula genoma é levada a cabo por uma outra enzima chamada viral integrase.

Este ADN virai integrado pode então permanecer dormente, na fase latente de infecção por HIV. Para produzir ativamente o vírus, certo celular factores de transcrição precisa de estar presente, o mais importante dos quais é NF- κ B (NF kappa B), que é regulada positivamente quando as células T tornam-se activas. Isso significa que essas células com maior probabilidade de ser morto por HIV são aqueles infecção lutando atualmente.
Durante a replicação virai, o ADN integrado provirus é transcrita em ARNm, que é então emendado em pedaços menores. Estas pequenas peças são exportadas a partir do núcleo para o citoplasma, onde eles são traduzidos para as proteínas reguladoras Tat (que incentiva a nova produção de vírus) e Rev. Como a proteína Rev recentemente produzido acumula-se no núcleo, que se liga a mRNAs virais e permite que os ARN não excisado para deixar o núcleo, onde elas são então retido até emendados. Nesta fase, as proteínas estruturais gag e env são produzidos a partir do ARNm de comprimento completo. O ARN de tamanho total é, na verdade, o genoma do vírus; liga-se à proteína Gag e é embalado em novas partículas virais.
HIV-1 e HIV-2 parecem empacotar o seu ARN de forma diferente; HIV-1 ligam-se a qualquer ARN adequada, ao passo que o HIV-2 se ligam preferencialmente ao mRNA que foi usado para criar a própria proteína Gag. Isso pode significar que o HIV-1 é mais capaz de sofrer mutações (infecção por VIH-1 para SIDA progride mais rapidamente do que a infecção por HIV-2 e é responsável pela maioria das infecções globais).
Montagem e liberação

O passo final do ciclo virai, a montagem de novos viriões de VIH-1, começa na membrana plasmática da célula hospedeira. O Env poliproteína (gp160) passa pelo retículo endoplasmático e é transportado para o Complexo de Golgi onde é clivada pela furina resultando em duas glicoproteínas do envelope de HIV, gp41 e gp120. Estes são transportados para o membrana plasmática da célula hospedeira onde gp41 ancora à membrana gp 120 da célula infectada. Os Gag (p55) e Gag-Pol (p160) poliproteínas também associar-se com a superfície interna da membrana do plasma juntamente com o RNA genómico de HIV como a formação de viriões começa a germinar a partir da célula hospedeira. O virion brotou ainda é imaturo como o poliproteínas gag ainda precisa ser clivada na matriz real, capsídeo e proteínas nucleoc�side. Esta clivagem é mediado pela protease virai também embalado e pode ser inibida pela medicamentos anti-retrovirais da classe de inibidores de protease. Os vários componentes estruturais, em seguida, se reúnem para produzir um virion HIV maduro. Apenas os viriões maduros são então capazes de infectar uma outra célula.
Variabilidade genética

HIV é diferente de muitos vírus na medida em que tem muito alta variabilidade genética. Esta diversidade é um resultado da sua rápida ciclo de replicação , com a geração de viriões de 10 a cerca de 10 todos os dias, juntamente com um elevado taxa de mutação de aproximadamente 3 x 10 -5 por bases de nucleótidos por ciclo de replicação e Propriedades recombinogénicas de transcriptase reversa.
Este cenário complexo conduz à geração de muitas variantes do HIV em um paciente infectado único no decurso de um dia. Esta variabilidade é agravado quando uma única célula é infectada simultaneamente por duas ou mais estirpes diferentes de HIV. Quando a infecção simultânea ocorre, o genoma de viriões da progenia pode ser composto por cadeias de ARN a partir de duas estirpes diferentes. Este híbrido virião então infecta uma nova célula, onde é submetido a replicação. Quando isso acontece, a transcriptase reversa, saltando para trás e para a frente entre os dois modelos diferentes ARN, irá gerar uma retroviral recém-sintetizado Sequência de ADN recombinante que é um entre os dois genomas parentais. Esta recombinação é mais óbvio quando ocorre entre os subtipos.
O intimamente relacionado vírus da imunodeficiência símia (SIV) evoluiu em muitas cepas, classificadas pelas espécies de hospedeiros naturais. Estirpes de SIV do Macaco verde africano (SIVagm) e mangabey sooty (SIVsmm) são pensados para ter uma longa história evolutiva com os seus anfitriões. Estas máquinas têm adaptado para a presença do vírus, que está presente em níveis elevados no sangue do hospedeiro, mas evoca apenas uma resposta imune leve, não faz com que o desenvolvimento de símio SIDA, e não sofre extensa mutação e recombinação típica do HIV infecção em seres humanos.
Em contraste, quando estas estirpes infectar espécies que não tenham adaptado ao SIV (hospedeiros "heterólogos", tais como macacos rhesus ou cynomologus), os animais desenvolvem SIDA e o vírus gera diversidade genética semelhante ao que é visto na infecção pelo HIV humano. Chimpanzé SIV (SIVcpz), o parente do HIV-1 mais próximo genética, está associada com aumento da mortalidade e sintomas de SIDA, como em seu hospedeiro natural. SIVcpz parece ter sido transmitido há relativamente pouco tempo para chimpanzés e populações humanas, para que seus hospedeiros ainda não se adaptaram ao vírus. Este vírus também perdeu uma função do Gene Nef que está presente na maioria dos SIV; sem esta função, a depleção de células T é mais provável, levando a imunodeficiência.
Três grupos de HIV-1 foram identificadas com base em diferenças na região do envelope (env): H, N e O. O grupo M é o mais prevalente e está subdividido em oito subtipos (ou clados), com base em todo o genoma, que estão geograficamente distintas. O mais prevalente são subtipos B (encontrado principalmente na América do Norte e Europa), A e D (encontrado principalmente na África), e C (encontrado principalmente na África e na Ásia); estes subtipos formar ramificações na árvore filogenética que representam a linhagem do grupo M de VIH-1. A co-infecção com subtipos distintos dá origem a formas recombinantes circulantes (CRFs). Em 2000, o último ano em que foi feita uma análise da prevalência do subtipo global, 47,2% das infecções em todo o mundo eram do subtipo C, 26,7% eram do subtipo A / CRF02_AG, 12,3% eram do subtipo B, 5,3% eram do subtipo D, 3,2% eram de CRF_AE, e a 5,3% restantes foram feitos de outros subtipos e CRFs. A maioria HIV-1 pesquisa é focada na subtipo B; poucos laboratórios se concentrar em outros subtipos. A existência de um quarto grupo, "P", tem sido colocada a hipótese de um vírus com base em isolados em 2009. A estirpe é aparentemente derivado gorila SIV (SIVgor), isolado pela primeira vez gorila de planície ocidental em 2006.
A sequência genética do HIV-2 é apenas parcialmente homóloga ao HIV-1 e mais de perto se assemelhe ao da SIVsmm.
Diagnóstico

Muitas pessoas seropositivas não sabem que estão infectados com o vírus. Por exemplo, em 2001, menos do que 1% da população urbana sexualmente activa na África tinha sido testado, e esta proporção é ainda mais baixa em populações rurais. Além disso, em 2001, apenas 0,5% das mulheres grávidas que frequentam as unidades de saúde urbanas são aconselhadas, testado ou receber os seus resultados. Mais uma vez, essa proporção é ainda menor nas unidades de saúde rurais. Desde os doadores podem, portanto, ter conhecimento da sua infecção, doadores de sangue e hemoderivados utilizados na medicina e pesquisa médica são examinados rotineiramente para o HIV.
HIV-1 teste é inicialmente por um enzyme-linked immunosorbent assay (ELISA) para detectar anticorpos para o HIV-1. As amostras com resultado reativo do ELISA inicial são considerados HIV-negativos a menos que nova exposição a um parceiro infectado ou parceiro de HIV status desconhecido ocorreu. As amostras com um resultado de ELISA reactivo são testados em duplicado. Se o resultado do teste seja duplicado é reativo, o espécime é relatado como repetidamente reativo e passa por testes de confirmação com um teste complementar mais específico (por exemplo, Western blot ou, menos comumente, uma teste de imunofluorescência (IFA)). Somente os espécimes que são repetidamente reativa por ELISA e positiva por IFA ou reativa por Western blot são considerados HIV-positivo e indicativo de infecção pelo HIV. As amostras que são repetidamente ELISA reactivo ocasionalmente fornecer um resultado de Western blot indeterminado, que pode ser quer uma resposta de anticorpos ao HIV incompleta em uma pessoa infectada ou reacções não específicas em uma pessoa não infectada.
Embora IFA podem ser usadas para confirmar a infecção nestes casos ambíguos, este ensaio não é amplamente usado. Em geral, uma segunda amostra deve ser coletada mais de um mês mais tarde e testadas novamente para as pessoas com resultados indeterminados em Western blot. Embora muito menos comumente disponíveis, teste de ácido nucleico (por exemplo, ARN virai ou um método de amplificação de DNA pró-viral) podem também ajudar diagnóstico em certas situações. Além disso, algumas amostras testadas podem fornecer resultados inconclusivos por causa de uma baixa quantidade de amostra. Nestas situações, um segundo espécimen é recolhido e testado para a infecção por VIH.
Teste de HIV moderno é extremamente preciso. Um teste de rastreio único é correcta, mais de 99% do tempo. A chance de um resultado falso-positivo no protocolo de teste em duas etapas padrão é estimada em cerca de 1 em 250.000 em uma população de baixo risco. Testando pós-exposição é recomendado inicialmente e em seis semanas, três meses e seis meses.
Pesquisa
Pesquisa de HIV / AIDS inclui todos pesquisa médica que tenta prevenir, tratar ou curar o HIV / SIDA , bem como a investigação fundamental sobre a natureza do HIV como um agente infeccioso e SIDA como a doença causada pelo HIV.
Atualmente, não há cura para o VIH / SIDA existe. O método mais universalmente recomendada para o prevenção de HIV / AIDS é evitar o contato do sangue com sangue entre as pessoas e para a prática de outra forma sexo seguro. O método mais recomendado para o tratamento de HIV é para Pessoas seropositivas a receber atenção de um médico que iria coordenar o paciente de gestão de HIV / AIDS. Não há cura para o HIV / AIDS .
Muitos governos e instituições de pesquisa participar na investigação do VIH / SIDA. Esta pesquisa inclui comportamental intervenções de saúde, tais como a investigação sobre educação sexual, e desenvolvimento de medicamentos, tais como a investigação microbicidas para doenças sexualmente transmissíveis, Vacinas contra o HIV, e medicamentos anti-retrovirais. Outras áreas de pesquisa médica incluem os temas de profilaxia pré-exposição, profilaxia pós-exposição, e A circuncisão e HIV.
História
Descoberta
SIDA foi primeiro observado clinicamente em 1981 nos Estados Unidos. Os casos iniciais eram um grupo de usuários de drogas injetáveis e homens gays sem causa conhecida de imunidade diminuída que apresentaram sintomas de Pneumonia por Pneumocystis carinii (PCP), uma infecção oportunista rara que era conhecido por ocorrer em pessoas com sistemas imunológicos muito comprometidos. Logo depois, os homens gays adicionais desenvolveu um câncer de pele rara anteriormente chamado Sarcoma de Kaposi (KS). Muitos mais casos de PCP e KS surgiu, alertando Centros dos EUA para Controle e Prevenção de Doenças (CDC) e uma força-tarefa CDC foi formada para monitorar o surto.
No início, o CDC não tem um nome oficial para a doença, frequentemente referindo-se a ele por meio de as doenças que foram associados com ele, por exemplo, linfadenopatia, a doença depois que os descobridores do HIV originalmente chamado o vírus. Eles também usaram Sarcoma de Kaposi e Infecções Oportunistas, o nome pelo qual uma força-tarefa foi criada em 1981. Na imprensa geral, o termo GRID, que representava deficiência imunológica relacionada com o gay, havia sido cunhado. O CDC, em busca de um nome, e olhando para as comunidades infectadas cunhado "a doença 4H", como parecia destacar haitianos , homossexuais, hemofílicos e usuários de heroína. No entanto, depois de determinar que a AIDS não foi isolado para o comunidade gay, percebeu-se que o termo GRID era enganador e SIDA foi apresentado em uma reunião em julho de 1982. Em setembro de 1982, o CDC começou a usar o nome de AIDS.

Em 1983, dois grupos de pesquisa independentes liderada por Robert Gallo e Luc Montagnier declarou independente que um romance retrovírus pode ter sido infectar pacientes com AIDS, e publicou suas descobertas na mesma edição da revista Science. Gallo afirmou que um vírus seu grupo tinha isolado de um paciente de AIDS era notavelmente semelhante em forma para outra vírus T-linfotrópico humano (HTLVs) seu grupo tinha sido o primeiro a isolar. O grupo de Gallo chamado seu recém isolado vírus HTLV-III. Ao mesmo tempo, o grupo de Montagnier um vírus isolado a partir de um paciente que apresenta com aumento de volume da gânglios linfáticos do pescoço e fraqueza física, dois sintomas clássicos da AIDS. Contrariando o relatório do grupo de Gallo, Montagnier e seus colegas mostraram que as proteínas do núcleo do vírus eram imunologicamente diferente dos de HTLV-I. O grupo de Montagnier nomeou seu vírus isolado associado à linfadenopatia vírus (LAV). Como estes dois vírus acabou por ser o mesmo, em 1986, LAV e HTLV-III foram renomeado HIV.
Origins
Ambos HIV-1 e HIV-2 são acreditados para ter originado em não-humanos primatas em África Centro-Ocidental e de ter transferido para os seres humanos (um processo conhecido como zoonose) no início do século 20. HIV-1 parece ter se originado no sul de Camarões através da evolução do SIV (CPZ), um vírus da imunodeficiência símia (SIV) que infecta selvagens chimpanzés (HIV-1 desce do SIVcpz endêmica nas subespécies de chimpanzés Pan troglodytes troglodytes). O parente mais próximo do HIV-2 é o SIV (smm), um virus da presente mangabey sooty (Atys Cercocebus atys), um velho macaco mundo vivo em litoral África Ocidental (do sul do Senegal a oeste da Costa do Marfim ). Macacos do Novo Mundo, como o macaco coruja são resistentes à infecção por VIH-1, possivelmente devido a uma genómico fusão de dois genes de resistência virais. HIV-1 é pensado para ter saltado a barreira das espécies pelo menos em três ocasiões separadas, dando origem a três grupos de vírus, M, N e O.
Há evidências de que os seres humanos que participam Atividades de carne de animais selvagens, quer como caçadores ou como vendedores de carne de animais selvagens, comumente adquirir SIV. No entanto, é um vírus SIV fraca, e está normalmente suprimida pelo sistema imunológico humano dentro de semanas da infecção. Pensa-se que várias transmissões do vírus de pessoa para pessoa em rápida sucessão são necessários para permitir-lhe tempo suficiente para se transformar em HIV. Além disso, devido à sua taxa de transmissão relativamente baixa de pessoa para pessoa, só pode espalhar por toda a população, na presença de um ou mais dos canais de transmissão de alto risco, que se pensa ter sido ausente na África antes do século 20 .
Canais de transmissão específicas propostas de alto risco, permitindo que o vírus se adaptar para os seres humanos e se espalhou por toda a sociedade, em função do calendário proposto para a travessia de animais para humanos. Estudos genéticos do vírus sugere que o ancestral comum mais recente do grupo HIV-1 M remonta a cerca de 1910. Os proponentes desta ligação namoro a epidemia de HIV com o surgimento de o colonialismo eo crescimento das grandes cidades africanas coloniais, levando a mudanças sociais, incluindo um maior grau de promiscuidade sexual, a propagação do prostituição, ea alta freqüência concomitante de doenças de úlceras genitais (por exemplo, sífilis) em cidades coloniais nascentes. Enquanto as taxas de transmissão do HIV durante a relação sexual vaginal são baixos em circunstâncias normais eles são aumentadas muitas vezes, se um dos parceiros sofre de uma infecção sexualmente transmissível que resulta em úlceras genitais. 1900s a cidades coloniais foram notáveis devido à sua alta prevalência de úlceras genitais de prostituição e na medida em que a partir de 1928 como muitos como 45% das mulheres residentes do leste Kinshasa foram pensados para ter sido prostitutas e como de 1933 cerca de 15% de todos os residentes da mesma cidade foram infectados por uma das formas de sífilis.
Uma visão alternativa defende que as práticas médicas inseguras em África durante os anos seguintes à Segunda Guerra Mundial, como a reutilização de seringas não esterilizado de uso único durante a vacinação em massa, campanhas de tratamento antibiótico e anti-malária, foram o vector inicial, que permitiram que o vírus se adaptar aos seres humanos e spread.
O primeiro caso bem documentado de HIV num humano remonta a 1959 no Congo . O vírus pode ter estado presente nos Estados Unidos já em 1966.
