
Corrosión
Antecedentes de las escuelas de Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?
| |||||
La corrosión es la destrucción gradual de material, por lo general los metales, por reacción química con su entorno. En el uso más común de la palabra, esto significa electroquímica oxidación de los metales en la reacción con un oxidante tal como oxígeno . La oxidación, la formación de hierro óxidos, es un ejemplo bien conocido de la corrosión electroquímica. Este tipo de daño produce típicamente óxido (s) o sal (s) de la de metal original. La corrosión también puede ocurrir en materiales distintos de metales, tales como cerámica o polímeros, aunque en este contexto, el término degradación es más común. La corrosión se degrada las propiedades útiles de materiales y estructuras incluyendo la resistencia, la apariencia y la permeabilidad a los líquidos y gases.
Muchos estructural aleaciones se corroen meramente de la exposición a la humedad en el aire, pero el proceso puede ser fuertemente afectados por la exposición a ciertas sustancias. La corrosión puede ser concentrada localmente para formar un hoyo o grieta, o puede extenderse a través de la corrosión una amplia zona más o menos uniformemente la superficie. Debido a que la corrosión es un proceso controlado por difusión, que se produce en las superficies expuestas. Como resultado, los métodos para reducir la actividad de la superficie expuesta, tal como pasivación y conversión de cromato, puede aumentar la resistencia a la corrosión de un material. Sin embargo, algunos mecanismos de corrosión son menos visibles y menos previsibles.



La corrosión galvánica

La corrosión galvánica se produce cuando dos metales diferentes están en contacto físico o eléctrico entre sí y están inmersos en un común electrolito, o cuando el mismo metal está expuesta a electrolitos con diferentes concentraciones. En un par galvánico, el metal más activo (el ánodo) corroe a un ritmo acelerado y más de metal noble (el cátodo) corroe a una velocidad retardada. Cuando se sumerge por separado, cada metal se corroe a su propio ritmo. ¿Qué tipo de metal (s) a utilizar se determina fácilmente por la siguiente serie galvánica. Por ejemplo, el zinc se utiliza a menudo como un ánodo de sacrificio para estructuras de acero. La corrosión galvánica es de gran interés para la industria marina y también en cualquier parte del agua (sales que contienen) Contactos de tuberías o estructuras metálicas.
Factores tales como el tamaño relativo de ánodo, tipos de metal, y las condiciones de operación ( temperatura , humedad, salinidad, etc.) afecta a la corrosión galvánica. La relación de área de superficie del ánodo y cátodo afecta directamente a las velocidades de corrosión de los materiales. La corrosión galvánica se utiliza a menudo en ánodos de sacrificio.
Serie galvánica
En un entorno determinado (un medio estándar se airea, a temperatura ambiente del agua de mar ), un metal será ya sea más noble o más activos que otros, basado en la fuerza con sus iones están unidos a la superficie. Dos metales en cuota de contacto eléctrico de los mismos electrones, por lo que el "tira y afloja" en cada superficie es análoga a la competencia por los electrones libres entre los dos materiales. Usando el electrolito como huésped para el flujo de iones en la misma dirección, el metal activo se llevará electrones de la noble. El flujo de masa resultante o la corriente eléctrica pueden ser medidos para establecer una jerarquía de materiales en el medio de interés. Esta jerarquía se llama una serie galvánica y es útil en la predicción y la comprensión de la corrosión.
Eliminación de la corrosión
A menudo es posible eliminar químicamente los productos de corrosión. Por ejemplo ácido fosfórico en forma de jalea naval a menudo se aplica a herramientas o superficies ferrosas para eliminar el óxido. Eliminación de la corrosión no se debe confundir con electropulido, que elimina algunas capas de metal subyacente para crear una superficie lisa. Por ejemplo, el ácido fosfórico también puede ser utilizado para electropulido cobre, pero lo hace mediante la eliminación de cobre, no los productos de la corrosión del cobre.
Resistencia a la corrosión
Algunos metales son más resistentes intrínsecamente a la corrosión que los demás (para algunos ejemplos, ver la serie galvánica). Hay varias formas de proteger los metales contra la corrosión incluyendo la pintura, galvanizado por inmersión en caliente, y combinaciones de estos.
Química intrínseca

Los materiales más resistentes a la corrosión son aquellos para los que la corrosión es termodinámicamente desfavorable. Cualquier producto de corrosión de oro o platino tienden a descomponerse espontáneamente en metal puro, por lo que estos elementos se pueden encontrar en forma metálica en la Tierra y durante mucho tiempo han sido valoradas. Más "base" común metales sólo puede ser protegido por medios más temporales.
Algunos metales tienen naturalmente lento cinética de la reacción, a pesar de que su corrosión es termodinámicamente favorable. Estos incluyen metales tales como zinc , magnesio , y cadmio . Mientras que la corrosión de estos metales es continua y permanente, ocurre a una tasa aceptablemente lenta. Un ejemplo extremo es grafito, que libera grandes cantidades de energía sobre la oxidación, pero tiene tales cinética lenta que es efectivamente inmune a la corrosión electroquímica en condiciones normales.
La pasivación
La pasivación se refiere a la formación espontánea de una película ultrafina de productos de corrosión conocidos como película pasiva, en la superficie del metal que actúan como una barrera a la oxidación adicional. La composición química y microestructura de una película pasiva son diferentes del metal subyacente. Espesor de la película pasiva típica en aluminio, aceros inoxidables y aleaciones está a 10 nanómetros. La película pasiva es diferente de capas de óxido que se forman al calentar y están en el rango de espesor micrométrico - la película pasiva se recupera si eliminado o dañado mientras que la capa de óxido no lo hace. Pasivación en entornos naturales como el aire, el agua y el suelo en moderada pH se ve en materiales tales como aluminio , acero inoxidable, titanio , y de silicio .
La pasivación está determinada principalmente por factores metalúrgicos y ambientales. El efecto del pH se resume utilizando Pourbaix Diagramas, pero muchos otros factores son influyentes. Algunas condiciones que inhiben la pasivación incluyen pH alto para el aluminio y el zinc, bajo pH o la presencia de iones de cloruro para el acero inoxidable, de alta temperatura para el titanio (en cuyo caso el óxido se disuelve en el metal, en lugar de el electrolito) y iones fluoruro para el silicio. Por otro lado, las condiciones inusuales pueden resultar en la pasivación de materiales que son normalmente sin protección, ya que el ambiente alcalino de hormigón hace para acero barras de refuerzo. La exposición a un metal líquido como el mercurio o caliente soldadura a menudo puede eludir los mecanismos de pasivación.
La corrosión en materiales pasivadas
La pasivación es extremadamente útil en la mitigación de los daños por corrosión, sin embargo, incluso una aleación de alta calidad le corroe si su capacidad para formar una película pasivante se ve obstaculizada. La selección adecuada del grado correcto de material para el medio ambiente específico es importante para el rendimiento de larga duración de este grupo de materiales. Si ruptura se produce en la película pasiva debido a factores químicos o mecánicos, los principales modos de corrosión resultantes pueden incluir la corrosión por picaduras, corrosión de la grieta y corrosión bajo tensión.
La corrosión por picaduras

Ciertas condiciones, tales como bajas concentraciones de oxígeno o altas concentraciones de especies tales como el cloruro que completa como aniones , puede interferir con la capacidad de una aleación dada para volver a formar una película pasivante. En el peor de los casos, la casi totalidad de la superficie permanecerá protegido, pero pequeñas fluctuaciones locales degradará la película de óxido en unos pocos puntos críticos. La corrosión en estos puntos se amplificará en gran medida, y puede causar picaduras de corrosión de varios tipos, dependiendo de las condiciones. Mientras que las picaduras de corrosión sólo nuclean bajo circunstancias bastante extremas, pueden seguir creciendo incluso cuando las condiciones vuelvan a la normalidad, ya que el interior de un pozo es naturalmente privado de oxígeno y localmente el pH disminuye a valores muy bajos y la velocidad de corrosión aumenta debido a un proceso autocatalítico. En casos extremos, las afiladas puntas de extremadamente largos y estrechos puntos de corrosión puede causar la concentración de tensión hasta el punto de que las aleaciones de otro modo difíciles pueden romper; una película fina perforada por un agujero de forma invisible pequeño puede ocultar un pulgar pit tamaño de la vista. Estos problemas son especialmente peligrosos porque son difíciles de detectar antes de que una parte o estructura falla. Picaduras sigue siendo una de las formas más comunes y dañinos de la corrosión en las aleaciones de pasivadas, pero puede prevenirse mediante el control del medio ambiente de la aleación.
Decaimiento Weld y ataque knifeline


El acero inoxidable puede plantear problemas especiales de corrosión, ya que su comportamiento de pasivación se basa en la presencia de un componente de aleación principal ( cromo , al menos 11,5%). Debido a las elevadas temperaturas de soldadura y el tratamiento térmico, cromo carburos pueden formar en el límites de grano de aleaciones inoxidables. Esta reacción química roba el material de cromo en la zona cerca del límite de grano, por lo que esas áreas mucho menos resistente a la corrosión. Esto crea una par galvánico con la aleación bien protegido cerca, lo que conduce a soldar decaimiento (la corrosión de los límites de los granos en las zonas afectadas por el calor) en ambientes altamente corrosivos.
Se dice que una de acero inoxidable que sensibilizar si carburos de cromo se forman en la microestructura. Una microestructura típica de un acero inoxidable de tipo 304 normalizada no muestra signos de la sensibilización, mientras que un acero altamente sensibilizados muestra la presencia de precipitados límite de grano. Las líneas oscuras en la microestructura sensibilizado son redes de carburos de cromo formados a lo largo de los bordes de grano.
Aleaciones especiales, ya sea con bajo contenido de carbono o con carbono añadido " getters ", tales como el titanio y el niobio (en los tipos 321 y 347, respectivamente), puede evitar este efecto, pero estos últimos requieren tratamiento térmico especial después de la soldadura para evitar el fenómeno de ataque similar knifeline. Como su nombre lo indica, la corrosión se limita a un zona muy estrecha adyacente a la soldadura, a menudo sólo unos pocos micrómetros de diámetro, por lo que es mucho menos notable.
Corrosión de la grieta

Corrosión de la grieta es una forma localizada de la corrosión que ocurre en espacios confinados (grietas), a la que el acceso del fluido de trabajo desde el medio ambiente es limitada. La formación de un diferencial de células de aireación conduce a la corrosión dentro de las grietas. Los ejemplos de las grietas son las lagunas y zonas de contacto entre las partes, bajo empaquetaduras o juntas, grietas y costuras interiores, espacios llenos de depósitos y bajo montones de lodo.
Corrosión de la grieta se ve influenciada por el tipo de grieta (metal-metal, metal no metal), la geometría de la grieta (tamaño, acabado de la superficie), y los factores metalúrgicos y ambientales. La susceptibilidad a la corrosión de la grieta se puede evaluar con los procedimientos estándar de ASTM. A temperatura crítica corrosión de la grieta se utiliza comúnmente para clasificar la resistencia de un material a la corrosión de la grieta.
Corrosión microbiana
Corrosión microbiana, o comúnmente conocido como corrosión influenciada microbiológicamente (MIC), es una corrosión causada o promovido por microorganismos, por lo general quimioautótrofos. Se puede aplicar tanto a los materiales metálicos y no metálicos, en presencia o ausencia de oxígeno. Bacterias reductoras de sulfato son activos en ausencia de oxígeno (anaeróbico); que producen sulfuro de hidrógeno, causando estrés sulfuro de agrietamiento. En presencia de oxígeno (aerobio), algunas bacterias pueden oxidar directamente a los óxidos de hierro e hidróxidos de hierro, otras bacterias oxidan azufre y producen ácido sulfúrico causando corrosión de sulfuro biogénico. Células de concentración se pueden formar en los depósitos de productos de corrosión, lo que produce corrosión localizada.
Corrosión de bajamar Acelerado (ALWC) es una forma particularmente agresiva de MIC que afecta pilotes de acero en el agua de mar cerca de la marca de marea baja de agua. Se caracteriza por un lodo naranja, que huele a sulfuro de hidrógeno cuando se tratan con ácido. Las tasas de corrosión pueden ser muy elevados y las prestaciones de corrosión diseño pronto pueden ser superado dando lugar a un fallo prematuro de la pila de acero. Pilas que han sido recubrimiento y tener protección catódica instalado en el momento de la construcción no son susceptibles a ALWC. Para pilotes desprotegidos, ánodos de sacrificio pueden ser instalados local para las zonas afectadas para inhibir la corrosión o un sistema de ánodo de sacrificio modernizado completa se puede instalar. Las zonas afectadas también pueden ser tratadas electroquímicamente utilizando un electrodo a la primera producción de cloro para matar las bacterias, y luego a producido un depósito calcáreo, lo que ayudará a proteger el metal de nuevos ataques.
La corrosión de alta temperatura
La corrosión de alta temperatura es el deterioro químico de un material (típicamente un metal) como resultado del calentamiento. Esta forma no galvánica de la corrosión puede ocurrir cuando un metal se somete a un ambiente caliente que contiene oxígeno, azufre u otros compuestos capaces de oxidante (o ayudar a la oxidación de) el material en cuestión. Por ejemplo, los materiales utilizados en la industria aeroespacial, generación de energía e incluso en motores de automóviles tienen que resistir períodos prolongados a altas temperaturas en las que pueden estar expuestos a una atmósfera que contiene potencialmente productos altamente corrosivos de la combustión.
Los productos de la corrosión a alta temperatura potencialmente pueden convertirse a la ventaja del ingeniero. La formación de óxidos en aceros inoxidables, por ejemplo, puede proporcionar una capa protectora prevenir una mayor ataque atmosférica, lo que permite un material para ser utilizado durante períodos prolongados, tanto en ambiente y altas temperaturas en condiciones hostiles. Tales productos de corrosión de alta temperatura, en la forma de esmaltes capa de óxido compactados, prevenir o reducir el desgaste durante la alta temperatura de contacto de metal (o metálico y cerámico) superficies deslizantes.
Quitar el polvo de metal
Formación de polvo metálico es una forma catastrófica de la corrosión que se produce cuando los materiales susceptibles están expuestos a ambientes con actividades de carbono altas, tales como otros entornos de alto gas de síntesis y CO. La corrosión se manifiesta como una ruptura de metal de mayor a polvo metálico. El mecanismo de sospecha es en primer lugar la deposición de una capa de grafito en la superficie del metal, por lo general a partir de monóxido de carbono (CO) en la fase de vapor. Esta capa de grafito se piensa entonces para formar M 3 especies metaestables C (donde M es el metal), que migran fuera de la superficie de metal. Sin embargo, en algunos regímenes no se observa M 3 especies de C que indica una transferencia directa de átomos de metal en la capa de grafito.
Protección de la corrosión
Los tratamientos de superficie
Recubrimientos aplicados

Forrado, pintura, y la aplicación de esmalte son los más comunes tratamientos anti-corrosión. Ellos funcionan proporcionando una barrera de material resistente a la corrosión entre el medio ambiente dañino y el material estructural. Aparte de los problemas cosméticos y de fabricación, hay ventajas y desventajas en cuanto a flexibilidad mecánica frente a la resistencia a la abrasión y alta temperatura. Galjanoplastias suelen fallar sólo en pequeñas secciones, y si el forro es más noble que el sustrato (por ejemplo, el cromo en el acero), un par galvánico causarán zonas expuestas a corroe mucho más rápidamente que una superficie sin chapar haría. Por esta razón, a menudo es aconsejable a la placa con metal activo como el zinc o cadmio. Pintura ya sea con rodillo o brocha es más deseable para espacios reducidos; rocíe sería mejor para las zonas de recubrimiento más grandes tales como cubiertas de acero y aplicaciones de la línea de costa. Revestimientos de poliuretano flexibles, como Durabak-M26 por ejemplo, pueden proporcionar un sellado anticorrosivo con una membrana altamente durable antideslizante. Revestimientos pintadas son relativamente fáciles de aplicar y tienen tiempos de secado rápido aunque la temperatura y la humedad pueden provocar tiempos de secado para variar.
Recubrimientos reactivos
Si el entorno es controlado (especialmente en sistemas de recirculación), inhibidores de la corrosión a menudo se pueden añadir a la misma. Estos forman un recubrimiento eléctricamente aislante o químicamente impermeable sobre superficies metálicas expuestas, para suprimir las reacciones electroquímicas. Tales métodos, obviamente, hacen que el sistema sea menos sensible a los arañazos o defectos en el revestimiento, ya que los inhibidores adicionales pueden estar disponibles siempre que sea de metal queda expuesto. Los productos químicos que inhiben la corrosión incluyen algunas de las sales en agua dura (sistemas de agua romana son famosos por sus yacimientos minerales ), cromatos, fosfatos, polianilina, otra polímeros conductores y una amplia gama de productos químicos especialmente diseñados que se asemejan tensioactivos (es decir, de cadena larga moléculas orgánicas con grupos terminales iónicos).
Anodización

Las aleaciones de aluminio a menudo se someten a un tratamiento de superficie. Condiciones electroquímicas en el baño se ajustan cuidadosamente para que poros uniformes varios nanómetros de ancho aparecer en la película de óxido de metal. Estos poros permiten que el óxido de crecer mucho más gruesa que las condiciones de pasivación permitirían. Al final del tratamiento, los poros están permitidos para sellar, formando una capa de la superficie más difícil de lo normal. Si se raya este recubrimiento, procesos normales de pasivación se hacen cargo de proteger la zona dañada.
El anodizado es muy resistente a la intemperie ya la corrosión, por lo que se utiliza comúnmente para la construcción de fachadas y otras áreas que la superficie esté en contacto regular con los elementos. Siendo a la vez resistente, se debe limpiar con frecuencia. Si se deja sin limpiar, ocurrirá naturalmente tinción borde del panel.
Revestimientos Biofilm
Una nueva forma de protección ha sido desarrollado por la aplicación de ciertas especies de películas bacterianas a la superficie de los metales en ambientes altamente corrosivos. Este proceso aumenta la resistencia a la corrosión sustancialmente. Alternativamente, la producción de los antimicrobianos biofilms pueden utilizarse para inhibir la corrosión de acero dulce sulfato de bacterias reductoras.
Encofrado permeabilidad controlada
Controlada encofrado permeabilidad (CPF) es un método de prevención de la corrosión de refuerzo mediante la mejora de la durabilidad natural de la cubrir durante la colocación del hormigón. CPF se ha utilizado en entornos para combatir los efectos de carbonatación, cloruros, las heladas y la abrasión.
Protección catódica
La protección catódica (CP) es una técnica para controlar la corrosión de una superficie de metal, haciendo que la superficie del cátodo de una celda electroquímica. Sistemas de protección catódica son los más utilizados para proteger el acero, agua y combustible tuberías y tanques; muelle de acero pilas, barcos y en alta mar plataformas petroleras.
Protección del ánodo de sacrificio

Para CP eficaz, el potencial de la superficie de acero está polarizada (empujado) más negativo hasta que la superficie de metal tiene un potencial uniforme. Con un potencial uniforme, se detiene la fuerza motriz para la reacción de corrosión. Para los sistemas de CP galvánicas, el material del ánodo se corroe bajo la influencia del acero, y, finalmente, debe ser reemplazado. La la polarización es causado por el flujo de corriente desde el ánodo al cátodo, impulsado por la diferencia de potencial electroquímico entre el ánodo y el cátodo.
Protección catódica por corriente impresa
Para las estructuras más grandes, ánodos galvánicos no pueden entregar económicamente suficiente corriente para proporcionar una protección completa. Protección catódica por corriente impresa sistemas (ICCP) utilizan ánodos conectados a un Fuente de alimentación DC (tal como una rectificador de protección catódica). Ánodos para sistemas ICCP son formas de varillas tubulares y sólidos de diversos materiales especializados. Estos incluyen alta silicio hierro fundido, grafito, óxido de metal mixto o titanio recubierto de platino o varilla y los cables de niobio recubierta.
Protección anódica
Protección anódica impresiona corriente anódica en la estructura a proteger (opuesta a la protección catódica). Es apropiado para los metales que presentan pasividad (por ejemplo, acero inoxidable) y adecuadamente pequeño de corriente pasiva en un amplio intervalo de potenciales. Se utiliza en ambientes agresivos, por ejemplo, soluciones de ácido sulfúrico.
Tasa de corrosión
Una prueba simple para medir la corrosión es el método de pérdida de peso. El método consiste en exponer una pieza pesada limpia del metal o aleación con el medio ambiente corrosivo durante un tiempo especificado, seguido de la limpieza para eliminar los productos de corrosión y un peso de la pieza para determinar la pérdida de peso. La velocidad de corrosión (R) se calcula como
- R = KW / (ρAt)
donde k es una constante, W es la pérdida de peso del metal en el tiempo t, A es el área de superficie del metal expuesto, y ρ es la densidad del metal (en g / cm³).
Impacto económico

En 2002, los EE.UU. Administración Federal de Carreteras publicó un estudio titulado Costos corrosión y estrategias preventivas en los Estados Unidos sobre los costos directos asociados a la corrosión metálica en la industria estadounidense. En 1998, el costo directo total anual de la corrosión en los EE.UU. fue ca. $ 276 mil millones (aproximadamente el 3,2% de los EE.UU. producto interno bruto ).
El óxido es una de las causas más comunes de accidentes puente. Como óxido tiene un volumen mucho mayor que la masa originario de hierro, su acumulación también puede causar insuficiencia forzando aparte partes adyacentes. Fue la causa del colapso de la Mianus puente del río en 1983, cuando los rodamientos oxidados internamente y empujaron a una de las esquinas de la losa de carreteras de su soporte. Tres conductores en la carretera en el momento murieron como la losa cayó al río abajo. La siguiente Investigación de la NTSB mostró que un drenaje en la carretera había sido bloqueado por carretera vuelve a allanar, y no había sido desbloqueado; Como resultado, el agua de escorrentía penetró las perchas de apoyo. Rust fue también un factor importante en el Desastre puente de plata de 1967 en Virginia Occidental , cuando un acero puente colgante se derrumbó en un minuto, matando a 46 conductores y pasajeros en el puente en el momento.
Del mismo modo, la corrosión del acero y hierro hormigón cubierto puede causar que el hormigón Spall, creando graves problemas estructurales. Es uno de los modos de fallo más comunes de hormigón armado puentes . Instrumentos de medición basado en el potencial de media celda puede detectar los posibles puntos de corrosión antes de que se alcance el fracaso total de la estructura de hormigón.
Hasta hace 20-30 años; tubo de acero galvanizado se utiliza ampliamente en los sistemas de agua potable para los residentes de una o varias familias, así como la construcción comercial y pública. Hoy en día, estos sistemas han consumido mucho tiempo el zinc protectora y se corroe internamente consecuentes fallas mala calidad del agua y de la tubería. El impacto económico de los propietarios de viviendas, habitantes de condominios, y la infraestructura pública se estima en 22 mil millones de dólares como corsés de la industria de seguros para una ola de reclamos por fallas de tubería.
La corrosión en los elementos no metálicos
Más materiales cerámicos son casi totalmente inmune a la corrosión. Las fuertes enlaces químicos que los mantienen unidos dejan muy poca energía libre de químicos en la estructura; que pueden ser considerados como ya se ha corroído. Cuando la corrosión ocurre, es casi siempre una sencilla disolución de la reacción de los materiales o productos químicos, en lugar de un proceso electroquímico. Un ejemplo común de protección contra la corrosión en la cerámica es la cal añadida a la sosa-cal de vidrio para reducir su solubilidad en agua; aunque no es tan soluble como pura silicato de sodio, vidrio normal hace formar defectos sub-microscópicos cuando se expone a la humedad. Debido a su fragilidad, tales defectos causan una dramática reducción en la fuerza de un objeto de vidrio durante sus primeras horas a temperatura ambiente.
La corrosión de los polímeros
La degradación del polímero implica varios complejos y procesos físico-químicos a menudo se entiende mal. Estos son notablemente diferentes de los otros procesos descritos aquí, por lo que el término "corrosión" sólo se aplica a ellos en un sentido amplio de la palabra. Debido a su gran peso molecular, muy poco entropía se puede obtener mediante la mezcla de una masa dada de polímero con otra sustancia, por lo que generalmente bastante difícil de disolver. Mientras que la disolución es un problema en algunas aplicaciones de los polímeros, es relativamente sencillo diseñar en contra. Un problema más común y relacionada es la hinchazón, donde las pequeñas moléculas se infiltran en la estructura, lo que reduce la resistencia y rigidez y causando un cambio de volumen. Por el contrario, muchos polímeros (especialmente flexibles de vinilo) se hinchó intencionalmente con plastificantes, que pueden ser lixiviados de la estructura, causando fragilidad u otros cambios indeseables. La forma más común de la degradación, sin embargo, es una disminución de la longitud de la cadena de polímero. Mecanismos que rompen las cadenas de polímero son familiares para los biólogos debido a su efecto sobre el ADN : radiación ionizante (más comúnmente ultravioleta luz), los radicales libres, y oxidantes tales como oxígeno, ozono , y cloro . Craqueo ozono es un problema bien conocido que afecta de caucho natural , por ejemplo. Aditivos pueden retrasar estos procesos de manera muy eficaz, y puede ser tan simple como un absorbente de UV de pigmento (es decir, dióxido de titanio o negro de carbono). Las bolsas de plástico a menudo no incluyen estos aditivos para que se descomponen más fácilmente como basura .
La corrosión de los vidrios

Enfermedad de cristal es la corrosión de los vidrios de silicato en soluciones acuosas. Se rige por dos mecanismos: controlada por difusión de lixiviación (intercambio iónico) y la disolución hidrolítica de la red de vidrio. Ambos mecanismos dependen en gran medida del pH de la solución en contacto con: la tasa de intercambio iónico disminuye con pH como 10 -0.5pH mientras que la tasa de aumento de disolución hidrolíticas con pH como 10 0.5pH.
Matemáticamente, las tasas de corrosión de gafas se caracterizan por tasas de corrosión de los elementos normalizados NR i (g / cm 2 · d) que se determina como la relación de la cantidad total de especies liberadas en el agua M i (g) a la superficie de contacto con el agua área S (cm 2), tiempo de contacto t (días) y la fracción en peso de contenido del elemento en el vidrio f i:
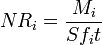 .
.
La tasa global de la corrosión es una suma de las contribuciones de ambos mecanismos (lixiviación + disolución) NR i = i + NRx nrh. Controlada por difusión de lixiviación (intercambio iónico) es característico de la fase inicial de la corrosión e implica la sustitución de los iones alcalinos del vidrio por un hidronio (3 O + H) de iones de la solución. Causa una disminución selectiva de iones de capas cercanas a la superficie de las gafas y da una dependencia inversa del cuadrado de la raíz de la velocidad de corrosión con el tiempo de exposición. La tasa de lixiviación normalizado controlada por difusión de cationes de vasos (g / cm 2 · d) viene dada por:
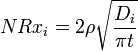 ,
,
donde t es el tiempo, D i es el catión i-ésimo coeficiente efectivo de difusión (cm 2 / d), que depende del pH del agua en contacto como D i = D i0 · 10 Ph, y ρ es la densidad del vidrio ( g / cm 3).
La disolución de la red de cristal es característico de las fases posteriores de la corrosión y provoca una liberación congruente de iones en la solución de agua a una velocidad independiente del tiempo en soluciones diluidas (g / cm 2 · d):
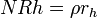 ,
,
donde r es la h estacionaria hidrólisis (disolución) tasa del vidrio (cm / d). En sistemas cerrados el consumo de protones de la fase acuosa aumenta el pH y causa una rápida transición a la hidrólisis. Sin embargo, una saturación adicional de solución con sílice impide la hidrólisis y hace que el vidrio para volver a una de intercambio iónico, por ejemplo, régimen de difusión controlada de la corrosión.
En condiciones naturales típicos tasas de corrosión normalizados de vidrios de silicato son muy bajos y son del orden de 10 -10 -7 -5 g / (cm 2 · d). La muy alta durabilidad de vidrios de silicato en el agua hace que sean adecuadas para la inmovilización de residuos peligrosos y nucleares.
Ensayos de corrosión de vidrio

Existen numerosos procedimientos estandarizados para medir la corrosión (también llamado durabilidad química) de gafas en ambientes neutros, básicos y ácidos, en condiciones ambientales simuladas, en fluido corporal simulado, a alta temperatura y presión, y en otras condiciones.
El procedimiento estándar ISO 719 describe una prueba de la extracción de compuestos básicos solubles en agua bajo condiciones neutras: 2 g de vidrio, tamaño de partícula de 300-500 micras, se mantiene durante 60 min en 50 ml de agua desionizada de grado 2 a 98 ° C; 25 ml de la solución obtenida se valora contra 0,01 mol / l HCl solución. El volumen de HCl requerido para la neutralización se clasifica de acuerdo a la siguiente tabla.
| Cantidad de HCl 0,01 M necesario para neutralizar óxidos básicos extraídos, ml | Extraído Na 2 O equivalente, g | Hidrolítica clase |
|---|---|---|
| <0,1 | <31 | 1 |
| 0,1-0,2 | 31-62 | 2 |
| ,2-0,85 | 62-264 | 3 |
| 0,85-2,0 | 264-620 | 4 |
| 2,0-3,5 | 620-1085 | 5 |
| > 3.5 | > 1085 | > 5 |

