
Ácido fosfórico
Sabías ...
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Ácido fosfórico | |
|---|---|
 | |
 | |
Otros nombres Ácido ortofosfórico | |
| Identificadores | |
| CAS | 7664-38-2 |
| Propiedades | |
| Fórmula molecular | H 3 PO 4 |
| Masa molar | 98,0 g / mol |
| Apariencia | sólido de color blanco o incoloro, líquido viscoso (> 42 ° C) |
| Densidad | 1,685 g / ml (líquidos) |
| Punto de fusion | 42.35 ° C, 316 K, 108 ° F |
| Punto de ebullicion | 158 ° C, 431 K, 316 ° F (descomp.) |
| Acidez (p K a) | 2.12, 7.21, 12.67 |
| Viscosidad | 85% de solución acuosa ? cP |
| Peligros | |
| Clasificación de la UE | Corrosivo (C) |
| Frases R | R34 |
| Frases S | (S1 / 2), S26, S45 |
| Compuestos relacionados | |
| Otros aniones | Ácido nítrico Ácido arsénico |
| Otros cationes | Fosfato de amonio El fosfato trisódico |
| Ácido de fósforo relacionados | Ácido hipofosforoso Ácido fosforoso Ácido pirofosfórico Ácido tripolifosfórico Ácido hipofosfórico Ácido Perphosphoric Ácido Permonophosphoric |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El ácido fosfórico, también conocido como ácido ortofosfórico o ácido fosfórico (V), es una mineral ácido (inorgánico) que tiene la fórmula química H 3 P O 4. Por el contrario, ortofosfórico ácido moléculas pueden combinar con ellos mismos para formar una variedad de compuestos que se refiere a los ácidos fosfóricos como de una manera más general. El ácido fosfórico término también puede referirse a un químico o reactivo que consiste en ácidos fosfóricos, generalmente ácido ortofosfórico en su mayoría.
La química del ácido ortofosfórico
Ácido fosfórico anhidro puro es un sólido blanco que se funde a 42,35 ° C para formar un líquido viscoso incoloro.
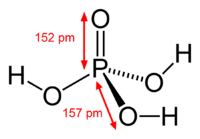
La mayoría de las personas e incluso los químicos se refieren a ortofosfórico ácido como ácido fosfórico, que es el nombre de la IUPAC para este compuesto. El orto prefijo se utiliza para distinguir el ácido de otros ácidos fosfóricos, llamados ácidos polifosfóricos. Ácido ortofosfórico es un no- tóxico, inorgánico más bien débil, triprótico ácido , que, cuando es puro, es un sólido en la sala de temperatura y presión. La estructura química de ácido ortofosfórico se muestra más arriba en la tabla de datos. Ácido ortofosfórico es una muy polar molécula ; por lo tanto es altamente soluble en agua. El estado de oxidación de fósforo (P) en ácidos fosfóricos orto- y otros es 5; el estado de oxidación de todos los oxígeno átomos (O) es -2 y todos los de hidrógeno átomos (H) es 1. Triprótico significa que una molécula de ácido ortofosfórico puede disociarse hasta tres veces, renunciar a un H + cada vez, que típicamente se combina con una molécula de agua , H 2 O, como se muestra en estas reacciones :
- H 3 PO 4 (s) + H 2 O (l) ⇌ H 3 O + (ac) + H 2 PO 4 - (aq) K a1 = 7,5 × 10 -3
- H 2 PO 4 - (aq) + H 2 O (l) ⇌ H 3 O + (aq) + HPO 4 2- (aq) K a2 = 6,2 × 10 -8
- HPO 4 2- (aq) + H 2 O (l) ⇌ H 3 O + (aq) + PO 4 3- (aq) K a3 = 2,14 × 10 -13
El anión después de la primera disociación, H 2 PO 4 -, es el anión fosfato de dihidrógeno. El anión después de la segunda disociación, HPO 4 2-, es el anión fosfato de hidrógeno. El anión después de la tercera disociación, PO 4 3-, es el fosfato o anión ortofosfato. Para cada una de las reacciones de disociación que se muestran arriba, hay una separada constante de disociación ácida, llamado K a1, a2 K y K A3 dan a 25 ° C. Asociado a estos tres constantes de disociación se p K a1 = 2.12, p K a2 = 7,21 y p K a3 = 12.67 valores a 25 ° C correspondiente. A pesar de que los tres de hidrógeno (H) átomos son equivalentes en una molécula de ácido ortofosfórico, los sucesivos K unos valores difieren, ya que es energéticamente menos favorable a perder otro H + si uno (o más) ya se ha perdido y la molécula / ion es más cargado negativamente.
Debido a que la disociación triprótico de ácido ortofosfórico, el hecho de que su bases conjugadas de los fosfatos (mencionados anteriormente) cubren una amplia intervalo de pH, y, ya que el ácido fosfórico / fosfato soluciones son, en general, no tóxico, mezclas de estos tipos de fosfatos se utilizan a menudo como agentes tampón o para hacer soluciones tampón, donde el pH deseado depende de las proporciones de los fosfatos en las mezclas. Del mismo modo, la no tóxico, anión sales de triprótico orgánica ácido cítrico también se utilizan a menudo para hacer tampones. Los fosfatos se encuentran penetrante en la biología, especialmente en los compuestos derivados de fosforilados azúcares , tales como ADN , ARN, y adenosina trifosfato (ATP). Hay un artículo separado sobre fosfato, un anión o sus sales.
Al calentar el ácido ortofosfórico, la condensación de las unidades fosfórico puede ser inducida por conducir fuera el agua formada por la condensación. Cuando una molécula de agua se ha eliminado por cada dos moléculas de ácido fosfórico, el resultado es ácido pirofosfórico (H 4 P 2 O 7). Cuando un promedio de una molécula de agua por unidad fosfórico ha sido impulsado fuera, la sustancia resultante es un sólido que tiene una fórmula empírica vítreo de HPO 3 y se llama ácido metafosfórico. Ácido metafosfórico es una versión en solitario anhidra de ácido orthophosphoic y se utiliza a veces como agua o reactivo absorbente de humedad. Adicional deshidratante es muy difícil, y sólo se puede lograr por medio de un extremadamente fuerte desecante (y no solo por calentamiento). Produce anhídrido fosfórico, que tiene una fórmula empírica P 2 O 5, aunque una molécula real tiene una fórmula química de P 4 O 10. Anhídrido fosfórico es un sólido, que es muy fuertemente la humedad aborbing y se utiliza como una desecante.
p H y composición de una solución de ácido fosfórico
Para una concentración de ácido total dada [A] = [H 3 PO 4] + [H 2 PO 4 -] + [HPO 4 2-] + [PO 4 3-] ([A] es el número total de moles de pura H 3 PO 4 que se han utilizado para preparar 1 litro de solución), la composición de una solución acuosa de ácido fosfórico se puede calcular utilizando las ecuaciones de equilibrio asociados con las tres reacciones descritas anteriormente junto con la [H +] [OH -] = 10 -14 relación y la ecuación de la neutralidad eléctrica. El sistema se puede reducir a una quinta ecuación grado de [H +], que se puede resolver numéricamente, obteniéndose:
| [A] (mol / L) | p H | [H 3 PO 4] / [A] (%) | [H 2 PO 4 -] / [A] (%) | [HPO 4 2-] / [A] (%) | [PO 4 3-] / [A] (%) |
| 1 | 1.08 | 91.7 | 8.29 | 6,20 × 10 -6 | 1,60 × 10 -17 |
| 10 -1 | 1.62 | 76.1 | 23.9 | 6,20 × 10 -5 | 5,55 × 10 -16 |
| 10 -2 | 2.25 | 43.1 | 56.9 | 6,20 × 10 -4 | 2.33 × 10 -14 |
| 10 -3 | 3.05 | 10.6 | 89.3 | 6,20 × 10 -3 | 1,48 × 10 -12 |
| 10 -4 | 4.01 | 1.30 | 98.6 | 6,19 × 10 -2 | 1,34 × 10 -10 |
| 10 -5 | 5.00 | 0,133 | 99.3 | 0,612 | 1,30 × 10 -8 |
| 10 -6 | 5.97 | 1,34 × 10 -2 | 94.5 | 5.50 | 1.11 × 10 -6 |
| 10 -7 | 6.74 | 1,80 × 10 -3 | 74.5 | 25.5 | 3,02 × 10 -5 |
| 10 -10 | 7.00 | 8,24 × 10 -4 | 61.7 | 38.3 | 8,18 × 10 -5 |
Para grandes concentraciones de ácido, la solución se compone principalmente de H 3 PO 4. Para [A] = 10 -2, el p H está cerrado a p K a1, dando una mezcla equimolar de H 3 PO 4 y H 2 PO 4 -. Para [A] por debajo de 10 -3, la solución se compone principalmente de H 2 PO 4 - con [HPO 4 2-] convertirse en no despreciable para soluciones muy diluidas. [PO 4 3-] es siempre despreciable.
Ácido fosfórico como un reactivo químico
Pure 75-85% acuosas soluciones (los más comunes) son claras, incoloro, inodoro, no ,, volátiles y no viscosos almibarados líquidos , pero todavía se puede verter. El ácido fosfórico se utiliza muy comúnmente como un solución acuosa de 85% de ácido fosfórico o H 3 PO 4. Debido a que es un ácido concentrado, una solución al 85% puede ser corrosivo, aunque no tóxico cuando se diluye. Debido al alto porcentaje de ácido fosfórico en este reactivo, al menos una parte del ácido ortofosfórico se condensa en ácidos polifosfóricos en un dependiente de la temperatura de equilibrio , pero, por el bien de etiquetado y simplicidad, el 85% representa H 3 PO 4 como si fuera todo el ácido ortofosfórico. Otros porcentajes son posibles también, incluso por encima del 100%, donde los ácidos fosfóricos y agua estarían en un equilibrio no especificada, pero el elemental general contenido mol sería considerado especificado. Cuando las soluciones acuosas de ácido fosfórico y / o fosfato son diluida, están en o se llegará a un equilibrio después de un tiempo donde las unidades de fosfato de prácticamente todo el fosfóricos / están en la forma orto.
Preparación de haluros de hidrógeno
El ácido fosfórico reacciona con halogenuros para formar el gas haluro de hidrógeno correspondiente (emanaciones vaporosas se observan en el calentamiento de la mezcla de reacción). Esta es una práctica común para la preparación de laboratorio de haluros de hidrógeno.
- 3 NaCl (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HCl (g)
- 3NaBr (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HBr (g)
- 3NaI (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HI (g)
Eliminación de la corrosión
El ácido fosfórico puede ser utilizado por aplicación directa a hierro oxidado, herramientas de acero, o superficies para convertir de hierro (III) óxido ( óxido) a una soluble en agua- compuesto de fosfato. Es generalmente disponible como un líquido verdoso, adecuado para la inmersión (baño de ácido), pero se utiliza más generalmente como un componente en un gel, comúnmente llamado jalea naval. Como un gel espeso, que se puede aplicar a superficies inclinadas, verticales, o incluso superiores. Se debe tener cuidado para evitar quemaduras de ácido de la piel y especialmente los ojos, pero el residuo se diluye fácilmente con agua. Cuando se diluye suficientemente, incluso puede ser nutritiva para la vida vegetal, que contiene el fósforo nutrientes esenciales y hierro. A veces se vende bajo otros nombres, tales como "removedor de óxido" o "asesino de la roya." No debe introducirse directamente en agua superficial, como arroyos o en los desagües, sin embargo. Después del tratamiento, el óxido de hierro de color marrón rojizo se convertirá en un negro revestimiento compuesto de fosfato de hierro que pueden ser fregado apagado. Múltiples aplicaciones de ácido fosfórico pueden ser necesarios para eliminar todo el óxido. El compuesto negro resultante puede proporcionar mayor resistencia a la corrosión (esa protección es algo proporcionado por el superficialmente similar Parkerizing y procesos de recubrimiento de conversión electroquímica azulados.) Después de la aplicación y la eliminación de moho usando compuestos de ácido fosfórico, el metal debe ser lubricada (si para ser utilizado desnudo, como en una herramienta) o debidamente pintado, mediante el uso de un proceso de múltiples manos de imprimación, intermedio, y terminar abrigos.
Uso Los alimentos procesados
Ácido fosfórico de grado alimenticio se utiliza para acidificar alimentos y bebidas tales como diversos colas, pero no sin controversia con respecto a sus efectos sobre la salud. Se proporciona un sabor fuerte y picante, y, al ser un producto químico producido en masa, está disponible de forma barata y en grandes cantidades. El bajo costo y la disponibilidad mayor es a diferencia de condimentos naturales más costosos que dan sabores comparables, como jengibre para tangyness, o ácido cítrico para la acidez, que puede obtenerse a partir de los limones y limas. (Ácido cítrico Sin embargo la mayoría de la industria alimentaria no se extrae de cítricos, pero fermentada por Moho Aspergillus niger a partir de chatarra melaza, residuos almidón hidrolizados y ácido fosfórico.) Se etiquetado como E número E338.
Efectos biológicos de calcio de los huesos y la salud de los riñones
El ácido fosfórico, que se utiliza en muchas bebidas no alcohólicas (principalmente cola), se ha relacionado con una menor densidad ósea en estudios epidemiológicos. Por ejemplo, un estudio utilizando absorciometría dual de rayos X en lugar de un cuestionario acerca de la rotura, proporciona evidencia razonable para apoyar la teoría de que el consumo de los resultados de cola en una menor densidad ósea. Este estudio fue publicado en la revista American Journal of Clinical Nutrition. Se estudiaron un total de 1.672 mujeres y 1.148 hombres entre 1996 y 2001. Dieta información se recogió mediante un cuestionario de frecuencia de alimentos que tenía preguntas específicas sobre el número de porciones de cola y otras bebidas carbonatadas y que también hizo una diferenciación entre regular, cafeína bebidas gratis, y la dieta. El documento cita evidencia estadística significativa para demostrar que las mujeres que consumen refrescos de cola al día tienen menor densidad ósea. La ingesta total de fósforo no fue significativamente mayor en los consumidores de cola al día que en los no consumidores; Sin embargo, las proporciones de calcio: fósforo fue menor. El estudio también sugiere que se necesita más investigación para confirmar los resultados.
Por otro lado, un estudio financiado por Pepsi sugiere que la baja ingesta de fósforo conduce a la disminución de la densidad ósea. El estudio no examina el efecto del ácido fosfórico, que se une con el magnesio y el calcio en el tracto digestivo para formar sales que no se absorben, sino, más bien, se estudia la ingesta de fósforo en general.
Sin embargo, un estudio clínico bien controlado por Heaney y Rafferty utilizando métodos de calcio de balance no encontró efectos de bebidas gaseosas que contienen ácido phoshporic en la excreción de calcio. El estudio comparó el impacto del agua, la leche, y varios refrescos (dos con cafeína y sin dos; dos con ácido fosfórico y dos con ácido cítrico) en el equilibrio del calcio de las mujeres de 20 a 40 años de edad que habitualmente consume ~ 3 o más tazas (680 ml) de una bebida gaseosa por día. Encontraron que, en relación con el agua, sólo la leche y los dos refrescos con cafeína incrementa el calcio urinario, y que la pérdida de calcio asociado con el consumo de refrescos con cafeína era aproximadamente igual a la encontrada previamente para la cafeína sola. El ácido fosfórico sin cafeína no tuvo impacto en el calcio en orina, ni tampoco aumentar la pérdida urinaria de calcio relacionada con la cafeína. Dado que los estudios han demostrado que el efecto de la cafeína es compensada por la reducción de las pérdidas de calcio más tarde en el día, Heaney y Rafferty concluyeron que el efecto neto de las bebidas carbonatadas - incluyendo aquellos con cafeína y ácido fosfórico - es insignificante, y que los efectos esqueléticos de carbonatada consumo de refrescos son probablemente debido principalmente a la leche desplazamiento.
Otros productos químicos como la cafeína (también un componente importante de las bebidas de cola común populares) también eran sospechosos como posibles contribuyentes a la baja densidad ósea, debido al conocido efecto de la cafeína en la calciuria. Otro estudio, compuesto por 30 mujeres en el transcurso de una semana, sugiere que el ácido fosfórico en las bebidas de cola no tiene tal efecto, y postula que la cafeína tiene sólo un efecto temporal, que más tarde se invierte. Los autores de este estudio concluyen que los efectos esqueléticos de consumo de bebidas carbonatadas son probablemente debido principalmente al desplazamiento de leche. (Otra posible factor de confusión puede ser una asociación entre el alto consumo de refrescos y el sedentarismo.)
Consumo Cola también se ha relacionado con la enfermedad renal y cálculos renales crónicas a través de la investigación médica. Este estudio diferenciado entre los efectos de cola (por lo general contiene ácido fosfórico), sin cola bebidas carbonatadas (ácido cítrico sustituto) y el café (control de la cafeína), y encontró que beber 2 o más bebidas de cola por día más que se duplicó la incidencia de riñón enfermedad.
El uso médico
El ácido fosfórico se utiliza en odontología y ortodoncia como una aguafuerte solución, para limpiar y raspar las superficies de los dientes donde se colocarán aparatos o empastes dentales. El ácido fosfórico es también un ingrediente en over-the-counter medicamentos contra las náuseas que también contienen altos niveles de azúcar ( glucosa y fructosa). No debe ser utilizado por diabéticos sin consultar a un médico. Este ácido se utiliza también en blanqueadores de dientes para eliminar cualquier placa que puede ser en sus dientes.
Preparación de ácido fosfórico
El ácido fosfórico se puede preparar por dos vías - el proceso térmico y el proceso húmedo.
Ácido fosfórico térmica: Este ácido fosfórico muy puro se obtiene por la combustión elemental de fósforo para producir pentóxido de fósforo y disolviendo el producto en ácido fosfórico diluido. Esto produce un ácido fosfórico muy puro, ya que la mayoría de las impurezas presentes en la roca se han eliminado al extraer el fósforo de la roca en un horno. El resultado final es de calidad alimentaria, ácido fosfórico térmico; Sin embargo, para aplicaciones críticas, puede ser necesario un procesamiento adicional para eliminar compuestos de arsénico.
Wet ácido fosfórico: ácido fosfórico del procedimiento en húmedo se preparó mediante la adición de ácido sulfúrico a roca de fosfato de calcio.
La reacción simplificada es:
- 3 H 2 SO 4 + Ca 3 (PO 4) 2 + 6 H2O ↔ 2 H 3 PO 4 + 3 CaSO 4 2H 2 O
Ácido proceso en húmedo puede purificarse mediante la eliminación de flúor para producir ácido fosfórico de grado animal, o por extracción con disolvente y eliminación de arsénico para producir ácido fosfórico de grado alimenticio.
Otras aplicaciones
El ácido fosfórico se utiliza como el electrolito en celdas de combustible de ácido fosfórico. También se utiliza como un estándar externo para el fósforo -31 resonancia magnética nuclear (NMR).
El ácido fosfórico se utiliza como un limpiador por industria de la construcción para eliminar los depósitos minerales, manchas de cemento, y las manchas de agua dura. También se usa como un ingrediente en algunos limpiadores destinados a tareas de limpieza similares.
Ácido fosfórico caliente se utiliza en microfabricación para etch nitruro de silicio (Si 3 N 4). Es altamente selectivo en el grabado de Si 3 N 4 en lugar de SiO 2, dióxido de silicio .
El ácido fosfórico se utiliza como una flujo por aficionados (como de miniaturas) como una ayuda para soldadura.
El ácido fosfórico también se utiliza en soluciones de pH hidroponía para bajar el pH de las soluciones de nutrientes. Aunque se pueden usar otros tipos de ácidos, el fósforo es un nutriente utilizado por las plantas, especialmente durante la floración, haciendo ácido fosfórico particularmente deseable. Solución líquida General Hydroponics pH Down contiene ácido fosfórico además de ácido cítrico y bisulfato de amonio con tampones para mantener un pH estable en el depósito de nutrientes.
El ácido fosfórico se utiliza como un ajustador de pH en cosméticos y productos de cuidado de la piel.
El ácido fosfórico se utiliza como un agente oxidante químico para la producción de carbón activado.

