
El cloruro de aluminio
Antecedentes de las escuelas de Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Ver http://www.soschildren.org/sponsor-a-child para averiguar sobre el apadrinamiento de niños.
| El cloruro de aluminio | |
|---|---|
 | |
 | |
Aluminio cloruro (III) | |
Otros nombres Tricloruro de aluminio | |
| Identificadores | |
| Propiedades | |
| Fórmula molecular | AlCl3 |
| Masa molar | 133,34 g mol -1 (anhidro) 241.432 g mol -1 (hexahidratado) |
| Apariencia | Sólido de color amarillo pálido, higroscópico. |
| Densidad | 2.48 g cm -3 |
| Punto de fusion | 190 ° C 463 K ) |
| Punto de ebullicion | 178 ° C (451 K) ( subl) |
| Solubilidad en agua | 43,9 g / 100 ml (0 ° C) 44,9 g / 100 ml (10 ° C) 45,8 g / 100 ml (20 ° C) 46,6 g / 100 ml (30 ° C) 47,3 g / 100 ml (40 ° C) 48,1 g / 100 ml (60 ° C) 48,6 g / 100 ml (80 ° C) 49 g / 100 ml (100 ° C) |
| Estructura | |
| Estructura cristalina | 6 coordenada celosía capa |
| Coordinación geometría | Octaédrica (sólido) Tetraédrica (líquido) |
| Forma molecular | Trigonal plana ( vapor de monómero) |
| Peligros | |
| MSDS | MSDS externa |
| Clasificación de la UE | Corrosivo (C) |
| Frases R | R34 |
| Frases S | (S1 / 2), S7 / 8, S28, S45 |
| Compuestos relacionados | |
| Otros aniones | El fluoruro de aluminio Bromuro de aluminio Yoduro de aluminio |
| Otros cationes | Tricloruro de boro Galio cloruro (III) Indio cloruro (III) Talio cloruro (III) Cloruro de magnesio |
| Conexo Ácidos de Lewis | Cloruro de hierro (III) El trifluoruro de boro |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
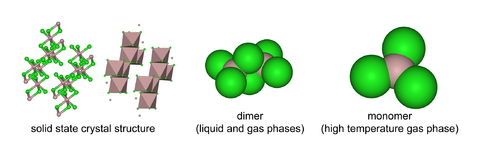
Cloruro de aluminio (AlCl3) es un compuesto de aluminio y el cloro . El sólido tiene un punto de fusión y de ebullición bajo, y es de enlace covalente. Ella sublima a 178 ° C . Molten AlCl3 conduce la electricidad mal, a diferencia de más iónico haluros tales como cloruro de sodio . Existe en el estado sólido como un enrejado de seis coordenadas capa.
AlCl3 adopta la estructura "YCl $ 3", con Al 3+ cúbico estructura en capas empaquetada. Por el contrario, AlBr3 tiene una estructura molecular más, con los centros de Al 3+ ocupando huecos tetraédricos adyacentes del marco de empaquetamiento compacto de Br - iones. Tras la fusión de AlCl3 da la dímero Al 2 Cl 6, que puede vaporizar. A mayores temperaturas este Al 2 Cl 6 dímero disocia en trigonal plana AlCl 3, que es estructuralmente análogo a BF3.
Cloruro de aluminio es altamente delicuescente, y puede explotar al contacto brusco con agua debido a la alta temperatura de hidratación. Acuosas soluciones de AlCl3 son iónicos y por lo tanto conducir la electricidad también. Tales soluciones se encuentran para ser ácida , indicativo de parcial hidrólisis de iones de Al 3+. Las reacciones pueden ser descritas (simplificado) como:
- [Al (H2O) 6] 3+ + H 2 O ⇌ [Al (OH) (H 2 O) 5] 2+ + H 3 O +
AlCl3 es probablemente el más utilizado Ácido de Lewis y también uno de los más poderosos. Encuentra una amplia aplicación en el industria química como el clásico catalizador para Friedel-Crafts reacciones, tanto acilaciones y alquilaciones. También encuentra uso en polimerización y reacciones de isomerización de hidrocarburos. Aluminio también forma una menor cloruro de aluminio (I) cloruro de (AlCl), pero esto es muy inestable y sólo se conoce en la fase de vapor.
Propiedades químicas
El cloruro de aluminio es un potente Lewis ácido, capaz de formar aductos estables de Lewis ácido-base con aún débil Bases de Lewis tales como benzofenona o mesitileno. No es sorprendente que forma AlCl 4 - en presencia de iones cloruro.
En el agua, las formas de hidrólisis parcial Gas HCl o H 3 O +, como se describe en el resumen anterior. Las soluciones acuosas se comportan de manera similar a otra de aluminio sales que contienen Al 3+ hidratados iones , dando una gelatinosa precipitado de hidróxido de aluminio en la reacción con la cantidad correcta de acuosa de hidróxido de sodio :
AlCl3 ( aq) + 3 NaOH (aq) → Al (OH) 3 ( s ) + 3 NaCl (aq)
Preparación
El cloruro de aluminio se fabrica a gran escala por el reacción exotérmica de metal de aluminio con cloro o cloruro de hidrógeno.
- 2 Al + 3 Cl 2 → 2 AlCl3
- 2 Al + 6 HCl → 2 AlCl3 + 3 H 2
Las formas hidratadas se preparan disolviendo los óxidos de aluminio con ácido clorhídrico.
Usos
La Reacción de Friedel-Crafts es el uso principal para el cloruro de aluminio, por ejemplo en la preparación de antraquinona (para el industria de colorantes) a partir de benceno y fosgeno. En general Reacción de Friedel-Crafts, una cloruro de acilo o haluro de alquilo reacciona con una sistema aromático como se muestra:
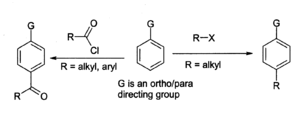
Con benceno derivados , el producto principal es la párr isómero. La reacción de alquilación tiene muchos problemas asociados, tales como en Friedel-Crafts, por lo que está menos extendida que la reacción de acilación. Para ambas reacciones, el cloruro de aluminio, así como otros materiales y el equipo, debe ser moderadamente seco, aunque un rastro de humedad es necesaria para que la reacción proceda. Un problema general con la reacción de Friedel-Crafts es que el cloruro de aluminio " catalizador "necesita estar presente en su totalidad cantidades estequiométricas en orden para que la reacción se complete, porque los complejos fuertemente con los productos (ver propiedades químicas anteriores). Esto hace que sea muy difícil de reciclar, por lo que debe ser destruido después de su uso, lo que genera una gran cantidad de residuos corrosivos. Por esta razón los químicos están examinando el uso de más catalizadores ambientalmente benignas tales como iterbio (III) triflato o disprosio (III) triflato, que puede ser reciclado .
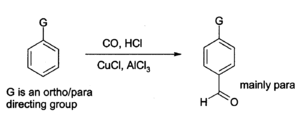
El cloruro de aluminio también se puede utilizar para introducir grupos aldehído Onto anillos aromáticos, por ejemplo a través de la Reacción de Gatterman-Koch que utiliza monóxido de carbono , cloruro de hidrógeno y una de cobre (I) cloruro de co- catalizador ):
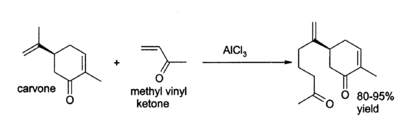
El cloruro de aluminio se encuentra una amplia variedad de otras aplicaciones en la química orgánica . Por ejemplo, puede catalizar la " reacción eno ", tales como la adición de 3-buten-2-ona (metil vinil cetona) a carvona:
AlCl 3 también se usa ampliamente para polimerización y reacciones de isomerización de hidrocarburos. Ejemplos importantes incluyen la fabricación de etilbenceno, que utiliza para hacer estireno y por lo tanto de poliestireno , y también la producción de dodecilbenceno, que se utiliza para hacer detergentes.
Cloruro de aluminio combinado con aluminio en la presencia de un areno se puede utilizar para sintetizar bis (areno) complejos de metales, por ejemplo, bis (benceno) cromo, de ciertos haluros de metal a través de la llamada Síntesis de Fischer-Hafner.
Cloruro de aluminio, a menudo en la forma de derivados tales como clorhidrato de aluminio, es un componente común en antitranspirantes en bajas concentraciones. Sufren hiperhidrosis necesitan una concentración mucho más alta (15% o más), que se vende bajo marcas como Drysol®, Maxim®, ODABAN®, CertainDri®, B + Drier® y Driclor®.
Precauciones
Anhidro AlCl3 reacciona vigorosamente con agua y bases, se requieren precauciones de modo adecuado. Sales hidratadas son menos problemáticos.

