fluorure de césium
À propos de ce écoles sélection Wikipedia
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
| fluorure de césium | |
|---|---|
 | |
 | |
fluorure de césium | |
Autres noms le fluorure de césium | |
| Identificateurs | |
| Numéro CAS | 13400-13-0 |
| ChemSpider | 24179 |
| Numéro RTECS | FK9650000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | CsF |
| Masse molaire | 151,90 g / mol |
| Apparence | solide cristallin blanc |
| Densité | 4,115 g / cm 3 |
| Point de fusion | 682 ° C (955 K) |
| Point d'ébullition | 1251 ° C (1524 K) |
| Solubilité dans l'eau | 367 g / 100 ml (18 ° C) |
| Structure | |
| Crystal structure | cubique, cf8 |
| Groupe d'espace | Fm 3 m, n ° 225 |
| Coordination géométrie | Octahedral |
| Moment de dipôle | 7,9 Ré |
| Risques | |
| FS | MSDS externe |
| Indice de l'UE | Non listé |
| Point d'éclair | Ininflammable |
| Des composés apparentés | |
| D'autres anions | chlorure de césium bromure de césium L'iodure de césium |
| D'autres cations | Le fluorure de lithium Le fluorure de sodium Le fluorure de potassium le fluorure de rubidium |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
le fluorure de césium (fluorure de césium en Amérique du Nord), est un composé inorganique habituellement rencontrées forme d'un solide blanc hygroscopique. Il est plus soluble et plus facilement dissocié de le fluorure de sodium ou le fluorure de potassium. Il est disponible sous forme anhydre, et si de l'eau a été absorbée, il est facile à sécher par chauffage à 100 ° C pendant deux heures sous vide. Comme tous les fluorures solubles, il est légèrement de base. Un fait intéressant sur ce composé est qu'il est le composé le plus ionique. Le césium a le plus faible électronégativité (autre que le francium, un élément radioactif très rare instable), et le fluor a la plus haute électronégativité.
Synthèse et propriétés
le fluorure de césium est préparée par l'action de de l'acide fluorhydrique sur l'hydroxyde de césium ou le carbonate de césium, puis par élimination de l'eau.
le fluorure de césium réagit habituellement comme une source d'ion fluorure, F -. Il subit donc toutes les réactions habituelles associées aux fluorures solubles, par exemple:
- 2 CsF + CaCl 2 → 2 + CaF 2 CsCl
Crystal structure
le fluorure de césium a la structure de sel gemme, ce qui signifie que le Cs + et F - un paquet en cube le plus proche tableau emballés comme le font Na + et Cl - dans le chlorure de sodium. des cations césium sont plus grandes que les anions fluorure, tandis que dans les halogénures de lithium, sodium, potassium, rubidium et les cations sont plus petites que l'anion.
Applications
En synthèse organique
Étant fortement dissociée ce est une source de fluorure plus réactif que les sels connexes. CsF est inférieure hygroscopique alternatif à le fluorure de tétra-n-butylammonium (TBAF) et TAS-fluorure (TASF) lorsque anhydre "nu" fluorure ionique est nécessaire.
Comme une base
Comme avec d'autres fluorures solubles, CSF est modérément basique, parce HF est un acide faible. Le faible de fluorure nucléophile signifie qu'il peut être utile dans une base de fluorure de chemistry.Caesium organique est une base utile en chimie organique , en raison du fait que le fluorure ionique est relativement faible nucléophile. CsF donne des rendements plus élevés dans Des réactions de condensation de Knoevenagel que KF ou NaF.
Formation de liaisons FC
fluorure de césium est également une source populaire de fluorure dans la chimie organofluoré. Par exemple, le LCR réagit avec hexafluoroacétone pour former un sel de césium, qui est stable jusqu'à 60 ° C, correspondant à la différence du sodium ou potassium sel. Il vous permet de convertir déficient en électrons aryle chlorures à les fluorures d'aryle ( réaction halex).
agent de déprotection
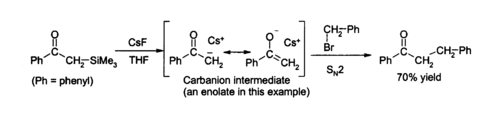
En raison de la force du Si - F liaison, l'ion fluorure est utile pour réactions de désilylation (d'enlèvement des groupes Si) en chimie organique ; le fluorure de césium est une excellente source de fluorure anhydre pour de telles réactions. L'élimination des groupes de silicium ( désilylation) est une application majeure pour la PPC en laboratoire, comme son la nature anhydre permet la formation propre de l'eau intermédiaires -sensibles. Solutions aqueuses de fluorure de césium dans THF ou DMF attaque une grande variété de des composés d'organosilicium pour produire un fluorure d'organosilicium et un carbanion, qui peut ensuite réagir avec électrophiles, par exemple:
La désilylation est également utile pour l'élimination de silyle les groupes protecteurs.
D'autres utilisations
Monocristaux de sel sont transparents dans l'abîme infrarouge. Pour cette raison, il est parfois utilisé comme les fenêtres de cellules utilisées pour spectroscopie infrarouge.
Précautions
Comme d'autres fluorures solubles, CsF est modérément toxique. Le contact avec l'acide doit être évitée, car cela formes hautement toxiques / corrosives l'acide fluorhydrique. Césium ions (Cs +), ou le chlorure de césium, ne est généralement pas considérés comme toxiques.