Solubilité
Saviez-vous ...
Cette sélection de wikipedia a été choisi par des bénévoles aidant les enfants SOS de Wikipedia pour cette sélection Wikipedia pour les écoles. Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
Solubilité est une caractéristique propriété physique se référant à la possibilité pour une substance donnée, le soluté , à se dissoudre dans un solvant . Elle est mesurée en fonction de la quantité maximale de soluté dissous dans un solvant à l'équilibre . La solution résultante est appelée saturé solution . Certains liquides sont solubles en toutes proportions avec un solvant donné, comme l'éthanol dans l'eau . Cette propriété est connue sous le nom miscibilité. En outre, le Produit de solubilité peut être dépassée dans diverses conditions pour donner un soi-disant solution sursaturée, ce qui est métastable.
Dans une solution, le solvant est souvent un liquide, qui peut être une substance pure ou un mélange. Les espèces qui se dissout (soluté) peut être un gaz, un autre liquide ou d'un solide. Solubilités varient considérablement, allant infiniment soluble tel que l'éthanol dans l'eau , à peu soluble, tel que chlorure d'argent dans l'eau. Le terme insoluble est souvent appliqué aux composés peu solubles, mais à proprement parler, il ya très peu de cas où il n'y a absolument pas de matière dissoute.
Vue moléculaire
Solubilité se produit dans un équilibre dynamique. Cela signifie que la solubilité devrait être considérée comme un résultat de deux processus simultanés et opposés: la dissolution et la précipitation. L'équilibre de solubilité se produit lorsque les deux processus se déroulent à la même vitesse.
L'équilibre de solubilité est relativement simple pour substances covalentes tels que l'éthanol. Lorsque l'éthanol se dissout dans l'eau, les molécules d'éthanol restent intacts mais forment nouvelle des liaisons hydrogène avec l'eau. Toutefois, lorsqu'une composé ionique tel que le chlorure de sodium (NaCl) se dissout dans l'eau, le chlorure de sodium treillis se dissocie en ions qui sont séparés solvatée (emballés) avec un revêtement de molécules d'eau. Néanmoins, NaCl est dit à dissoudre dans l'eau, car l'évaporation des solvants rendements cristalline NaCl.
Parfois, le terme "dissolution" est appliqué à une irréversible réaction chimique , comme avec du fer dans de l'acide nitrique , mais dans ce cas la notion de solubilité thermodynamique ne se applique pas.
Quand il se dissout, un soluté peut former plusieurs espèces dans la solution. Par exemple, l'eau au-dessus des cristaux de l'hydroxyde ferreux, Fe (OH) 2, sera, à l'équilibre, contenir Fe 2+, Fe (OH) +, Fe (OH) 2, Fe (OH) 3 - et éventuellement d'autres complexes. Par conséquent, la solubilité de l'hydroxyde ferreux dépend du pH. En général, la solubilité dans la phase de solvant peut être donnée que pour un soluté spécifique qui est thermodynamiquement stable, et la valeur de la solubilité comprend toutes les espèces de la solution (dans l'exemple ci-dessus, tous les complexes contenant du fer).
Facteurs affectant la solubilité
La solubilité est définie pour spécifiques phases . Par exemple, la solubilité de aragonite et de calcite dans l'eau devraient être différente, même si les deux sont la même substance chimique ( carbonate de calcium ).
La solubilité d'une substance dissolvant dans un autre est déterminée par l'équilibre de forces intermoléculaires entre le solvant et le soluté et l'entropie qui accompagne le changement solvatation. Des facteurs tels que la température et la pression va modifier cet équilibre, ce qui modifie la solubilité.
La solubilité peut également dépendre fortement de la présence d'autres espèces dissoutes dans le solvant, par exemple, les anions formant des complexes ( ligands) dans des liquides. Solubilité dépendra également de l'excédent (ou l'insuffisance) d'un ion commun ( effet d'ion commun) dans la solution. Dans une moindre mesure, la solubilité dépend de la la force ionique de solutions liquides. Les deux derniers effets peuvent être quantifiés en utilisant l'équation pour Produit de solubilité.
Il ya aussi un certain nombre de facteurs moins susceptibles de modifier la solubilité. Solubilité peut dépendre de la taille cristalline (ou gouttelettes) de la phase de soluté (typiquement, la solubilité augmente avec la diminution de la taille des cristaux de cristaux beaucoup plus petits que 1 pm). Pour cristaux très défectueux, la solubilité peut augmenter avec le degré croissant de troubles. Les deux derniers effets, bien que d'une grande importance pratique, ne sont pas de véritables effets de solubilité parce solubilité vraie se produit à EQuilbrium, qui nécessite un monocristal parfait. Pour les substances à dissoudre dans un réaction électrochimique, la solubilité devrait dépendre du potentiel de la phase de soluté.
Température
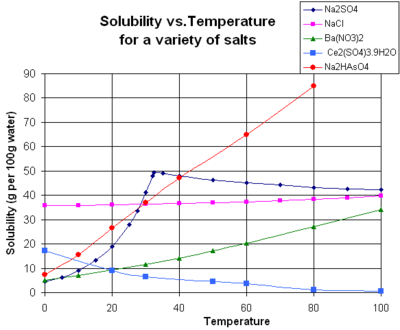
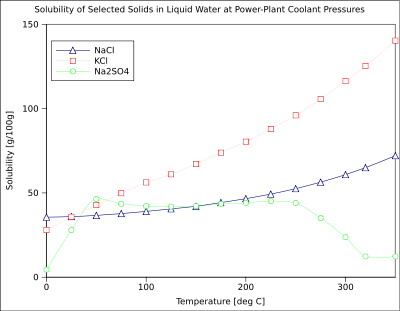
La solubilité d'un soluté donné dans un solvant donné dépend généralement de la température. Pour environ 95% des solutés solides, la solubilité augmente avec la température, dans la plage de température allant d'environ la température ambiante à 100 ° C. Dans l'eau liquide à haute température (par exemple, qui se approche le température critique), la solubilité des solutés ioniques a tendance à diminuer en raison du changement de propriétés et la structure de l'eau liquide (inférieur constante diélectrique, à moins d'un solvant polaire ).
Gazeux solutés présentent un comportement plus complexe avec la température. Comme on élève la température des gaz deviennent généralement moins soluble dans l'eau, mais plus soluble dans les solvants organiques.
Le graphique montre les courbes de solubilité pour certains inorganique typique Tous les solides (sels). Beaucoup se comportent comme des sels le nitrate de baryum et l'arséniate de sodium dibasique, et montrent une grande augmentation de la solubilité avec la température. Certains solutés (par exemple NaCl dans l'eau) solubilité dans l'exposition qui est assez indépendant de la température. Quelques-uns, tels que le cérium (III) sulfate, deviennent moins solubles dans l'eau lorsque la température augmente. Ceci est parfois appelé "retrograte" ou "inverse" solubilité. De temps en temps, un modèle plus complexe est observée, comme avec du sulfate de sodium , où le déca moins soluble hydrate cristallin perd de l'eau de cristallisation à 32 ° C pour former un plus soluble la phase anhydre.
Composé organique soluble deviennent presque toujours que la température se élève, dans la plupart des solvants. La technique de recristallisation, utilisé pour la purification de solides, dépend de cette différence de solubilité dans un solvant chaud et froid. Il ya quelques exceptions, comme certains cyclodextrines.
Pression
Pour phases condensées (solides et liquides), la dépendance de la pression de la solubilité est généralement faible et souvent négligée dans la pratique. En supposant une solution idéale, la dépendance peut être quantifiée en tant que:
où N i est la fraction molaire du constituant i dans la solution, P est la pression, l'indice T fait référence à une température constante, V i, aq est la volume molaire partiel du composant i dans la solution, V i, cr est le volume molaire partiel de la composante i dans le solide à dissoudre, et R est le constante universelle des gaz.
La loi de Henry indique que la solubilité d'un gaz dans un liquide est directement proportionnelle à la la pression partielle de ce gaz au-dessus du liquide, qui peut être écrite comme suit:
où k est une constante dépendant de la température (par exemple, 769,2 atm • L / mol pour dioxygène (O 2) dans l'eau à 298 K), p est la pression partielle (atm), et c est la concentration du gaz dissous dans le liquide (mol / L).
Polarité
Un populaire aphorisme utilisé pour prédire la solubilité est «Comme se dissout comme" Ceci indique que un soluté se dissout mieux dans un solvant qui a un similaire polarité à lui-même. Ce est une vision plutôt simpliste, car il ne tient pas compte de nombreuses interactions solvant-soluté, mais ce est une règle-de-pouce utile. Par exemple, une très polaire ( hydrophile) soluté tel que l'urée est très soluble dans l'eau hautement polaire, relativement moins solubles dans l'polaire du méthanol et pratiquement insoluble dans des solvants non polaires tels que le benzène . En revanche, une non-polaire ou soluté lipophile tel que naphtalène est insoluble dans l'eau, assez soluble dans le methanol et très soluble dans le benzène non polaire.
Solubilité liquides aussi généralement cette règle. Huiles végétales lipophiles, tels que l'huile d'olive et l'huile de palme, se dissolvent dans l'essence non polaire (essence), mais liquides polaires tels que l'eau ne se mélangent pas avec de l'essence.
Chimistes de synthèse utilisent souvent les différentes solubilités des composés pour séparer et purifier les composés de mélanges réactionnels.
Vitesse de dissolution
Dissolution ne est pas toujours un processus instantané. Il est rapide lorsque le sel et le sucre se dissolvent dans l'eau, mais beaucoup plus lent pour un comprimé de l'aspirine ou un gros cristal hydraté de sulfate de cuivre (II) . La vitesse à laquelle un solide se dissout peut dépendre de ses propriétés cristallines (cristallines vs amorphe, la taille des cristaux) et la présence de polymorphisme. Ce est important dans de nombreux systèmes pratiques, par exemple dans la conception de méthodes pour contrôlée délivrance de médicament. Critique, la vitesse de dissolution dépend de la présence de mélange et d'autres facteurs qui déterminent le degré de undersaturation dans le film de solvant liquide immédiatement adjacente au cristal de soluté solide. Dans certains cas, les équilibres de solubilité peuvent prendre un certain temps pour établir (heures, jours, mois ou de nombreuses années; en fonction de la nature du soluté et d'autres facteurs). Dans la pratique, cela signifie que la quantité de soluté dans une solution ne est pas toujours déterminé par la solubilité thermodynamique, mais peut dépendre de la cinétique de dissolution (ou la précipitation).
Le taux de dissolution et la solubilité ne doit pas être confondue - ce sont des concepts différents (cinétiques et thermodynamiques, respectivement).
Quantification de solubilité
La solubilité est communément exprimée en concentration, soit la concentration en masse (g de soluté par kg de solvant, g par 100 mL (dL) de solvant), molarité, molalité, fraction molaire ou d'autres descriptions similaires de concentration. La quantité maximale d'équilibre du soluté qui peut dissoudre par quantité de solvant est la solubilité du soluté que dans ce solvant dans les conditions spécifiées. L'avantage de la solubilité exprimant de cette manière réside dans sa simplicité, tandis que l'inconvénient est qu'il peut fortement dépendre de la présence d'autres espèces dans le solvant (par exemple, l'effet de l'ion commun).
les constantes de solubilité sont utilisés pour décrire des solutions saturées de composés ioniques de solubilité relativement faible (voir équilibre de solubilité). La constante de solubilité est un cas spécial d'un la constante d'équilibre. Il décrit l'équilibre entre les ions dissous du sel et le sel non dissous. La constante de solubilité est également «applicable» (c.-à-utile) à précipitation, l'inverse de la réaction de dissolution. Comme avec d'autres constantes d'équilibre, la température peut affecter la valeur numérique de la constante de solubilité. La constante de solubilité est plus compliquée que la solubilité. Toutefois, la valeur de cette constante est généralement indépendante de la présence d'autres espèces dans le solvant.
La loi de Henry est utilisé pour quantifier la solubilité des gaz dans des liquides en fonction du gaz de pression partielle. Ce est un cas particulier d'un équilibre de solubilité.
Le Théorie de la solution Flory-Huggins est un modèle théorique qui décrit la solubilité de polymères. Le Hansen paramètres de solubilité et la Paramètres de solubilité Hildebrand sont des méthodes empiriques pour la prédiction de la solubilité. il est également possible de prédire la solubilité d'autres constantes physiques tels que la enthalpie de fusion.
Le Coefficient de partage ( Log P) est une mesure de la solubilité différentielle d'un composé dans un solvant hydrophobe ( octanol) et un solvant hydrophile ( de l'eau ). Le logarithme de ces deux valeurs permet composés à être classées en fonction de hydrophile (ou hydrophobe).
Applications
Solubilité est d'une importance fondamentale dans un grand nombre de disciplines scientifiques et les applications pratiques, les plus évidentes étant en génie chimique, science des matériaux, la géologie et sciences de l'environnement.
La solubilité est souvent considérée comme l'un des «propriétés caractéristiques d'une substance". Cela signifie que la solubilité est couramment utilisé pour décrire la substance, pour faire la lumière sur la nature de la substance, pour aider à distinguer d'autres substances, et de guider avec une application de la substance. Par exemple, indigo est décrit comme «insoluble dans l'eau, un alcool ou un éther, mais soluble dans le chloroforme, le nitrobenzene ou l'acide sulfurique concentré."
Par exemple, la solubilité d'une substance est utile pour la séparation de mélanges. Par exemple, un mélange de sel ( chlorure de sodium ) et de la silice peut être séparé par dissolution du sel dans l'eau, séparation par filtration et la silice non dissoute. La synthèse de composés chimiques, par milligramme dans un laboratoire ou à la tonne dans l'industrie, à la fois faire usage des solubilités relatives du produit désiré, ainsi que des matières de départ ne ayant pas réagi, des sous-produits, et les produits secondaires pour obtenir la séparation.
Un autre exemple de ceci serait la synthèse du l'acide benzoïque à partir de bromure de phénylmagnésium et glace sèche . L'acide benzoïque est plus soluble dans un solvant organique tel que le le dichlorométhane ou l'éther de diéthyle, et quand secoué avec ce solvant organique dans un entonnoir de séparation, sera préférentiellement dissoudre dans la couche organique. Les autres produits de réaction, à savoir le bromure de magnésium demeure dans la phase aqueuse, qui montre clairement que la séparation sur la base de solubilité est atteint. (Sur le plan pratique, l'acide benzoïque obtenu après évaporation du solvant organique devrait idéalement être purifié par recristallisation dans l'eau chaude.)
Solubilité des composés ioniques dans l'eau
La solubilité d'un sel qui se ionise dans l'eau est déterminée par la produit de solubilité (K sp) qui est une constante à une température donnée. Chlorure d'argent est un sel relativement insoluble dans l'eau. Il ionise:
- Ag + + Cl - ↔ AgCl (s)
Le produit de solubilité de l'AgCl, 1.8E-10 est aussi le la constante d'équilibre de cette réaction qui est calculé en multipliant les concentrations des ions argent et chlorure dans une solution saturée, soit [Ag +] [Cl]. Ainsi, la concentration maximale d'une solution pure de chlorure possible d'argent est sqrt (1.8E-10) = 1,34 E-5 M. Cependant, si les ions chlorure ont été ajoutés, peut-être une solution de chlorure de sodium, l'équilibre se déplace en fonction de principe, et chlorure d'argent de Le Chatelier va précipiter de la solution.
| Soluble | Insoluble |
|---|---|
| Groupe I et NH 4 + composés | carbonates (à l'exception du groupe I , NH 4 + et composés d'uranyle) |
| nitrates | sulfites (à l'exception du groupe I et NH 4 + composés) |
| acétates (ethanoates) | phosphates (à l'exception du groupe I et NH 4 + composés) |
| les chlorures, bromures et iodures (sauf Ag + , Pb 2+ , Cu + et Hg 2+ 2 ) | des hydroxydes et oxydes (à l'exception du groupe I , NH 4 +, Ba 2+ , Sr 2+ et Tl + ) |
| sulfates (sauf Ag + , Pb 2+ , Ba 2+ , Sr 2+ et Ca 2+ ) | sulfures (à l'exception du groupe I , Groupe II et NH 4 + composés) |
Solubilité de composés organiques
Le principe énoncé ci-dessus sous la polarité , qui se dissout comme tels, est le guide d'habitude à la solubilité avec les systèmes organiques. Par exemple, gelée de pétrole se dissout dans essence; qui sont tous deux lipophile. Ce est parce que la vaseline est constituée de chaînes de carbone longues, de même que l'essence. Il ne sera pas, d'autre part, se dissout dans de l'alcool ou de l'eau, étant donné que la polarité de ces solvants est trop élevée. Sucre ne se dissout pas dans l'essence, puisque le sucre est trop polaire en comparaison avec l'essence. Un mélange d'essence et de sucre peut donc être séparé par filtration, ou extraction à l'eau.
Solubilité Solide
Ce terme est souvent utilisé dans le domaine de la métallurgie pour désigner la mesure où un élément d'alliage va se dissoudre dans le métal de base sans former une phase séparée. La ligne de solubilité (ou courbe) est la ligne (ou lignes) sur un diagramme de phase qui donne les limites d'addition du soluté. Autrement dit, les lignes indiquent la quantité maximale d'un composant qui peut être ajouté à un autre composant et être toujours en solution solide. En fabrication microélectronique, de la solubilité solide se réfère à la concentration maximale en impuretés, on peut placer dans le substrat.
Dissolution incongru
De nombreuses substances se dissolvent de manière congruente, à savoir la composition de la matière solide et la partie de soluté dissous stoechiométrique. Toutefois, certaines substances peuvent se dissoudre non congruente, moyennant quoi la composition du soluté dans la solution ne correspond pas à celui du solide. Ceci est accompagné par l'altération de la "primaire solide" et éventuellement la formation d'une phase solide secondaire. Cependant, en général, une certaine solide primaire reste également et un équilibre de solubilité complexe établit. Par exemple, la dissolution de albite peut entraîner la formation de gibbsite.
- NaAlSi 3 O 8 (s) + H + + 7H 2 O = Na + + Al (OH) 3 (s) + 3 H 4 SiO 4.
Dans ce cas, on prévoit que la solubilité de l'albite à dépendre du rapport solide-solvant. Ce genre de solubilité est d'une grande importance en géologie, où elle aboutit à la formation des roches métamorphiques .