
Sodium
À propos de ce écoles sélection Wikipedia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille près de la charité. Lire la suite ...
| Sodium | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
11 Na | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||
métallique blanc argenté  Raies spectrales de sodium | |||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||
| Nom, symbole, nombre | sodium, Na, 11 | ||||||||||||||||||||||||||||
| Prononciation | / s oʊ ré Je ə m / -Əm de SOH | ||||||||||||||||||||||||||||
| Élément Catégorie | métal alcalin | ||||||||||||||||||||||||||||
| Groupe, période, bloc | (1) des métaux alcalins , 3, s | ||||||||||||||||||||||||||||
| Poids atomique standard | 22.98976928 (2) | ||||||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3s 1 2,8,1 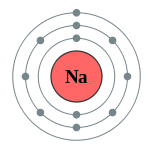 | ||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||
| Découverte | Humphry Davy (1807) | ||||||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1807) | ||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||
| Densité (à proximité rt) | 0,968 g · cm -3 | ||||||||||||||||||||||||||||
| Liquid densité au mp | 0,927 g · cm -3 | ||||||||||||||||||||||||||||
| Point de fusion | 370,87 K , 97,72 ° C, 207,9 ° F | ||||||||||||||||||||||||||||
| Point d'ébullition | 1156 K, 883 ° C, 1621 ° F | ||||||||||||||||||||||||||||
| Point critique | (Extrapolation) 2573 K, 35 MPa | ||||||||||||||||||||||||||||
| La chaleur de fusion | 2,60 kJ · mol -1 | ||||||||||||||||||||||||||||
| Chaleur de vaporisation | 97,42 kJ · mol -1 | ||||||||||||||||||||||||||||
| Capacité thermique molaire | 28,230 J · mol -1 · K -1 | ||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||
| États d'oxydation | 1, -1 (Fortement oxyde de base) | ||||||||||||||||||||||||||||
| Électronégativité | 0,93 (échelle de Pauling) | ||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 495,8 kJ · mol -1 | ||||||||||||||||||||||||||||
| 2ème: 4562 kJ · mol -1 | |||||||||||||||||||||||||||||
| 3ème: 6910,3 kJ · mol -1 | |||||||||||||||||||||||||||||
| Rayon atomique | 186 h | ||||||||||||||||||||||||||||
| Rayon covalente | 166 ± 21 heures | ||||||||||||||||||||||||||||
| Rayon de Van der Waals | 227 h | ||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||
| Crystal structure | cubique centré  | ||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 47,7 nΩ · m | ||||||||||||||||||||||||||||
| Conductivité thermique | 142 W · m -1 · K -1 | ||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 71 um · m -1 · K -1 | ||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,200 m · s -1 | ||||||||||||||||||||||||||||
| Le module d'Young | 10 GPa | ||||||||||||||||||||||||||||
| Module de cisaillement | 3,3 GPa | ||||||||||||||||||||||||||||
| Module Bulk | 6,3 GPa | ||||||||||||||||||||||||||||
| Dureté Mohs | 0,5 | ||||||||||||||||||||||||||||
| Dureté Brinell | 0,69 MPa | ||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-23-5 | ||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||
| Article détaillé: Isotopes du sodium | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Le sodium est un élément chimique avec le symbole Na (du latin : natrium) dans le tableau périodique et de numéro atomique 11. Ce est un, blanc argenté, métal hautement réactif doux et est un membre des métaux alcalins ; sa seule stable isotope est 23 Na. Le métal libre ne se produit pas dans la nature, mais doit être préparé à partir de ses composés; il a d'abord été isolé par Humphry Davy en 1807 par la électrolyse de l'hydroxyde de sodium . Le sodium est le sixième plus abondant élément dans la croûte de la Terre, et existe dans de nombreux minéraux comme le feldspath , sodalite et sel gemme. De nombreux sels de sodium sont très solubles dans l'eau, et leurs sels de sodium a été lessivé par l'action de l'eau de sorte que chlorure et de sodium sont les éléments dissous plus courantes en poids dans les instances de la Terre de l'eau océanique .
Beaucoup de composés du sodium sont utiles, comme l'hydroxyde de sodium (soude caustique) pour fabrication de savon, et le chlorure de sodium destiné à être utilisé comme agent de dégivrage et un nutriment ( sel comestible). Le sodium est un élément essentiel pour tous les animaux et certaines plantes. Chez les animaux, les ions sodium sont utilisés contre potassium ions de se charger sur les membranes cellulaires, ce qui permet la transmission de l'influx nerveux lorsque la charge est dissipée. La nécessité qui en découle d'animaux pour le sodium amène à être classé comme un macro-minéral inorganique alimentaire.
Caractéristiques
Physique
Sodium à température et pression standard est un métal doux qui peut être facilement coupé avec un couteau et est un bon conducteur de l'électricité. Fraîchement exposée, le sodium a un éclat argenté brillant qui se ternit rapidement, formant une couche de peinture blanche de l'hydroxyde de sodium et le carbonate de sodium. Ces propriétés changent à des pressions élevées: à 1,5 Mbar, les changements de couleur au noir, puis au rouge transparent à 1,9 Mbar, et enfin claires transparent à trois Mbar. Tous ces allotropes sont isolants et electrides.
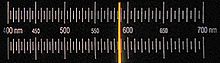
Lorsque sodium ou ses composés sont introduits dans une flamme, ils se tournent en jaune, parce que le excités 3s électrons de sodium émettent un photon quand ils tombent de 3p à 3s; la longueur d'onde de ce photon correspondant à la ligne D à 589,3 nm. Interactions spin-orbite impliquant l'électron dans la scission orbitale 3p la ligne D en deux; structures hyperfins impliquant deux orbitales causent beaucoup plus de lignes.
Chimique

Le sodium est généralement moins réactifs que le potassium et plus réactif que le lithium . Comme tous les métaux alcalins , il réagit exothermique avec l'eau, au point que suffisamment gros morceaux fondent à une sphère et peuvent exploser; Cette réaction produit caustique d'hydroxyde de sodium et inflammable hydrogène gazeux. Quand a brûlé dans l'air sec, il principalement formes le peroxyde de sodium, ainsi que certaines oxyde de sodium. Dans l'air humide, des résultats d'hydroxyde de sodium. Le sodium métallique est fortement réduit, avec la réduction des ions sodium, mais nécessitant -2,71 volts potassium et lithium ont même des potentiels plus négatifs. Par conséquent, l'extraction de métal de sodium de ses composés (tels que le chlorure de sodium) utilise une quantité importante d'énergie.
Isotopes
20 isotopes de sodium sont connus, mais seulement 23 Na est stable. Deux radioactifs, isotopes cosmogéniques sont le sous-produit de cosmique spallation de rayons: 22 Na avec une demi-vie de 2,6 ans et 24 Na avec une demi-vie de 15 heures; tous les autres isotopes ont une demi-vie de moins d'une minute. Deux isomères nucléaires ont été découverts, le plus long vécu un être Na 24m avec une demi-vie d'environ 20,2 microsecondes. Rayonnement neutronique aiguë, par exemple d'un nucléaire accident de criticité, transforme une partie de l'écurie 23 Na dans le sang humain à 24 Na; en mesurant la concentration de Na 24 par rapport à 23 Na, la dose de rayonnement neutronique de la victime peut être calculé.
Occurrence
23 Na est créé dans le processus en fusionnant deux brûler carbone carbone atomes ensemble; ce qui nécessite des températures supérieures à 600 megakelvins et une étoile avec au moins trois masses solaires. La croûte de la Terre a 2,6% de sodium en poids, ce qui en fait la sixième élément le plus abondant sur Terre. En raison de sa réactivité élevée, il ne se trouve jamais en tant que élément pur. Il se trouve dans de nombreux minéraux différents, dont certains très soluble, tel que halite et natron, d'autres beaucoup moins soluble tel que amphibole, et zéolite. L'insolubilité de certains minéraux, tels que de sodium cryolite et feldspath découle de leurs anions polymères, qui dans le cas de feldspath est un polysilicate. Dans le milieu interstellaire, le sodium est identifié par la ligne D; si elle a une température élevée de vaporisation, son abondance permis d'être détecté par Mariner 10 en mercure de l'atmosphère.
Composés

Composés de sodium sont d'une immense importance commerciale, étant particulièrement centrale aux industries produisant du verre , papier, savon, et les textiles . Les composés de sodium qui sont les plus importants comprennent sel de table (Na Cl), carbonate de sodium (Na 2 CO 3 ), bicarbonate de soude (Na HCO 3), la soude caustique (NaOH), nitrate de sodium (Na NO 3 ), di- et tri-phosphates de sodium, du thiosulfate de sodium (Na 2 S 2 O 3 · 5H 2 O), et borax (Na 2 B 4 O 7 · 10H 2 O). Dans ses composés, le sodium est habituellement liaison ionique à l'eau et anions, et est considéré comme un dur Acide de Lewis.
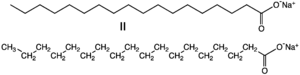
Plus les savons sont des sels de sodium d' acides gras . des savons de sodium sont plus durs (point de fusion plus élevé) que les savons savons de potassium. Le chlorure de sodium est largement utilisé pour antigivrage et dégivrage et comme agent de conservation; le bicarbonate de sodium est principalement utilisé pour la cuisson. Avec potassium, de nombreux médicaments importants ont sodium ajouté pour améliorer leur biodisponibilité; bien que dans la plupart des cas potassium est le mieux ions sodium est choisie pour son faible prix et de poids atomique. l'hydrure de sodium est utilisé comme base pour diverses réactions (telles que la réaction d'aldolisation ) en chimie organique, et comme un agent réducteur en chimie inorganique.
Les solutions aqueuses
Le sodium a tendance à former des composés solubles dans l'eau, tels que des halogénures, des sulfates, des nitrates, des carboxylates et des carbonates. Les principales espèces aqueuses sont les complexes aquo [Na (H 2 O) n] +, dans laquelle n = 4-6. Repose-oxygène L'affinité élevée de sodium des ligands est la base de éthers couronne; les antibiotiques macrolides, qui interfèrent avec le transport de Na + dans l'organisme infectant, sont fonctionnellement liés et plus complexe.
Précipitation directe de sels de sodium à partir de solutions aqueuses est rare, car les sels de sodium ont généralement une forte affinité pour l'eau; une exception est le bismuthate de sodium (NaBiO 3). De ce fait, les sels de sodium sont généralement isolés sous forme de solides par evaporation ou par précipitation avec un solvant organique tel que l'éthanol ; par exemple, seulement 0,35 g / l de chlorure de sodium se dissout dans l'éthanol. Éthers de la Couronne, comme 15-couronne-5, peuvent être utilisés en tant que catalyseur de transfert de phase.
La teneur en sodium en vrac peut être déterminée par traitement avec un grand excès de acétate de zinc uranyle; l'hexahydrate (UO 2) 2 ZnNa (CH 3 CO 2) · 6H 2 O précipités, qui peut être pesé. Le césium et du rubidium ne interfèrent pas avec cette réaction, mais le potassium et le lithium font. Des concentrations plus faibles de sodium peuvent être déterminées par spectrophotométrie d'absorption atomique ou par potentiométrie en utilisant des électrodes sélectives d'ions.
Electrides et sodides
Comme les autres métaux alcalins, le sodium se dissout dans l'ammoniaque et des amines pour donner des solutions de couleur foncée; évaporation de ces solutions laisse un film brillant de sodium métallique. Les solutions contiennent du complexe de coordination (Na (NH 3 6)) +, dont la charge positive est contrebalancée par électrons que anions; cryptands permettent l'isolement de ces complexes comme des solides cristallins. Cryptands, comme les éthers couronnes et autres ionophores, ont une forte affinité pour l'ion sodium; des dérivés de la alkalide Na - peuvent être obtenus par addition de solutions à cryptands de sodium dans l'ammoniac par dismutation.
Composés organosodique

De nombreux composés ont été préparés organosodique. En raison de la forte polarité des liaisons C-Na, ils se comportent comme des sources de carbanions (sels organiques ayant des anions ). Certains dérivés bien connus comprennent cyclopentadiénide de sodium (NaCl 5 H 5) et trityle sodium ((C 6 H 5) 3 CNA).
Histoire
Le sel a été un produit important dans les activités humaines, comme indiqué par le mot salaire anglais, qui découle de salarium, les plaquettes de sel parfois donnés aux soldats romains avec leurs autres salaires. Dans l'Europe médiévale, un composé de sodium avec le nom latin de sodanum a été utilisé comme des maux de tête remède. Le nom sodium est considéré comme provenant de l'arabe Suda (صداع), ce qui signifie des maux de tête, que les propriétés de maux de tête soulageant de carbonate de sodium ou de la soude étaient bien connus dans les premiers temps. L'abréviation chimique de sodium a été publié par Jöns Jakob Berzelius dans son système de symboles atomiques, et est une contraction de l'élément de nouveau nom natrium latine, qui se réfère à l'égyptienne natron, un sel minéral naturel composé essentiellement de carbonate de sodium hydraté. Natron avait historiquement plusieurs usages industriels et domestiques importants, plus tard éclipsé par d'autres composés de sodium. Bien que sodium, parfois appelé soude, avait longtemps été reconnu dans les composés, le métal lui-même n'a pas été isolé jusqu'en 1807 par Sir Humphry Davy travers le électrolyse de l'hydroxyde de sodium .
Sodium confère une couleur jaune intense aux flammes. Dès 1860, Kirchhoff et Bunsen a noté la grande sensibilité d'un test de la flamme de sodium, et a déclaré dans Annalen der Physik und Chemie:
| " | Dans un coin de notre 60 m 3 pièces le plus éloigné de l'appareil, nous explosé 3 mg. de chlorate de sodium avec le sucre du lait tout en observant la flamme non lumineuse avant la fente. Après un certain temps, il rayonnait d'un jaune vif et a montré une ligne forte de sodium qui a disparu seulement après 10 minutes. Du poids du sel de sodium et le volume d'air dans la chambre, nous calculons aisément que une partie en poids de l'air ne pouvait pas contenir plus de poids 1/20 millionième de sodium. | " |
La production commerciale
Bénéficiant d'applications plutôt spécialisés, seulement environ 100 000 tonnes de sodium métallique sont produites annuellement. Le sodium métallique a été produit en 1855 par le commerce la réduction carbothermique de la carbonate de sodium à 1 100 ° C, dans ce qui est connu comme le Extraction de l'alumine:
- Na 2 CO 3 + 2 → C 2 CO 3 Na +
Un procédé apparenté basée sur la réduction de l'hydroxyde de sodium a été développé en 1886.
Sodium est maintenant produit commercialement à travers le électrolyse de fusion du chlorure de sodium , basé sur un procédé breveté en 1924. Cela se fait dans un Downs cellule dans laquelle le NaCl est mélangé avec du chlorure de calcium pour abaisser le point de fusion en dessous de 700 ° C. Comme calcium est inférieure électropositif que le sodium, le calcium ne sera déposé à la cathode. Cette méthode est moins coûteuse que la précédente Castner processus de l'électrolyse de l'hydroxyde de sodium .
Qualité réactif sodium dans des quantités de tonnes vendu pour environ US $ 3,30 / kg en 2009; inférieure métallique de pureté vend pour beaucoup moins. Le marché pour le sodium est instable en raison de la difficulté dans son stockage et l'expédition; il doit être stocké dans un endroit sec atmosphère de gaz inerte ou anhydre huile minérale pour empêcher la formation d'une couche superficielle de l'oxyde de sodium ou superoxyde de sodium. Ces oxydes peuvent réagir violemment en présence d' organiques matériaux. De petites quantités de sodium coûtent beaucoup plus cher, de l'ordre de US $ 165 / kg; le coût élevé est dû en partie à la charge de l'expédition matières dangereuses.
Applications
Bien que le sodium métallique a des utilisations importantes, les principales applications de sodium utiliser dans ses nombreux composés; des millions de tonnes de chlorure , hydroxyde , et carbonate sont produites annuellement.
Élément gratuit
Le sodium métallique est utilisé principalement pour la production de le borohydrure de sodium, de l'azide de sodium, indigo, et la triphénylphosphine. Utilisations antérieures étaient pour la fabrication de plomb tétraéthyle et du titane métal; parce que les applications de ces produits chimiques ont été abandonnées, la production de sodium a diminué après 1970. Le sodium est également utilisé comme un métal d'alliage, un agent anti-desquamation, et comme un agent réducteur pour les métaux alors que d'autres matériaux sont inefficaces. lampes à vapeur de sodium sont souvent utilisés pour l'éclairage des rues dans les villes et donnent des couleurs allant du jaune-orange à la pêche que la pression augmente. Par lui-même ou avec le potassium, le sodium est un déshydratant; il donne une coloration bleue intense avec benzophénone lorsque le dessicat est sec. En la synthèse organique, de sodium est utilisé dans diverses réactions telles que la Réduction de Birch et le test de la fusion de sodium est réalisée pour analyser qualitativement composés. Lasers émettant de la lumière sur la ligne D, utilisant sodium, sont utilisés pour créer artificielle étoiles de guidage laser qui aider à la optique adaptative pour les télescopes en lumière visible terrestres.
Le transfert de chaleur
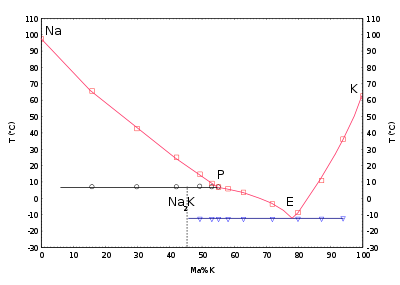
Sodium liquide est utilisé en tant que le transfert de chaleur de fluide en certains réacteurs à neutrons rapides, en raison de sa conductivité thermique élevée et une faible absorption de neutrons section transversale, qui est nécessaire pour atteindre un haut flux de neutrons; le point d'ébullition élevée permet au réacteur de fonctionner à la pression ambiante. Inconvénients de l'utilisation de sodium comprennent son opacité, ce qui entrave la maintenance visuelle, et de ses propriétés explosives. Radioactif sodium-24 peut être formée par activation neutronique pendant le fonctionnement, ce qui pose un léger risque d'irradiation; la radioactivité se arrête au bout de quelques jours après le retrait du réacteur. Si un réacteur doit être fréquemment arrêtée, NaK est utilisée; parce qu'elle est liquide à température ambiante, tuyaux de refroidissement ne gèlent pas. Dans ce cas, la pyrophoricité de potassium signifie précautions supplémentaires contre les fuites doivent être prises. Une autre application de transfert de chaleur est en haute performance des moteurs à combustion interne avec valves à clapet, où les tiges de soupape partiellement remplies de sodium sont utilisés en tant que caloduc refroidir les soupapes.
Rôle biologique
Chez l'homme, le sodium est un nutriment essentiel qui régule le volume sanguin, la pression sanguine, l'équilibre osmotique et pH; l'exigence minimum de sodium physiologique est de 500 milligrammes par jour. Le chlorure de sodium est la principale source de sodium dans l'alimentation, et est utilisé comme assaisonnement et des conservateurs, comme par décapage et saccadée; la plus grande partie provient des aliments transformés. Le DRI en sodium est de 2,3 grammes par jour, mais la moyenne des gens aux États-Unis consomment 3,4 grammes par jour, le montant minimum qui favorise l'hypertension ; à son tour, provoque 7,6 millions de décès prématurés dans le monde.
Le système rénine-angiotensine régule la quantité de fluides et de sodium dans le corps. Réduction de la pression sanguine et la concentration de sodium dans le résultat de rein dans la production de la rénine, qui à son tour produit aldostérone et angiotensine, en conservant sodium dans l'urine. En raison de l'augmentation de la concentration de sodium, la production de rénine diminue, et la concentration de sodium retours à la normale. Le sodium est également important dans la fonction des neurones et osmorégulation entre les cellules et la liquide extracellulaire, leur distribution médiation chez tous les animaux par Na + / K + -ATPase; par conséquent, le sodium est le cation le plus important dans le liquide extracellulaire.
En plantes C4, le sodium est un micronutriments qui aide dans le métabolisme, en particulier dans la régénération de phosphoénolpyruvate et la synthèse de la chlorophylle. Dans d'autres, il se substitue à potassium dans plusieurs rôles, comme le maintien la pression de turgescence et en aidant à l'ouverture et la fermeture des stomates. Sodium en excès dans le sol limite l'absorption d'eau en raison de la baisse potentiel de l'eau, ce qui peut entraîner un flétrissement; des concentrations similaires dans le cytoplasme peut conduire à l'inhibition enzymatique, qui à son tour provoque une nécrose et la chlorose. Pour éviter ces problèmes, les plantes mécanismes développés qui limitent l'absorption de sodium par les racines, les stocker dans la cellule vacuoles, et de les contrôler sur de longues distances; l'excès de sodium peut également être stocké dans les tissus végétaux vieux, limiter les dommages à la nouvelle croissance.
Précautions
Soins est nécessaire dans le traitement de sodium élémentaire, car il génère de l'hydrogène inflammable et caustique d'hydroxyde de sodium au contact avec de l'eau; sodium en poudre peut brûler spontanément dans l'air ou de l'oxygène. L'excès de sodium peut être retiré en toute sécurité par hydrolyse dans une armoire ventilée; ce est généralement fait par traitement séquentiel avec de l'isopropanol, de l'éthanol et de l'eau. Isopropanol réagit très lentement, la génération du correspondant alcoolate et de l'hydrogène. Extincteurs à base d'eau accélérer feux de sodium; ceux à base de dioxyde de carbone et bromochlorodifluorométhane perdre de leur efficacité quand ils se dissipent. Un agent extincteur est efficace Met-LX, qui comprend environ 5% Saran dans du chlorure de sodium ainsi que des agents d'écoulement; il est le plus souvent appliqué à la main avec une boule. D'autres matériaux comprennent Lith +, qui a poudre de graphite et un organophosphorés retardateur de flamme, et le sable sec.

