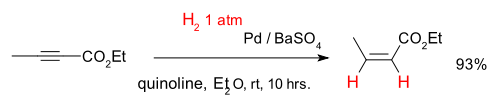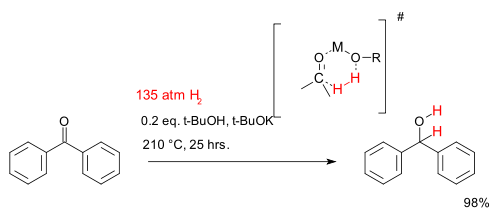Hydrogénation
Saviez-vous ...
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet était une initiative de SOS Enfants. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
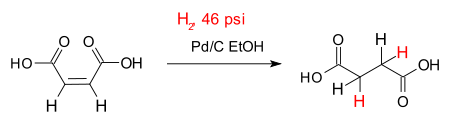
L'hydrogénation est une classe de réactions chimiques qui conduisent à une addition d' hydrogène (H 2) généralement à insaturés composés organiques . Le processus constitue l'ajout d' hydrogène des atomes à la des doubles liaisons d'une molécule par l'utilisation d'un catalyseur . L'hydrogène contribue également à triples liaisons, se ils sont présents. Des substrats typiques comprennent les alcènes , des alcynes, des cétones , nitriles, et imines. La plupart des hydrogénations agit de l'addition directe d'hydrogène diatomique (H 2), mais certains comportent les sources de l'hydrogène, H 2 pas: ces procédés sont appelés hydrogénations de transfert. La réaction inverse, l'élimination de l'hydrogène, est appelée déshydrogénation. Une réaction mettant en jeu l'hydrogène et le clivage d'une liaison carbone-oxygène ou liaison carbone-azote est appelée L'hydrogénolyse. L'hydrogénation est différente de protonation ou Outre hydrure (par exemple de l'utilisation de le borohydrure de sodium): dans hydrogénation, les produits ont la même charge que les réactifs.
L'exemple classique d'une hydrogénation est l'addition d'hydrogène à insaturation liaisons entre carbone atomes , la conversion des alcènes à alcanes . Un exemple simple est l'hydrogénation de de l'acide maléique l'acide succinique représenté sur la droite. De nombreuses applications importantes se trouvent dans la pétrochimiques, industries pharmaceutiques et alimentaires.
Les problèmes de santé associés à l'hydrogénation de graisses insaturées pour produire graisses saturées et gras trans est un aspect important de la conscience actuelle des consommateurs.
Processus
Hydrogénation comporte trois volets:
- la substrat insaturé,
- l'atome d'hydrogène (ou une source d'hydrogène) et, invariablement,
- un catalyseur.
Les utilisations technologiques plus grande échelle de H 2 et l'hydrogénation sont réactions d'hydrogénolyse associés aux industries des produits chimiques à la fois lourdes et fines. L'hydrogénation est l'addition de H 2 à insaturés des composés organiques tels que des alcènes destiné à mettre en alcanes et aldéhydes pour donner les alcools . Les réactions d'hydrogénation nécessitent des catalyseurs métalliques, souvent ceux constitués de platine ou similaire métaux précieux.
L'ajout de H 2 à une alc e ne offre un alk une amende dans la réaction protypical:
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alkyle , aryle)
Une caractéristique importante de l'alcène et alcyne deux hydrogénations homogènes et hétérogènes est que l'addition d'hydrogène se effectue avec addition syn avec de l'hydrogène entrant par le côté le moins encombré.
Catalyseurs
A l'exception rare, pas de réaction au-dessous de 480 ° C se produit entre H 2 et les composés organiques en l'absence de catalyseurs métalliques. Le catalyseur se lie simultanément à la fois le H 2 et le substrat insaturé et facilite leur union. des métaux du groupe du platine, notamment le platine , palladium , rhodium et ruthénium , sont des catalyseurs très actifs. Très catalyseurs actifs fonctionnent à des températures plus basses et des pressions plus faibles de H 2. Des catalyseurs de métaux non précieux, en particulier ceux à base de nickel (tels que Le nickel de Raney et Urushibara nickel) ont également été développés comme des alternatives économiques mais elles sont souvent plus lent ou exiger des températures plus élevées. Le compromis est l'activité (vitesse de réaction) vs. coût du catalyseur et le coût du matériel requis pour l'utilisation de hautes pressions.
Deux grandes familles de catalyseurs sont connus - homogène et hétérogène. Les catalyseurs homogènes se dissolvent dans le solvant qui contient le substrat insaturé. Les catalyseurs hétérogènes sont des solides qui sont en suspension dans le même solvant ou avec le substrat sont traités avec un substrat gazeux. Dans l'industrie pharmaceutique et pour des applications chimiques spéciaux, soluble " "Homogène" "catalyseur sont parfois employé, tel que le rhodium à base de composé connu sous le nom Le catalyseur de Wilkinson, ou l' iridium à base Catalyseur de Crabtree.
L'activité et la sélectivité des catalyseurs peuvent être ajustées en modifiant l'environnement autour du métal, à savoir le sphère de coordination. Différent faces d'un catalyseur hétérogène cristalline présentent des activités distinctes, par exemple. De même, les catalyseurs hétérogènes sont affectés par leurs supports, ce est à dire sur le matériau avec le catalyseur hétérogène est lié. Les catalyseurs homogènes sont affectées par leur ligands. Dans de nombreux cas, des modifications très empiriques comportent des "poisons". Sélectifs Ainsi, un catalyseur choisi avec soin peut être utilisé pour hydrogéner des groupes fonctionnels sans affecter d'autres, comme l'hydrogénation d'alcènes sans toucher cycles aromatiques, ou l'hydrogénation sélective de des alcynes en alcènes à l'aide de Catalyseur de Lindlar. Pour substrats prochiraux, la sélectivité du catalyseur peuvent être ajustées de telle sorte qu'un produit d'énantiomère est produit.
Mécanisme de la réaction
En raison de sa pertinence technologique, "activation" catalysée-métallique de H 2, a été l'objet de nombreuses études, en se concentrant sur la des mécanismes de réaction de métaux qui médient par ces réactions. Tout d'abord marquage isotopique utilisant deutérium peut être utilisé pour déterminer la régiochimie de l'addition:
- RCH = CH 2 + D 2 → RCHDCH 2 D
Essentiellement, le métal se lie à deux composants pour donner un alcène-métallique intermédiaire (H) de deux complexes. La séquence générale de réactions est:
- la liaison de l'hydrogène pour donner un complexe de dihydrure ("addition oxydante"):
- L n M + H 2 → L n MH 2
- la liaison de l'alcène:
- L n M (η 2 H 2) + CH 2 = CHR → L n-1 MH 2 (CH 2 = CHR) L +
- transfert d'un atome d'hydrogène à partir du métal de carbone (insertion migratoire)
- L n-1 MH 2 (CH 2 = CHR) → L n-1 M (H) (CH 2 -CH 2 R)
- transfert du second atome d'hydrogène à partir du métal du groupe alkyle avec dissociation simultanée de l'alcane («d'élimination réductrice»)
- L n-1 M (H) (CH 2 -CH 2 R) → L n-1 M + CH 3 -CH 2 R
Précédant l'addition oxydative de H 2 est la formation d'une complexe dihydrogène.
Températures
La réaction est effectuée à des températures et des pressions différentes en fonction du substrat. L'hydrogénation est fortement réaction exothermique. Lors de l'hydrogénation d'huiles végétales et d'acides gras, par exemple, la chaleur dégagée est d'environ 25 kcal par mole (105 kJ / mol), suffisante pour élever la température de l'huile de 1.6 à 1.7 ° C par la chute de l'indice d'iode.
Portée
Les alcynes peuvent être convertis sélectivement en alcènes dans un hémihydrogénation dite, par exemple avec le composé 2-butynoate d'éthyle et un catalyseur palladium sur le sulfate de baryum et quinoléine (ce qui désactive le catalyseur améliorant chimiosélectivité):
ou avec l'acide 4- (triméthylsilyl) -3-butyne-1-ol:
- 4- (triméthylsilyl) hydrogénation -3-butyne-1-ol
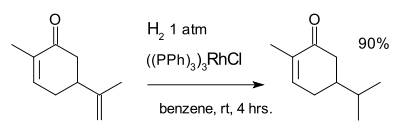
La réaction suivante avec carvone est un exemple de ce est à dire la catalyse homogène Le catalyseur de Wilkinson:
L'hydrogénation est sensible à empêchement stérique expliquer la sélectivité pour la réaction avec le double liaison exocyclique mais pas la double liaison interne.
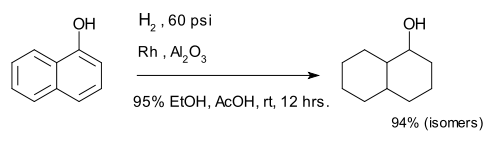
Le composé 1-naphtol est complètement réduit à un mélange de décaline-ol isomères.
Le composé le résorcinol, hydrogéné avec Le nickel de Raney en présence d'aqeous hydroxyde de sodium forme un énolate qui est alkyle avec l'iodure de méthyle en 2-méthyl-1,3-cyclohexandione:
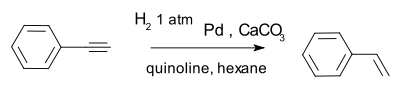
Un catalyseur efficace est le Catalyseur de Lindlar par exemple dans la conversion de phénylacétylène à le styrène.
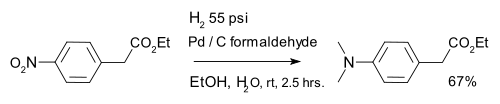
L'hydrogénation est également utilisé dans réduction organique de les composés nitro aromatiques, par exemple des composés nitrés en combinaison avec le palladium sur du carbone et formaldéhyde:
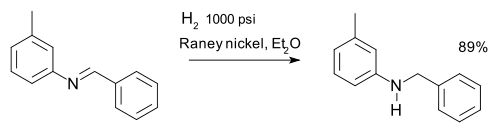
ou la réduction du des imines, par exemple dans une synthèse de m-tolylbenzylamine:
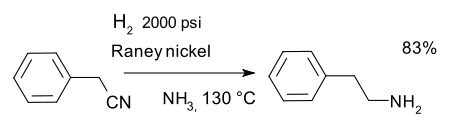
ou la réduction du des nitriles, par exemple dans une synthèse de phénéthylamine avec Le nickel de Raney et l'ammoniac :
Dans l'industrie alimentaire
| Types de graisses dans les aliments |
|---|
|
| Voir également |
|
L'hydrogénation est largement appliquée au traitement des huiles végétales et graisses. L'hydrogénation complète convertit insaturés des acides gras à ceux saturés. En pratique, le procédé ne est généralement pas réalisée à la fin. Étant donné que les huiles d'origine contiennent généralement plus d'un double liaison par molécule (ce est à dire qu'ils sont le poly-insaturés), le résultat est généralement décrit comme une huile végétale partiellement hydrogénée; ce est-à certains, mais habituellement pas la totalité, des doubles liaisons dans chaque molécule ont été réduits. Ceci est réalisé en limitant la quantité d'hydrogène (ou agent réducteur) a laissé réagir avec la matière grasse.
les résultats d'hydrogénation dans la conversion des végétale liquide huiles à graisses solides ou semi-solides, tels que ceux présents dans margarine. Modification du degré de saturation de la graisse change certaines propriétés physiques importantes telles que le point de fusion, ce est pourquoi les huiles liquides deviennent semi-solide. Graisses semi-solides sont préférés pour la cuisson parce que la façon la graisse se mélange avec de la farine produit une texture plus souhaitable dans le produit cuit. Depuis les huiles végétales partiellement hydrogénées sont moins chers que les graisses d'origine animale, sont disponibles dans une large gamme de consistances, et ont d'autres caractéristiques souhaitables (par exemple, l'augmentation de stabilité à l'oxydation (durée de conservation)), ils sont les graisses prédominants utilisés dans la plupart des produits de boulangerie commerciaux . Mélanges de graisses formulées à cet effet sont appelés shortenings.
Répercussions sur la santé
Un effet secondaire de hydrogénation ayant des implications incomplètes pour la santé humaine est le isomérisation des liaisons restantes insaturés de carbone. Le configuration cis de ceux-ci doubles liaisons prédomine dans les graisses non transformés en sources de matières grasses les plus comestibles, mais hydrogénation incomplète convertit partiellement ces molécules isomères trans, qui ont été impliqués dans des maladies du système circulatoire, y compris maladie cardiaque (voir les acides gras trans). Le procédé d'hydrogénation catalytique favorise la conversion de cis liaisons trans parce que la configuration trans a une énergie inférieure à celle cis naturel. A l'équilibre, le rapport des isomères trans / cis est d'environ 2: 1. La législation alimentaire aux États-Unis et les codes de pratique dans l'UE exige depuis longtemps étiquettes déclarant la teneur en gras des aliments dans le commerce de détail, et, plus récemment, ont également exigé la déclaration de la teneur en gras trans.
En 2006, New York City a adopté première interdiction municipale majeure des Etats-Unis sur les gras trans artificiels dans les plus cuisson de restaurant.
Histoire
La première est celle de l'hydrogénation du platine catalysé addition d'hydrogène à l'oxygène dans le Briquet Döbereiner, un dispositif commercialisé dès 1823. Le chimiste français Paul Sabatier est considéré comme le père du processus d'hydrogénation. En 1897, il a découvert que l'introduction d'une trace de nickel comme un catalyseur facilité l'addition d'hydrogène aux molécules de composés de carbone gazeux dans ce qui est maintenant connu sous le nom Processus Sabatier. Pour ce travail Sabatier a remporté la moitié des 1912 prix Nobel de chimie . Wilhelm Normann a obtenu un brevet en Allemagne en 1902 et en Grande-Bretagne en 1903 pour l'hydrogénation des huiles liquides en utilisant de l'hydrogène gazeux, ce qui fut le début de ce qui est maintenant un très grand monde de toute l'industrie. Le commercialement très important Procédé Haber-Bosch (ammoniac hydrogénation) a été décrite pour la première en 1905 et moins Procédé de Fischer-Tropsch (hydrogénation du monoxyde de carbone) en 1922. Une autre application commerciale est la processus d'oxo (1938), un couplage d'hydrogène médiation d'aldéhydes avec des alcènes. Le catalyseur de Wilkinson est la première catalyseur homogène mis au point dans les années 1960 et Noyori hydrogénation asymétrique (1987) l'une des premières applications en synthèse asymétrique. Un article de 2007 a préconisé l'utilisation de plusieurs hydrogénations dans les réactions de couplage CC comme le processus oxo.
Hydrogénation sans métal
Bien que, à toutes fins pratiques hydrogénation nécessite un catalyseur métallique, il existe certains systèmes catalytiques sans métal qui sont étudiés dans la recherche universitaire. Un tel système pour la réduction de cétones se compose de le tert-butanol et tert-butylate de potassium et des températures très élevées. La réaction décrite ci-dessous décrit l'hydrogénation de benzophénone:
Un étude de cinétique chimique trouvé cette réaction est premier ordre dans les trois réactifs suggérant une cyclique à 6 chaînons état de transition.
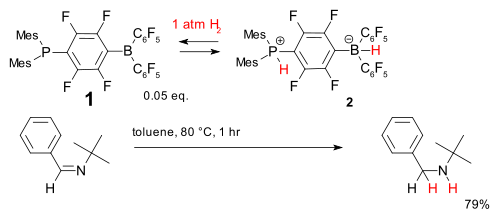
Un autre système est basé sur la phosphine- composé borane (1). Il accepte dihydrogénophosphate de manière réversible à des températures relativement basses pour former le phosphonium borate 2 qui est capable de réduire simple entravé imine.