
Ruthénium
À propos de ce écoles sélection Wikipedia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Pour comparer les organismes de bienfaisance de parrainage ce est le meilleur lien de parrainage .
| Ruthénium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
44 Ru | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
métallique blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | ruthénium, Ru, 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / r U θ Je n Je ə m / roo- THEE -neE-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 8, 5, ré | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 101,07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 4d 7 5s 1 2, 8, 18, 15, 1 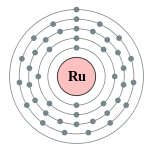 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Jędrzej Śniadecki (1807) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Jędrzej Śniadecki (1807) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconnu comme un distincte élément par | Karl Klaus (1844) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 12,45 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 10,65 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2607 K , 2334 ° C, 4233 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4423 K, 4150 ° C, 7502 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 38,59 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 591,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,06 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 8, 7, 6, 4, 3, 2, 1, -2 (Légèrement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,2 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 710,2 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1620 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2747 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 134 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 146 ± 19 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) de 71 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 117 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) de 6,4 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 5,970 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 447 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 173 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 220 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 2160 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-18-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du ruthénium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le ruthénium est un élément chimique avec le symbole Ru et de numéro atomique 44. Il est rare métal de transition appartenant à la groupe du platine du tableau périodique . Comme les autres métaux du groupe du platine, du ruthénium est inerte à la plupart des produits chimiques. Le Scientifique allemand Baltique Karl Klaus a découvert l'élément en 1844 et l'a nommé après Ruthénie, le mot pour latine Rus '. Ruthénium se produit généralement une composante mineure de platine de minerais et sa production annuelle ne est que de 20 tonnes. La plupart ruthénium est utilisé pour les contacts électriques résistant à l'usure et la production de résistances à couche épaisse. Une application mineure de ruthénium est son utilisation dans certains platine alliages.
Caractéristiques
Propriétés physiques

Un disque métal blanc polyvalent, ruthénium est un membre de la groupe du platine et est en groupe 8 de la classification périodique:
| Z | Élément | Nombre de électrons / shell |
|---|---|---|
| 26 | fer | 2, 8, 14, 2 |
| 44 | ruthénium | 2, 8, 18, 15, 1 |
| 76 | osmium | 2, 8, 18, 32, 14, 2 |
| 108 | hassium | 2, 8, 18, 32, 32, 14, 2 |
Cependant, il a une configuration atypique dans ses couches électroniques ultrapériphériques: alors que tout autre groupe 8 éléments ont deux électrons de la couche la plus externe, en ruthénium, un de ceux est transférée à une coque inférieure. Cet effet peut être observé dans les métaux voisins niobium (41), le rhodium (45), et du palladium (46).
Ruthénium a quatre modifications cristallines et ne ternit pas à des températures normales. Ruthénium dissout dans les alcalis en fusion, ne est pas attaqué par les acides mais est attaqué par des halogènes à haute température. De petites quantités de ruthénium peuvent augmenter la dureté du platine et du palladium . La corrosion résistance de titane est nettement augmenté par l'addition d'une petite quantité de ruthénium.
Ce métal peut être plaqué soit par galvanisation ou par des procédés de décomposition thermique. Un ruthénium molybdène alliage est connu pour être supraconducteur à des températures inférieures à 10,6 K .
Isotopes
Naturellement ruthénium survenant est composé de sept stables isotopes . En outre, les 34 isotopes radioactifs ont été découverts. De ceux-ci radio-isotopes, les plus stables sont 106 Ru avec une demi-vie de 373,59 jours, 103 Ru avec une demi-vie de 39,26 jours et 97 Ru avec une demi-vie de 2,9 jours.
Quinze autres radio-isotopes ont été caractérisés avec poids atomiques allant de 89,93 u (90 Ru) à 114,928 u (115 Ru). La plupart d'entre eux ont des demi-vies qui sont moins de cinq minutes à l'exception de 95 Ru (demi-vie: 1,643 heures) et 105 Ru (demi-vie: 4,44 heures).
Le primaire mode de désintégration avant l'isotope le plus abondant, 102 Ru, est capture d'électrons et le mode primaire après est- émissions beta. Le primaire produit de désintégration avant 102 Ru est le technétium et le mode primaire après est rhodium .
Occurrence
Le ruthénium est extrêmement rare, seulement le 74e la plupart des métaux abondant sur Terre. Cet élément est généralement trouvé dans les minerais avec les autres métaux du groupe du platine dans le Oural et en Amérique du Nord et du Sud. Petits mais commercialement importantes quantités sont également présents dans extrait de pentlandite Sudbury, Ontario, Canada , et dépôts de pyroxénite en Afrique du Sud . La forme native de ruthénium est un minéral très rare (Ir remplace une partie de Ru dans sa structure).
Production
Exploitation minière
Environ 12 tonnes de ruthénium est extrait chaque année avec des réserves mondiales, estimées en 5000 tonnes. La composition des mélanges extrait métal du groupe du platine (PGM) varie dans une large gamme en fonction de la formation géochimique. Par exemple, les platinoïdes minées en Afrique du Sud contiennent en moyenne 11% de ruthénium alors que les platinoïdes extraits dans l'ex-URSS ne contiennent que 2% sur la base de recherche datant de 1992.
Le ruthénium, comme les autres métaux du groupe du platine, est obtenu dans le commerce en tant que sous-produit à partir de nickel et de cuivre extraction et de traitement, ainsi que par le traitement du groupe du platine de minerais métalliques. Pendant électroraffinage du cuivre et du nickel, des métaux nobles tels que l'argent, l'or et les métaux du groupe du platine se déposent au fond de la cellule sous forme de boue d'anode, qui forme le point de départ de leur extraction. Pour séparer les métaux, ils doivent d'abord être mis en solution. Plusieurs méthodes sont disponibles selon le procédé de séparation et la composition du mélange; deux procédés représentatifs sont fusion avec le peroxyde de sodium, puis par dissolution dans l'eau régale, et la dissolution dans un mélange de chlore avec de l'acide chlorhydrique . L'osmium, le ruthénium, le rhodium et l'iridium peuvent être séparés du platine et de l'or et les métaux de base par leur insolubilité dans l'eau régale, laissant un résidu solide. Le rhodium peut être séparé du résidu par traitement avec du bisulfate de sodium fondu. Le résidu insoluble, contenant Ru, Os et Ir est traité avec de l'oxyde de sodium, dans lequel est insoluble Ir, Ru et Os produire des sels solubles dans l'eau. Après oxydation des oxydes volatils, RuO 4 est séparée de OsO 4 par précipitation de (NH 4) 3 RuCl 6 avec du chlorure d'ammonium ou par distillation ou par extraction avec des solvants organiques du tétroxyde d'osmium volatil. L'hydrogène est utilisé pour diminuer chlorure d'ammonium de ruthénium donne une poudre. La première méthode pour précipiter le ruthénium avec du chlorure d'ammonium est similaire à la procédure que Smithson Tennant et William Hyde Wollaston utilisé pour leur séparation. Plusieurs méthodes sont adaptés à la production industrielle à grande échelle. Dans les deux cas, le produit est réduit avec de l'hydrogène, ce qui donne la forme d'une poudre métallique ou une éponge qui peut être traité en utilisant techniques de métallurgie des poudres ou par l'argon - soudage à l'arc.
À partir de combustibles nucléaires utilisés
Les produits de fission de uranium-235 contient des quantités significatives de ruthénium et les métaux du groupe du platine, et donc plus légers combustible nucléaire irradié pourrait être une source possible de ruthénium. L'extraction est coûteux et compliqué les isotopes radioactifs de ruthénium qui sont présents ferait un stockage de plusieurs demi-vie des isotopes nécessaires en décomposition. Cela rend cette source de ruthénium peu attrayant et ne extraction à grande échelle a été commencé.
Les composés chimiques
Les états d'oxydation du ruthénium plage de 0-8, et -2. Les propriétés de ruthénium et d'osmium composés sont souvent similaires. Les 2, 3 et 4 Etats sont les plus communs. Le précurseur le plus répandu est trichlorure de ruthénium, un solide rouge qui est mal défini chimiquement mais polyvalent synthétique.
Oxydes
Ruthénium peut être à oxyder ruthénium (IV) oxyde (RuO 2, l'état d'oxydation +4), qui peut à son tour être oxydé par le métaperiodate de sodium à tétroxyde de ruthénium, RuO 4, un agent oxydant puissant avec la structure et les propriétés analogues à tétroxyde d'osmium. Comme tétroxyde d'osmium, le ruthénium tétroxyde est un fixateur puissant et tache pour la microscopie électronique de matières organiques, et est principalement utilisé pour révéler la structure des échantillons de polymères. Dipotassique ruthénate (K 2 RuO 4, 6), et perruthénate de potassium (Kruo 4, 7) sont également connus.
complexes de coordination et organométalliques

Le ruthénium forme une variété de complexes de coordination. Des exemples sont les dérivés de nombreux pentammine [Ru (NH 3) 5 L] n + qui existe souvent dans les deux Ru (II) et Ru (III). Dérivés de bipyridine et terpyridine sont nombreux, plus connu étant le luminescent tris (bipyridine) ruthénium (II).
Ruthénium former une large gamme de composés avec des liaisons carbone-ruthénium. Ruthénocène est analogue à ferrocène structurellement, mais présente des propriétés distinctives redox. Un grand nombre de complexes de monoxyde de carbone sont connus, le parent étant triruthénium dodécacarbonyle. L'analogue de pentacarbonyle de fer, le ruthénium pentacarbonyle est instable dans les conditions ambiantes. Le trichlorure de ruthénium (carbonylates réagit avec le monoxyde de carbone) pour donner les mono- et diruthénium (II) à partir de laquelle les carbonyles de nombreux dérivés ont été préparés comme RuHCl (CO) (PPh 3) 3 et Ru (CO) 2 (PPh 3) 3 ( Le complexe de Roper). Solutions de chauffage de trichlorure de ruthénium en alcools avec triphénylphosphine donne tris (triphénylphosphine) ruthénium (RuCl 2 (PPh 3 3)), qui convertit le complexe ruthénium chlorohydridotris hydrure (triphénylphosphine) (II) (RuHCl (PPh3) 3).
Dans le domaine de la synthèse de la chimie fine, Catalyseur de Grubbs est utilisé pour la métathèse alcène.
Ruthenides
ruthenides métalliques (Ru 2-) sont très rares, mais on trouve couramment dans les applications de supraconducteurs, en particulier en ce qui concerne par exemple les métaux lanthanides cérium ruthenide (Ceru 2).
Histoire
Bien que les alliages de platine contenant tous les six naturelle des métaux du groupe du platine ont été utilisés depuis longtemps par précolombienne Américains et connu comme un matériau pour les chimistes européens du milieu du 16ème siècle, il a fallu attendre le milieu du 18e siècle pour le platine d'être identifié comme un élément pur. La découverte que le platine naturelle contenue palladium, le rhodium, l'osmium et l'iridium se est produite dans la première décennie du 19ème siècle. Platinum dans sables alluvionnaires des fleuves russes ont donné l'accès à la matière première pour une utilisation dans des plaques et médailles et pour la frappe de rouble pièces , à partir de 1828. Les résidus de la production de platine pour la frappe étaient disponibles dans l'Empire russe, et donc la plupart des recherches sur eux a été fait en Europe de l'Est.
Il est possible que le polonais chimiste Jędrzej Śniadecki élément isolé 44 (qu'il a appelé "vestium") à partir de minerais de platine en 1807. Il a publié sa découverte en langue polonaise dans l'article "Rosprawa o nowym usi w surowey platynie odkrytym" en 1808. Son travail n'a jamais été confirmée, cependant, et il a ensuite retiré sa demande de découverte. Jöns Berzelius et Gottfried Osann près découvert le ruthénium en 1827. Ils ont examiné les résidus qui étaient restés après la dissolution de platine brut de la Oural en l'eau régale. Berzelius n'a pas trouvé de métaux inhabituels, mais Osann pensait il a trouvé trois nouveaux métaux, pluranium, le ruthénium et polinium. Cet écart a conduit à une longue controverse entre Berzelius et Osann sur la composition des résidus.
En 1844, le Scientifique allemand Baltique Karl Klaus a montré que les composés préparés par Gottfried Osann contenue petites quantités de ruthénium, qui avait Claus découvert la même année. Claus ruthénium isolé à partir des résidus de platine de la production du rouble alors qu'il travaillait dans Université de Kazan, Kazan. Claus a montré que l'oxyde de ruthénium contenait un nouveau métal et obtient 6 g de ruthénium à partir de la partie de platine brut qui est insoluble dans l'eau régale.
Le nom dérive de Ruthénie, le mot pour latine Rus ', un quartier historique qui comprend aujourd'hui l'ouest la Russie , l'Ukraine , le Bélarus , et certaines parties de la Slovaquie et de la Pologne . Claus a utilisé le nom proposé par Gottfried Osann en 1828. Il a choisi le nom de l'élément en l'honneur de son birthland, comme il est né en Tartu, Estonie , qui était à l'époque une partie de l' Empire russe .
Applications
En raison de sa capacité à durcir le platine et le palladium, le ruthénium est utilisé dans les alliages de platine et de palladium pour rendre résistant à l'usure des contacts électriques. Dans cette application, les films métallisés seulement mince sont utilisés pour obtenir la résistance à l'usure nécessaire. En raison de son faible coût et des propriétés semblables par rapport au rhodium, l'utilisation en tant que matériau de revêtement pour contacts électriques est l'une des principales applications. Les couches minces sont soit appliqués par électrodéposition ou pulvérisation cathodique.
dioxyde de ruthénium et de plomb et de bismuth ruthénates sont utilisés dans résistances à puce en couche épaisse. Ces deux applications électroniques représentent 50% de la consommation de ruthénium.
Seuls quelques alliages de ruthénium sont utilisés, autres que ceux avec d'autres métaux du groupe du platine. Ruthénium est souvent utilisé en petites quantités dans les alliages pour améliorer certaines de leurs propriétés. L'effet bénéfique sur la résistance à la corrosion du titane alliages conduit à l'élaboration d'un alliage spécial contenant 0,1% de ruthénium. Ruthénium est également utilisé dans certains haute température monocristallin avancée superalliages, avec des applications, notamment des aubes de turbine dans les moteurs à réaction . Compositions de superalliage à base de nickel Plusieurs sont décrits dans la littérature. Parmi eux se trouvent EPM-102 (avec 3% de Ru) et TMS-162 (avec 6% de Ru), ainsi que TMS-138 et TMS-174. les deux contenant 6% de rhénium . pointes de stylet de Fontaine sont souvent déversées avec des alliages contenant du ruthénium. De 1944 en avant, la célèbre Stylo Parker 51 de fontaine a été équipé de la plume "RU", une plume d'or 14K basculé avec 96,2% de ruthénium et de 3,8% d'iridium .
Le ruthénium est un composant de oxyde de métal mixte (MMO) anodes utilisés pour la protection cathodique de structures souterraines et immergées, ainsi que pour les cellules électrolytiques pour des procédés chimiques tels que de produire du chlore à partir de l'eau salée. Le fluorescence de certains complexes du ruthénium est trempé par l'oxygène, ce qui a conduit à leur utilisation comme capteurs de Optode pour l'oxygène. Le rouge de ruthénium, [(NH 3) 5-O-Ru Ru (NH 3) 4 -O-Ru (NH 3) 5] 6+, est un tache biologique utilisé pour colorer molécules polyanioniques tels que la pectine et acides nucléiques pour microscopie optique et microscopie électronique. L'isotope bêta-décomposition 106 de ruthénium est utilisé en radiothérapie des tumeurs oculaires, principalement mélanomes malins de la uvée. complexes de ruthénium-centrée sont à l'étude pour les propriétés anticancéreuses possibles. Par rapport aux complexes de platine, de ruthénium ceux montrent une plus grande résistance à l'hydrolyse et une action plus sélective sur les tumeurs. NAMI-A et KP1019 sont deux médicaments en cours d'évaluation clinique contre les tumeurs métastatiques et les cancers du côlon.
Catalyse
Le ruthénium est un catalyseur polyvalent. Le sulfure d'hydrogène peut être divisée par la lumière en utilisant une suspension aqueuse de CdS particules chargées avec du dioxyde de ruthénium. Cela peut être utile dans l'élimination de H 2 S dans les raffineries de pétrole et les autres installations de traitement industriel. Ruthénium organométallique carbène et des complexes alkylidène se sont révélés être des catalyseurs très efficaces pour métathèse des oléfines, un processus avec des applications importantes en chimie organique et pharmaceutique.
Conversion de l'énergie solaire
Certains complexes de ruthénium absorber la lumière à travers le spectre visible et sont l'objet de recherches activement à diverses, potentiels, énergie solaire technologies. Par exemple, des composés à base de ruthénium ont été utilisées pour l'absorption de la lumière dans à colorant les cellules solaires, une nouvelle prometteuse à faible coût d'un système de cellules solaires.
Stockage de données
Dépôt en phase vapeur chimique de ruthénium est utilisé comme un procédé pour produire des films minces de ruthénium pur sur des substrats. Ces films montrent des propriétés prometteuses pour l'utilisation de puces et pour le géant élément de lecture à magnétorésistance pour les lecteurs de disque dur. Le ruthénium a également été suggéré comme matériau pour la microélectronique possible parce que son utilisation est compatible avec les techniques de traitement de semi-conducteur.
Matériaux exotiques
De nombreux oxydes à base de ruthénium présentent des propriétés très inhabituelles, comme un comportement quantique critique point, exotique la supraconductivité , et à haute température ferromagnétisme.

