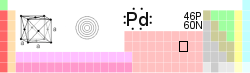
Palladium
Contexte des écoles Wikipédia
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet était une initiative de SOS Enfants. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Données générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom , symbole, nombre | palladium, Pd, 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | les métaux de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, Période, Bloc | 10, 5, ré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | métallique blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 106,42 (1) g · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 4d 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par coquille | 2, 8, 18, 18, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 12,023 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 10,38 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1828,05 K (1554,9 ° C, 2830,82 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3236 K (2963 ° C, 5365 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 16,74 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chaleur de vaporisation 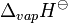 | 362 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique spécifique | (25 ° C) 25,98 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | visage cubique centrée | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 4 (Légèrement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,20 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 804,4 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1870 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3177 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 140 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc.) | 169 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 131 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 163 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | pas de données | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 105,4 n Ω · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | (300 K) 71,8 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 11,8 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3070 mlle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 121 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 180 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 4,75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 461 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 37,3 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-05-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Références | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Palladium (\ prononcée pe-'La-de-em \) est un métal blanc argenté rare et brillant qui a été découvert en 1803 par William Hyde Wollaston, qui l'a nommée le palladium de l'astéroïde Pallas, qui à son tour, a été nommé pour la déesse grecque de la sagesse. Le symbole de palladium est Pd, et son numéro atomique est 46. Le palladium, ainsi que le platine , rhodium , ruthénium , iridium et osmium former un groupe d'éléments dénommé métaux du groupe platine (MGP de). Platinoïdes part des propriétés chimiques similaires, mais palladium est unique en ce qu'elle a le point de fusion le plus bas et est la moins dense de ces métaux précieux. Étonnamment, lorsque le palladium est à température ambiante et pression atmosphérique, il peut absorber jusqu'à 900 fois son propre volume d' hydrogène , ce qui rend le palladium d'un support de stockage efficace et sûr pour les isotopes d'hydrogène et d'hydrogène. Palladium est également ternir résistant à la chaleur, électriquement stable et résistant à l'érosion chimique ainsi que intense.
Les propriétés uniques de palladium et autres platinoïdes nécessitent leur utilisation généralisée comme l'un dans quatre des produits fabriqués aujourd'hui contiennent soit PGM ou avaient PGM jouer un rôle clé au cours du processus de fabrication. Plus de la moitié de l'approvisionnement de palladium et de sa soeur métal platine va dans les convertisseurs catalytiques, qui convertissent jusqu'à 90% de gaz nocifs des gaz d'échappement d'automobiles ( des hydrocarbures, du monoxyde de carbone et l'oxyde d'azote) en des substances moins nocives ( azote , dioxyde de carbone et vapeur d'eau). Précieux métal qualités et l'apparence de Palladium génèrent une consommation importante dans le luxe des bijoux marché. Palladium se trouve dans de nombreux appareils électroniques, y compris les ordinateurs , les téléphones mobiles , multicouches condensateurs céramiques, composante placage, contacts électriques basse tension, et SED / OLED / LCD téléviseurs . Le palladium est également utilisé dans dentisterie, la médecine , la purification de l'hydrogène, des applications chimiques, le traitement des eaux souterraines, et elle joue un rôle clé dans la technologie utilisée pour les piles à combustible, qui combinent un atome d'hydrogène et l'oxygène pour produire de l'électricité, de la chaleur et de l'eau avec pratiquement aucune pollution .
Dépôts de minerai de palladium et d'autres platinoïdes sont rares, et les dépôts les plus étendus ont été trouvés dans la ceinture de la norite Bushveld complexe igné dans le Transvaal en Afrique du Sud , le Stillwater Complex à Montana, États-Unis , le Sudbury District de Ontario Canada et de la Norilsk Complex à la Russie . Outre l'exploitation minière , le palladium est également récupéré par recyclage ; dont la majeure partie provient de convertisseurs catalytiques mis au rebut. Les nombreuses applications et sources d'approvisionnement limitées de résultat de palladium en palladium dessin considérable l'intérêt de l'investissement.
Histoire
Palladium était découverte par William Hyde Wollaston en 1803 . Cet élément a été nommé par Wollaston en 1804 après l'astéroïde Pallas, qui a été découvert deux ans plus tôt.
Wollaston trouvé palladium dans le minerai de platine brut de l'Amérique du Sud par dissolution du minerai dans l'eau régale, la neutralisation de la solution avec de l'hydroxyde de sodium , et de précipitation du platine en tant que chloroplatinate d'ammonium avec chlorure d'ammonium. Il a ajouté le cyanure mercurique pour former le composé cyanure de palladium, qui a été chauffé pour extraire le palladium métallique.
chlorure de palladium a été à un moment prescrit comme la tuberculose traitement à la dose de 0,065 g par jour (environ un milligramme par kilogramme de poids corporel). Ce traitement a eu de nombreuses répercussions effets secondaires, et a ensuite été remplacés par des médicaments plus efficaces.
L'affinité de Palladium pour l'hydrogène a amené à jouer un rôle essentiel dans la Expérience Fleischmann-Pons en 1989, également connu sous le nom la fusion froide.
Dans la course jusqu'à 2000 , l'offre russe de palladium sur le marché mondial a été retardée à plusieurs reprises et perturbé parce que le quota d'exportation n'a pas été accordée à l'heure, pour des raisons politiques. Le suivi des achats de panique de marché a conduit le prix du palladium à un niveau record de 1100 $ l'once, atteint en Janvier 2001. Au cours de la période de temps, Ford Motor Company , dans la crainte de la production perturbations du véhicule automobile en raison d'une pénurie possible de palladium, stocké grande quantités de métal, achetés près du prix élevé. Comme les prix par la suite tombées début 2001 , Ford a perdu près de $ 1,000,000,000 dollars américains .
La demande mondiale de palladium a augmenté de 100 tonnes en 1990 à près de 300 tonnes en 2000. La production mondiale des mines était de 222 tonnes en 2006 selon les données de l'USGS. La plupart palladium est utilisé pour Les convertisseurs catalytiques dans l'industrie automobile.
Occurrence
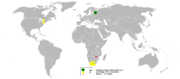
En 2005, la Russie était le premier producteur de palladium avec au moins 50% de part de monde suivie par l'Afrique du Sud, États-Unis et au Canada, rapporte le British Geological Survey.
Le palladium se trouve sous forme de métal libre et allié avec du platine et de l'or avec des métaux du groupe du platine dans dépôts alluvionnaires de la Oural, l'Australie , l'Ethiopie , du Sud et Amérique du Nord . Il est produit commercialement à partir de nickel - cuivre dépôts trouvés dans l'Afrique du Sud , Ontario, et Sibérie; l'énorme volume de minerai traité rend cette extraction rentable malgré la faible proportion de palladium dans ces minerais. Plus grand producteur au monde de palladium est MMC Norilsk Nickel produit à partir du Gisements de nickel Norilsk-Talnakh. Le Merensky Reef de la Bushveld complexe igné d'Afrique du Sud contient du palladium importante en plus d'autres éléments du groupe du platine. Le Stillwater complexe igné de Montana contient également le palladium exploitable.
Palladium est également produit dans la fission nucléaire des réacteurs et peut être extraite de combustible nucléaire usé, voir Synthèse des métaux nobles, si la quantité produite est insignifiant.
Palladium se trouve dans les minéraux rares cooperite et polarite.
Caractéristiques

Le palladium est un métal argenté douce qui ressemble platine . Ce est le moins dense et a le plus bas point de fusion de la des métaux du groupe du platine. Il est doux et ductile lorsqu'il recuit et augmente considérablement sa résistance et de dureté lorsqu'il est travaillé à froid. Le palladium est chimiquement attaquée par sulfurique , nitrique et l'acide chlorhydrique dans lequel il se dissout lentement. Ce métal aussi ne réagit pas avec l'oxygène à des températures normales (et donc ne ternit pas dans l'air ). Palladium chauffé à 800 ° C va produire une couche d'oxyde de palladium (II) (AOP) de. Il ternit légèrement dans un sol humide atmosphère contenant du soufre.
Ce métal a la capacité rare de absorber jusqu'à 900 fois son propre volume d' hydrogène à la température ambiante. On pense que cette forme éventuellement hydrure de palladium (PdH 2), mais il ne est pas encore clair si ce est un véritable composé chimique .
Lorsque palladium a absorbé de grandes quantités d'hydrogène, il se étendre légèrement en taille.
Communes états d'oxydation de palladium sont 0, + 1, 2 et 4. Bien qu'à l'origine 3 était considéré comme l'un des états d'oxydation fondamentaux de palladium, il ne existe aucune preuve pour le palladium se produisant dans l'état d'oxydation +3; ce qui a été étudié par l'intermédiaire Diffraction des rayons X pour un certain nombre de composés, ce qui indique une dimère de palladium (II) et le palladium (IV) à la place. Récemment, composés avec un état de six d'oxydation ont été synthétisés.
Isotopes
Palladium naturelle est composée de six isotopes . Le plus stable radio-isotopes sont 107 Pd avec une demi-vie de 6,5 millions d'années, 103 Pd avec une demi-vie de 17 jours, 100 et Pd avec une demi-vie de 3,63 jours. Dix-huit autres radio-isotopes ont été caractérisés avec poids atomiques allant de 92,936 u (93 Pd) à 119,924 u (120 Pd). La plupart d'entre eux ont des demi-vies qui sont moins d'une demi-heure, à l'exception 101 Pd (demi-vie: 8,47 heures), 109 Pd (demi-vie: 13,7 heures), et 112 Pd (demi-vie: 21 heures) .
Le primaire mode de désintégration avant l'isotope stable le plus abondant, 106 Pd, est capture d'électrons et le mode primaire après est- désintégration bêta. Le primaire produit de désintégration avant 106 Pd est le rhodium et le produit primaire après est l'argent .
Radiogénique 107 Ag est un produit de désintégration du 107 Pd et a été découvert dans le Santa Clara, Californie météorite de 1978 . Les découvreurs suggèrent que la coalescence et la différenciation des petites planètes de fer à noyau ont pu se produire 10.000.000 années après une événement nucleosynthetic. 107 par rapport à Pd Ag des corrélations observées dans les organes, qui ont manifestement été fondues depuis accrétion du système solaire , doit tenir compte de la présence de radionucléides de courte durée dans le système solaire primitif.
Applications
Le palladium est utilisé en dentisterie, regarder faire, dans les bandelettes de test de glycémie, dans les avions les bougies d'allumage et dans la production de et les instruments chirurgicaux des contacts électriques. Le palladium est également utilisé pour faire professionnel flûtes traversières.
Électronique
L'application la plus importante de palladium dans l'électronique fait le Condensateur céramique multicouche. Palladium (palladium et d'argent alliages) sont utilisés comme électrodes dans multicouche céramique condensateurs. Palladium (parfois allié avec du nickel ) est utilisé dans les placages de connecteur dans l'électronique grand public.
Il est également utilisé dans le placage de composants électroniques et des matériaux de soudure. Le secteur de l'électronique a consommé 1,07 millions d'onces troy de palladium en 2006, selon un Rapport Johnson Matthey.
Technologie
L'hydrogène diffuse facilement à travers le palladium chauffé; Ainsi, il offre un moyen de purifier le gaz. Les réacteurs à membranes avec des membranes de Pd sont donc utilisés pour la production d' hydrogène .
Ce est dans le cadre de la électrode palladium-hydrogène dans les études électrochimiques. Palladium (II) chlorure peut absorber de grandes quantités de monoxyde de carbone gazeux, et est utilisé dans des détecteurs de monoxyde de carbone.
Catalyse
Quand il est finement divisé, tel que dans le palladium sur charbon, le palladium forme un bon catalyseur et est utilisé pour accélérer hydrogénation et Les réactions de déshydrogénation, ainsi que dans le craquage du pétrole. Un grand nombre de liaison carbone-carbone formant réactions en chimie organique (par exemple, le Heck et Couplage de Suzuki) sont facilitées par catalyse avec des composés de palladium. La plus grande utilisation du palladium est aujourd'hui dans convertisseurs catalytiques.
Pd est également un métal polyvalent pour catalyse homogène. Il est utilisé en combinaison avec une grande variété de des ligands pour les transformations chimiques hautement sélectifs.
stockage de l'hydrogène
Le palladium est du palladium hydrure métallique qui contient une quantité substantielle d' hydrogène dans son réseau cristallin. À la température ambiante et atmosphérique la pression, le palladium peut absorber jusqu'à 935 fois son propre volume d'hydrogène dans un processus réversible. Cette propriété a été étudiée car le stockage d'hydrogène est de ces intérêts et une meilleure compréhension de ce qui se passe au niveau moléculaire pourrait donner des indices à la conception améliorée des hydrures de métaux. Un magasin de base de palladium, cependant, serait prohibitif en raison du coût du métal.
Bijoux

Palladium se a parfois été utilisé comme un métal précieux en bijoux , en remplacement de platine ou or blanc. Ce est en raison de ses propriétés naturellement blanc lui donnant pas besoin de rhodium placage. Il est légèrement plus blanc, plus léger et environ 12% plus dur. Semblable à l'or, le palladium peut être battu en une forme de feuille mince mince comme 100 nm (1/250 000 in). Comme le platine, il élaborera un flou patine avec le temps. Contrairement à platine, cependant, le palladium se décolore au la température de brasage, deviennent fragiles avec le chauffage et le refroidissement répétés, et réagissent avec les acides forts.
Il peut également être utilisé comme un substitut de nickel lors de l'or blanc. Palladium est l'un des trois métaux les plus utilisés qui peuvent être allié avec l'or pour produire de l'or blanc. ( nickel et d'argent peuvent également être utilisés.) palladium-or est un alliage beaucoup plus coûteux que le nickel-or, mais est hypoallergénique et conserve sa couleur blanche mieux.
Lorsque le platine a été déclarée une ressource stratégique du gouvernement pendant la Seconde Guerre mondiale , de nombreuses bandes de bijoux ont été fabriqués à partir de palladium. Aussi récemment qu'en Septembre 2001, le palladium était plus cher que le platine et rarement utilisé dans les bijoux aussi en raison de l'obstacle technique coulée. Cependant, le problème de coulée a été résolu, et son utilisation dans les bijoux a augmenté en raison d'un grand pic dans le prix du platine et une baisse du prix du palladium.
Avant 2004, l'usage principal de palladium dans les bijoux était comme un alliage dans la fabrication de bijoux en or blanc, mais, dès le début de 2004, lorsque l'or et le prix du platine ont commencé à monter en flèche, bijoutiers chinois ont commencé à fabriquer des volumes importants de bijoux en palladium. Johnson Matthey estime que, en 2004 avec l'introduction de bijoux en palladium en Chine, la demande de palladium pour les bijoux de fabrication a été de 920.000 onces, soit environ 14% de la demande totale de palladium pour 2004, soit une augmentation de près de 700000 onces à partir de 2003. continué Cette croissance en 2005, à la demande de bijoux dans le monde entier pour le palladium estimée d'environ 1,4 millions d'onces, soit près de 21% de l'offre de palladium net, encore une fois avec la plupart de la demande centrée en Chine.
Photographie
Avec le platinotype photographes de processus d'impression font de beaux-arts impressions en noir et blanc à l'aide de sels de platine ou de palladium. Souvent utilisé avec le platine, le palladium offre une alternative à l'argent.
Art
Feuille de palladium est l'un des plusieurs alternatives à la feuille d'argent utilisée dans l'enluminure. L'utilisation de la feuille d'argent est problématique en raison de sa prédisposition à ternir. feuille d'aluminium est une alternative très bon marché, mais l'aluminium est beaucoup plus difficile à travailler que l'or ou l'argent et les résultats en moins de résultats optimaux lors de l'utilisation des techniques traditionnelles de feuillaison métalliques, et ainsi de feuille de palladium est considéré comme le meilleur substitut malgré son coût considérable. Platinum feuille peut être utilisée pour le même effet que la feuille de palladium avec des propriétés de travail similaires, mais il ne est pas aussi facilement disponibles sous forme de feuilles dans le commerce.