
Alcène
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.

Dans la chimie organique , d'un alcène, de l'oléfine ou l'oléfine est une insaturé composé chimique contenant au moins un carbone de la carbone double liaison. Les simples alcènes acycliques, avec une seule double liaison et aucun autre des groupes fonctionnels, forment un série homologue de des hydrocarbures à la formule générale C n H 2n.
L'alcène simple est l'éthylène (C 2 H 4), qui a la Union internationale de chimie pure et appliquée (UICPA) éthylène. Alcènes sont aussi appelés oléfines (un synonyme archaïque, largement utilisé dans le industrie pétrochimique). Les composés aromatiques sont souvent dessinés comme des alcènes cycliques, mais leur structure et les propriétés sont différentes et ne sont pas considérés comme des alcènes.
Structure
Collage

Comme seule des liaisons covalentes, des doubles liaisons peuvent être décrits en termes de chevauchement des orbitales atomiques, sauf que la différence d'une simple liaison (qui est constituée d'un seul liaison sigma), une double liaison carbone-carbone consiste en une liaison sigma et une pi obligataire. Cette double liaison est plus fort qu'un seul liaison covalente (611 kJ / mole de C = C par rapport à 347 kJ / mol pour C-C) et également plus court, avec une moyenne longueur de la liaison de 1,33 (133 Angstroms h).
Chaque carbone de la double liaison utilise ses trois sp² orbitales hybrides pour former des liaisons sigma à trois atomes de carbone. Les orbitales atomiques non hybridées 2p, qui se situent perpendiculairement au plan créé par les axes des trois orbitales sp² hybrides, se combinent pour former la liaison pi. Cette liaison se trouve en dehors de l'axe principal C-C, avec la moitié de la liaison d'un côté et de l'autre moitié.
Rotation autour de la double liaison carbone-carbone est limitée parce qu'elle implique la rupture du lien de pi, ce qui nécessite une grande quantité d'énergie (264 kJ / mol dans de l'éthylène). En conséquence, il peut exister des alcènes substitués comme l'un des deux isomères appelé isomère cis et un isomère trans, ou encore (pour alcènes plus complexes) un Z et un isomère E. Par exemple, dans cis but-2-ène deux substituants méthyle font face au même côté de la double liaison trans et en but-2-ène ils font face du côté opposé; Ces deux isomères sont légèrement différents dans leurs propriétés chimiques et physiques.
Il ne est certainement pas impossible de tordre une double liaison. En fait, une torsion de 90 ° nécessite une énergie approximativement égale à la moitié de la force d'un pi obligataire. Le désalignement de la orbitales p sont inférieurs aux prévisions en raison pyridalization a lieu (Voir: alcène pyramidale). trans -Cyclooctene est un alcène tendues stable et le désalignement orbitale est seulement 19 ° avec un dièdre de 137 ° (120 °) normales et un degré de pyramidalisation de 18 °. Ceci explique la instant dipôle de 0,8 D pour ce composé ( cis-isomère 0,4 D) où une valeur de zéro est attendu. L'isomère trans de cycloheptène ne est stable à basse température.
Forme
Comme prévu par la Modèle VSEPR des électrons paire de répulsion, le géométrie moléculaire d'alcènes comprend liaison sur chacun des angles de carbone dans une double liaison d'environ 120 °. L'angle peut varier en raison des souche stérique introduit par les interactions non liées créées par des groupes fonctionnels attachés à des atomes de carbone de la double liaison. Par exemple, l'angle de liaison de la CCC dans propylène est 123,9 °.
Propriétés physiques
Les propriétés physiques des alcènes sont comparables avec des alcanes . Le état physique dépend de la masse moléculaire (gaz d'éthylène en butène - liquides du pentène partir). Le plus simple des alcènes, d'éthylène , propylène et butylène sont des gaz. Alcènes linéaires d'environ cinq à seize atomes de carbone sont des liquides, et alcènes supérieurs sont solides cireux.
Propriétés chimiques
Les alcènes sont des composés relativement stables, mais sont plus réactifs que les alcanes en raison de la présence d'un pi-liaison carbone-carbone. La majorité des réactions des alcènes implique la rupture de cette liaison pi, formant nouvelle des liaisons simples.
Les alcènes servent de matière première pour la industrie pétrochimique, car ils peuvent participer à une grande variété de réactions.
réactions d'addition
Alcènes réagissent dans de nombreux réactions d'addition, qui se produisent en ouvrant le double liaison.
- Addition catalytique d'hydrogène : Catalytic hydrogénation d'alcènes correspondants produit les alcanes . La réaction est effectuée sous pression en présence d'un métal catalyseur . Catalyseurs industriels communs sont basés sur le platine , le nickel ou le palladium . Pour les synthèses de laboratoire, Nickel Raney est souvent employé. Il se agit d'un alliage de nickel et de l'aluminium . Un exemple de cette réaction est l'hydrogénation catalytique de l'éthylène pour produire de l'éthane :
- CH 2 = CH 2 + H 2 → CH 3 -CH 3
- Addition électrophile: La plupart des réactions d'addition à alcènes suivent le mécanisme de addition électrophile. Un exemple est le Réaction de Prins où l'électrophile est un groupe carbonyle.
- Halogénation: Ajout d'élémentaire de brome ou le chlore à alcènes rendements dibromo- et dichloroalcanes vicinal, respectivement. La décoloration d'une solution de brome dans l'eau est un essai analytique pour déterminer la présence d'alcènes:
- CH 2 = CH 2 + Br 2 → BrCH 2 CH 2 Br
- Il est également utilisé comme test quantitatif d'insaturation, exprimée en la indice de brome d'un composé unique ou un mélange. La réaction fonctionne parce que la forte densité d'électrons à la double liaison provoque un décalage temporaire des électrons dans la liaison Br-Br provoquant un dipôle induit temporaire. Cela rend le Br plus proche de la double liaison légèrement positif et donc un électrophile.
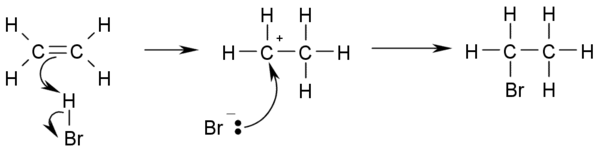
- Hydrohalogénation: Ajout de les acides halohydriques tels que HCl ou HBr à alcènes donne le correspondant haloalcanes.
- CH 3 -CH = CH 2 + HBr → Br CH 3 -CH 2 -CH - H
- Si les deux atomes de carbone à la double liaison sont reliés à un nombre différent d'atomes d'hydrogène, l'halogène se trouve de préférence au niveau du carbone avec moins de substituants hydrogène ( La règle de Markovnikov).
- Ce est le mécanisme de réaction pour hydrohalogénation:
-
- L'addition d'un carbène ou carbénoïde donne le correspondant cyclopropane.
Oxydation
Alcènes sont oxydé avec un grand nombre de agents oxydants.
- En présence d' oxygène , les alcènes brûler avec une flamme lumineuse pour produire du dioxyde de carbone et l'eau.
- Catalyseur d'oxydation avec de l'oxygène ou la réaction avec percarboxyliques acides rendements époxydes
- La réaction avec l'ozone dans ozonolyse conduit à la rupture de la double liaison, ce qui donne deux des aldéhydes ou des cétones
- R 1 -CH = CH-R + O 2 → 3 R 1 + R 2 -CHO -CHO + H 2 O
- Cette réaction peut être utilisée pour déterminer la position d'une double liaison dans un alcène inconnu.
- Sharpless et le bishydroxylation Cis-hydroxylation Woodward donner diols
Polymérisation
La polymérisation d'alcènes est une réaction qui donne une importance économique des polymères de valeur industrielle élevée, tels que les matières plastiques polyéthylène et polypropylene. Polymérisation peut soit procéder via un libre un mécanisme radicalaire ou ionique.
Synthèse
Méthodes industrielles
La synthèse industrielle la plus courante d'alcènes est basée sur fissuration du pétrole . Les grandes alcanes sont décomposés à des températures élevées, souvent en présence d'un catalyseur de zéolite, pour donner des alcènes et alcanes plus petites, et le mélange de produits est ensuite séparé par distillation fractionnée. Elle est principalement utilisée pour la fabrication de petits alcènes (jusqu'à six atomes de carbone).
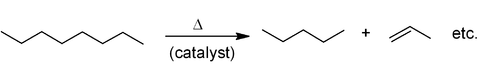
Est liée à ce catalytique déshydrogénation, où un alcane perd de l'hydrogène à des températures élevées pour produire un alcène correspondant. Ce est l'inverse de l' hydrogénation catalytique d'alcènes.
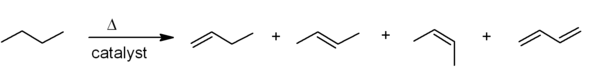
Ces deux processus sont endothermique, mais ils sont entraînés vers l'alcène à des températures élevées par entropie (la partie de l'équation TΔS AG = AH - TΔS domine pour la haute T).
Catalyseur de synthèse α-alcènes supérieurs (du type RCH = CH 2) peut également être obtenu par une réaction de l'éthylène avec composé organométallique triéthylaluminium en présence de nickel , cobalt ou le platine .
réactions d'élimination
L'un des principaux procédés de synthèse d'alcène en laboratoire est la élimination des halogénures d'alkyle, des alcools et des composés similaires. La plus commune est la -élimination par le mécanisme E2 ou E1, mais -éliminations sont également connus.
Le mécanisme E2 fournit une méthode d'élimination -plus fiable que E1 pour la plupart des synthèses d'alcènes. La plupart des éliminations E2 commencent avec un ester sulfonate ou un groupe alkyle à l'halogénure d'alkyle (tel qu'un tosylate ou triflate). Lorsque l'halogénure d'alkyle est utilisé, la réaction est appelée déshydrohalogénation. Pour les produits non symétriques les alcènes substitués plus (avec moins de ces atomes d'hydrogène attachés à la C = C) ont tendance à prédominer (voir La règle de Saytzeff). Un exemple typique est indiqué ci-dessous; noter que le H qui doit être anti laisse au groupe partant, même si cela conduit à l'isomère Z à peu près stable.

Alcènes peuvent être synthétisés à partir des alcools via la déshydratation, dans laquelle l'eau est perdue par cas le mécanisme E1. Par exemple, la déshydratation de l'éthanol produit éthène:
- CH 3 CH 2 OH + H 2 SO 4 → H 2 C = CH 2 H 3 O + + + HSO 4 -
Un alcool peut aussi être converti en un groupe mieux partant (par exemple, xanthate), de manière à permettre un syn -élimination plus doux tels que le Et l'élimination Chugaev Élimination Grieco. Réactions connexes comprennent éliminations par β-haloéthers (les Boord de synthèse oléfine) et les esters ( pyrolyse ester).
Alcènes peuvent être préparés indirectement de alkyle amines . L'amine ou l'ammoniac ne est pas un groupe partant convenable, de sorte que la première amine est soit alkyle (comme dans le Élimination de Hofmann) ou oxydée à un oxyde d'amine (le Réaction de Cope) pour rendre une élimination en douceur possible. Élimination de Hofmann est inhabituel en ce que le moins substitué (non Saytseff) alcène est généralement le produit principal. La réaction est la vie est un -élimination syn qui se produit au niveau ou en dessous de 150 ° C, par exemple:
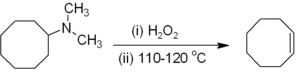
Alcènes sont générés à partir α-halo sulfones de la Réaction Ramberg-Bäcklund, via un sulfone de cycle à trois chaînons intermédiaires.
Synthèse de composés carbonylés
Une autre méthode importante pour la synthèse alcène comprend la construction d'un nouveau double liaison carbone-carbone par couplage d'un composé carbonyle (comme un aldéhyde ou cétone ) à un carbanion équivalent. Ces réactions sont parfois appelés olefinations. La plus connue de ces méthodes est la réaction de Wittig, mais d'autres méthodes connexes sont connus.
La réaction implique la réaction de Wittig d'un aldéhyde ou d'une cétone avec un Réactif de Wittig (ou phosphorane) du type Ph 3 P = CHR pour produire un alcène et Ph 3 P = O. Le réactif de Wittig est lui-même préparé facilement à partir de la triphénylphosphine et d'un halogénure d'alkyle. La réaction est très générale et beaucoup de groupes fonctionnels sont tolérés, voire des esters, comme dans cet exemple:
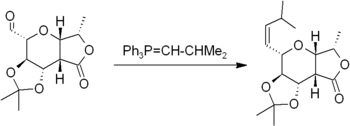
Liée à la réaction de Wittig est le Oléfination de Peterson. Celui-ci utilise un réactif à base de silicium moins accessible à la place du phosphorane, mais il permet la sélection de produits E ou Z. Si une E-produit est souhaitée, une autre alternative est le Oléfination de Julia, qui utilise le carbanion engendré à partir d'un phényle sulfone. Un composé du titane, Le réactif de Tebbe, est utile pour la synthèse de composés de méthylène; dans ce cas, même les esters et amides réagissent.
Une paire de composés carbonyle peut également être couplé de façon réductrice ensemble (avec réduction) pour générer un alcène. Alcènes symétriques peuvent être préparés à partir d'un couplage de l'aldéhyde ou de la cétone unique avec elle-même, en utilisant la réduction de métal Ti (la McMurry réaction). Si deux cétones sont différentes pour être couplé, un procédé indirect plus complexe tel que le Barton-réaction de Kellogg peut être utilisé.
Un seul cétone peut également être converti en l'alcène correspondant via son tosylhydrazone, en utilisant méthoxyde de sodium (le Réaction Bamford-Stevens) ou un alkyllithium (la Réaction Shapiro).
Métathèse d'oléfines
Les alcènes peuvent être préparés par échange avec d'autres alcènes, dans une réaction connue sous le nom métathèse d'oléfines. Fréquemment perte de gaz de l'éthylène est utilisé pour entraîner la réaction vers le produit souhaité. Dans de nombreux cas, on obtient un mélange d'isomères géométriques, mais la réaction tolère de nombreux groupes fonctionnels. Le procédé est particulièrement efficace pour la préparation d'alcènes cycliques, comme dans cette synthèse de muscone:

L'utilisation de réactions de couplage catalysées par le palladium
Réactions de couplage, notamment ceux catalysée par le palladium , les composés sont devenus populaires pour la synthèse des alcènes. Le Réaction de Heck fournit un procédé de couplage d'un halogénure d'aryle à un alcène, par exemple dans la synthèse du produit pharmaceutique naproxène:
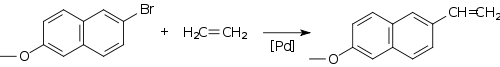
D'autres couplages, comme le Stille, Suzuki et Negishi implique la réaction d'un groupe alcényle, un groupe allyle ou un halogénure d'aryle (ou triflate) avec un groupe alcényle, un groupe alkyle (pas de Stille) ou un dérivé aryle d'un métal ou métalloïde. Par exemple, un couplage de Suzuki a été utilisé sur un dérivé citronellal pour la synthèse du capparatriene, un produit naturel qui est très active contre la leucémie:

De alcynes
Réduction de alcynes est une méthode utile pour la synthèse stereoselective d'alcènes disubstitués. Si l'alcène cis est désiré, hydrogénation en présence de Catalyseur de Lindlar est couramment utilisée, bien hydroboration suivie d'une hydrolyse fournit une approche alternative. Réduction de l'alcyne par sodium métallique dans un liquide ammoniac donne l'alcène trans.
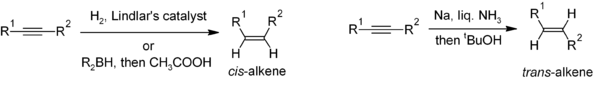
Pour la préparation multisubstitués alcènes, carbometalation d'alcynes peut donner lieu à une grande variété de dérivés d'alcènes.
Alcènes peuvent être synthétisés à partir d'autres alcènes par réactions de réarrangement. Outre métathèse d'oléfine (décrite ci-dessus ), un grand nombre de péricycliques réactions peuvent être utilisés tels que la et la réaction ène Cope.
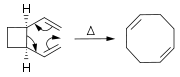
Dans le Réaction de Diels-Alder, un dérivé cyclohexène est préparé à partir d'un diène et d'un alcène réactif ou pauvre en électrons.
Nomenclature
UICPA noms
Pour former la racine des UICPA noms pour alcènes, il suffit de changer l'infixe -an- du parent -FR-. Par exemple, CH 3 CH 3 est l' alcane éthane. Le nom de CH 2 = CH 2 est donc éthène.
Dans alcènes supérieurs, où isomères qui diffèrent exister en position de la double liaison, le système de numérotation suivant est utilisé:
- Numéroter la plus longue chaîne de carbone qui contient la double liaison dans le sens qui donne les atomes de carbone de la double liaison les numéros les plus bas possibles.
- Indiquez l'emplacement de la double liaison par l'emplacement de son premier carbone
- Nom alcènes ramifiés ou substitués d'une manière similaire à alcanes .
- Nombre des atomes de carbone, et les groupes localiser nom substituants, localiser la double liaison, et le nom de la chaîne principale

La notation Cis-Trans
Dans le cas particulier d'alcènes disubstitués où les deux atomes de carbone ont un substituant chacune, Cis-trans notation peut être utilisée. Si les deux substituants sont sur le même côté de la liaison, il est défini comme (cis). Si les substituants sont de chaque côté de la liaison, il est défini comme (trans).

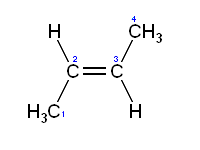
Le E, Z notation
Quand un alcène possède plus d'un substituant (en particulier nécessaire avec trois ou quatre substituants), la géométrie de la double liaison est décrite en utilisant les étiquettes E et Z. Ces étiquettes proviennent de la mots allemands "entgegen» qui signifie «face» et «zusammen" qui signifie "ensemble". Alcènes avec les groupes les plus prioritaires (tel que déterminé par Règles CIP) sur le même côté de la double liaison ont ces groupes ensemble et sont désignés Z. Alcènes avec les groupes les plus prioritaires sur les côtés opposés sont désignés E. Un moyen mnémotechnique pour se en souvenir: la notation Z a les groupes prioritaires plus élevés sur "ze zame zide".

Les groupes contenant C = C doubles liaisons
UICPA reconnaît deux noms pour les groupes d'hydrocarbures contenant du carbone-carbone doubles liaisons, les groupe vinyle et la un groupe allyle. .


