
Élément chimique
Contexte des écoles Wikipédia
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Une bonne façon d'aider d'autres enfants est de parrainer un enfant
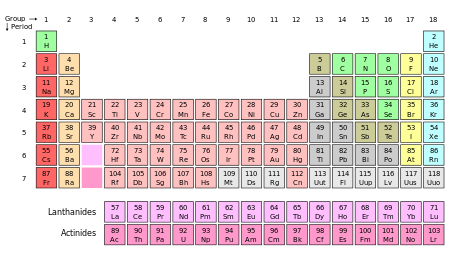
Un élément chimique, ou élément, est un type d' atome qui se distingue par son nombre atomique ; ce est, par le nombre de protons dans son noyau . Le terme est également utilisé pour faire référence à un produit chimique pur substance composée d'atomes ayant le même nombre de protons.
Des exemples courants d'éléments sont un atome d'hydrogène , carbone , azote et oxygène . Au total, 117 éléments ont été observés en 2007, dont 94 produisent naturellement sur Terre. Les éléments ayant un numéro atomique supérieur à 82 ( de bismuth et plus) sont intrinsèquement instables et subissent désintégration radioactive. Sur les 82 premiers éléments, 80 ont stables isotopes . Elements 43 et 61 ( technétium et promethium ) ne ont pas les isotopes stables, et la pourriture. Les éléments de 83 à numéro atomique 94 qui ne ont pas noyaux stables, sont néanmoins trouvés dans la nature, soit survivre comme des vestiges de la nucléosynthèse stellaire primordiale qui a produit les éléments dans le système solaire, ou encore comme produits comme fille-isotopes de courte durée nouveaux dans la décroissance naturelle de l'uranium et du thorium .
Tous matière chimique est constituée de ces éléments. Nouveaux éléments de numéro atomique supérieur sont découverts de temps à autre, comme des produits de artificielle réactions nucléaires.
Histoire
Le terme «éléments» (stoicheia) a été d'abord utilisé par le philosophe grec Platon dans environ 360 BCE, dans son dialogue Timée, qui comprend une analyse de la composition des organes inorganiques et organiques et est un traité rudimentaire sur la chimie. Platon suppose que la particule de minute de chaque élément correspond à l'un des polyèdres réguliers: tétraèdre (le feu), l'octaèdre (air), icosaèdre (eau), et cube (la terre).
 | 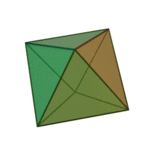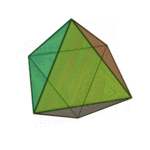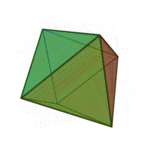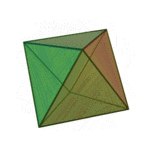 | 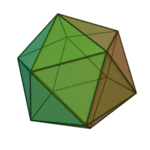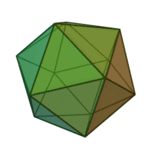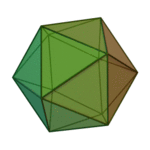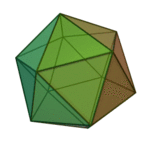 | 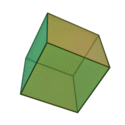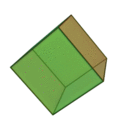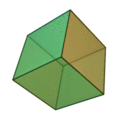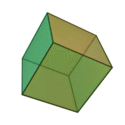 | |
| Tétraèdre (feu) | Octaèdre (air) | Icosaèdre (eau) | Cube (terre) |
Ajoutant à la quatre éléments du philosophe grec Empédocle, dans environ 350 avant JC, Aristote a également utilisé le terme «élément» et conçu cinquième élément appelé " quintessence ", qui a formé les cieux Aristote défini comme un élément.:
Element - un de ces organismes dans lesquels d'autres organismes peuvent être décomposées et qui même ne est pas capable d'être divisé en d'autres.
Se appuyant sur cette théorie, en c. 790 chimiste Arabian Jabir ibn Hayyan-( Geber) postule que les métaux ont été formées à partir de deux éléments: le soufre, "la pierre qui brûle», qui caractérise le principe de la combustibilité, et le mercure, qui contenait le principe idéalisée de propriétés métalliques. Peu de temps après, les choses ont évolué dans le concept arabe des trois principes: le soufre donnant inflammabilité ou de la combustion, le mercure donnant la volatilité et de la stabilité, et le sel donnant solidité.
En 1524, le chimiste suisse Paracelse a adopté quatre Théorie de l'élément d'Aristote, mais a estimé que ils sont apparus dans les organes que trois principes de Geber. Paracelse a vu ces principes aussi fondamentaux et les justifiait par le recours à la description de la façon dont le bois brûle dans le feu. Le mercure compris le principe cohésif, de sorte que lorsqu'il a quitté la fumée du bois se est effondré. Tabac représenté la volatilité (le principe de mercure), les flammes à la chaleur donnant représentés inflammabilité (soufre), et la cendre reste représentés solidité (sel).
En 1669, le médecin et chimiste allemand Johann Becher a publié son Physica Subterranea. Dans la modification sur les idées de Paracelse, il a soutenu que les constituants du corps sont l'air, l'eau et trois types de terre: terre fluida, l'élément mercurial, qui contribue fluidité et la volatilité; terra lapida, l'élément de solidification, qui produit la fusibilité ou la qualité de liaison; et terra pinguis, l'élément gras, qui donne la substance matérielle de ses qualités huileux et combustibles. Ces trois terres correspondent aux trois principes de Geber. Un morceau de bois, par exemple, selon la Becher, est composé de cendres et terra pinguis; lorsque le bois est brûlé, le pinguis terra est libéré, laissant les cendres. En d'autres termes, dans la combustion de la terre gras brûle.
En 1661, Robert Boyle a montré qu'il y avait plus que quatre éléments classiques que les anciens avaient supposé. La première liste moderne des éléments chimiques a été donné dans Antoine Lavoisier de 1789 éléments de chimie, qui contenait trente-trois éléments, y compris la lumière et calorique. En 1818, Jöns Jakob Berzelius avait déterminé poids atomiques pendant quarante-cinq des éléments acceptées quarante-neuf. Dmitri Mendeleïev avait soixante-six éléments dans son tableau périodique de 1869, illustré ci-dessous.

De Boyle jusqu'au début du 20e siècle, un élément a été défini comme un pur substance qui ne peut être décomposé en une substance plus simple. Autrement dit, un élément chimique ne peut pas être transformée en d'autres éléments chimiques par chimiques processus. En 1913, Henry Moseley a découvert que la base physique du numéro atomique de l'atome était sa charge nucléaire, qui a finalement conduit à la définition actuelle. La définition actuelle permet également d'éviter certaines ambiguïtés dues aux isotopes et allotropes .
En 1919, il y avait soixante-douze éléments connus. En 1955, l'élément 101 a été découvert et nommé mendelevium en l'honneur de Mendeleïev, le premier à disposer les éléments d'une manière périodique. En Octobre 2006, la synthèse de l'élément 118 a été signalé; cependant, l'élément 117 n'a pas encore été créé dans le laboratoire.
Description
Les éléments les plus légers sont l'hydrogène et de l'hélium , à la fois créé par Big Bang lors de la nucléosynthèse 20 premières minutes de l'univers dans un rapport d'environ 3: 1 en poids (environ 12: 1 en nombre d'atomes). Presque tous les autres éléments trouvés dans la nature, y compris un certain laps hydrogène et d'hélium créé depuis lors, ont été faites par divers (fois) naturels ou à des méthodes artificielles de nucléosynthèse, y compris parfois par des activités telles que la fission nucléaire .
En 2006, il ya 117 éléments connus (dans ce contexte, "connu" moyennes observées assez bien, même de quelques produits de désintégration, avoir été différenciée de tout autre élément). Parmi ces 117 éléments, 94 produisent naturellement sur Terre. Six d'entre eux se produisent en quantités infimes extrêmes: technétium , numéro atomique 43; promethium , numéro 61; astatine , numéro 85; francium , le numéro 87; le neptunium , le numéro 93; et le plutonium , le numéro 94. Ces 94 éléments, et aussi peut-être l'élément 98 californium , ont été détectés dans l'univers dans son ensemble, dans les spectres des étoiles et aussi supernovae, où des éléments radioactifs à vie courte ont été récemment réalisés.
Les 22 éléments restants introuvable sur Terre ou dans les spectres astronomiques ont été obtenus artificiellement. Tous les éléments qui proviennent exclusivement par des moyens artificiels sont radioactifs très courts demi-vie ; si des atomes de ces éléments étaient présents à la formation de la Terre, ils sont extrêmement susceptibles d'avoir déjà cariées, et si présente dans les novae, sont en quantité trop faible pour ont été notés. technétium était le premier élément prétendument non naturelle à synthétiser, en 1937, bien que des quantités infimes de technétium ont depuis été trouvés dans la nature, et l'élément peut avoir été découvert naturellement en 1925. Ce modèle de production artificielle et de découverte naturelle tard a été répété avec plusieurs autres éléments naturels radioactifs de traces .
Listes des éléments par nom , par le symbole, par numéro atomique, par densité, par le point de fusion, et par point d'ébullition ainsi que énergies d'ionisation des éléments sont disponibles. La présentation la plus commode des éléments se trouve dans le tableau périodique , les groupes d'éléments ayant des propriétés chimiques semblables.
Numéro atomique
Le nombre atomique d'un élément, Z, est égal au nombre de protons qui définit l'élément. Par exemple, tous carbone atomes contiennent six protons dans leur noyau ; de sorte que le nombre atomique "Z" de carbone est 6. Les atomes de carbone peuvent avoir différents nombres de neutrons, qui sont connus comme des isotopes de l'élément.
Le nombre de protons dans le noyau atomique détermine également la charge électrique , qui à son tour détermine les électrons de l'atome dans son état non ionisé. Ceci à son tour (au moyen de la Principe d'exclusion de Pauli) détermine l'atome de diverses propriétés chimiques. Donc, tous les atomes de carbone, par exemple, avoir en fin de compte des propriétés chimiques identiques parce qu'ils ont tous le même nombre de protons dans leur noyau, et ont donc le même numéro atomique. Ce est pour cette raison que le nombre atomique plutôt que nombre de masse (ou poids atomique) est considérée comme la caractéristique d'identification d'un élément.
Masse atomique
Le Numéro de la masse d'un élément, A, est le nombre de nucléons (protons et neutrons) dans le noyau atomique. Différents isotopes d'un élément donné se distinguent par leurs nombres de masse, qui sont classiquement écrit comme un super-index sur le côté gauche du symbole atomique (par exemple, 238 U).
Le masse atomique relative d'un élément est la moyenne des masses atomiques de tous les isotopes de l'élément chimique que l'on trouve dans un environnement particulier, pondérée par l'abondance isotopique, par rapport à la l'unité de masse atomique (u). Ce nombre peut être une fraction qui ne est pas proche d'un nombre entier, en raison du processus de calcul de moyenne. D'autre part, la masse atomique de l'isotope pur est assez proche de son nombre de masse. Alors que le nombre de masse est un nombre naturel (ou entier), la masse atomique d'un seul isotope est un nombre réel qui est proche d'un nombre naturel. En général, il diffère légèrement du nombre de masse que la masse des protons et des neutrons ne est pas exactement une u, les électrons contribuent légèrement à la masse atomique, et en raison de la énergie de liaison nucléaire. Par exemple, la masse de 19 F est 18,9984032 u. La seule exception à la masse atomique de l'isotope ne étant pas un nombre entier naturel est de 12 C, qui a une masse de 12 exactement, du fait de la définition de u (il est fixé en tant que 1 / 12e de la masse de connexion une liaison carbone-12 atome, exactement).
Isotopes
Les isotopes sont des atomes d'un même élément (ce est, avec le même nombre de protons dans leur noyau atomique), mais ayant un nombre différent de neutrons . La plupart (66 sur 94) naturellement éléments présents ont plus d'un isotope stable. Ainsi, par exemple, il ya trois principaux isotopes de carbone . Tous les atomes de carbone avoir six protons dans le noyau, mais ils peuvent avoir soit 6, 7, ou 8 neutrons. Étant donné que les nombres de masse de ceux-ci sont 12, 13 et 14 respectivement, les trois isotopes de carbone sont connues en tant que liaison carbone-carbone 13 14 carbone-12, et, souvent abrégés à 12 C, 13 C et 14 C. Carbone dans la vie quotidienne et dans la chimie est un mélange de 12 C, 13 C et 14 atomes de carbone.
Les trois isotopes de carbone ont les mêmes propriétés chimiques. Mais ils ont des propriétés nucléaires. Dans cet exemple, le carbone-12 et le carbone-13 sont des atomes stables, mais carbone-14 est instable; il est légèrement radioactifs, en décomposition au fil du temps dans d'autres éléments.
Comme le carbone, certains isotopes de divers éléments sont radioactifs et se désintègrent en d'autres éléments sur rayonnant d'une particule alpha ou bêta. Pour certains éléments, tous les isotopes sont des isotopes radioactifs en particulier: les éléments sans aucune isotopes stables sont technétium (numéro atomique 43), le prométhium (numéro atomique 61) et tous les éléments observés avec un numéro atomique supérieur à 82.
Sur les 80 éléments avec un isotope stable, 16 ne ont qu'un seul isotope stable, et le nombre moyen d'isotopes stables pour les 80 éléments stables est 3,4 isotopes stables par élément. Le plus grand nombre d'isotopes stables qui se produisent pour un élément est de 10 (pour l'étain, élément 50).
Allotropes
Certains éléments peuvent être trouvés en tant que substances élémentaires multiples, connues sous le nom allotropes , qui diffèrent dans leur structure et les propriétés. Par exemple, le carbone peut être trouvé en tant que diamant , qui a une structure tétraédrique autour de chaque atome de carbone; graphite, qui a des couches d'atomes de carbone de structure hexagonale, et fullerènes, qui ont des formes presque sphériques. La possibilité pour un élément d'exister dans une des nombreuses formes structurelles est connu comme 'allotropie'.
État standard
Le état standard, ou de l'état de référence, d'un élément est définie comme son état thermodynamique plus stable à 1 bar à une température donnée (typiquement à 298,15 K). En thermochimie, un élément est défini pour avoir un enthalpie de formation de zéro dans son état standard. Par exemple, l'état de référence pour le carbone est du graphite, car il est plus stable que les autres allotropes.
Nomenclature
La désignation des éléments précède la théorie atomique de la matière, même si au moment où il ne était pas connu quels produits chimiques sont des éléments et qui aggrave. Quand il a appris, les noms existants (par exemple, l'or, le mercure, fer) ont été maintenus dans la plupart des pays, et les différences nationales ont émergé sur les noms des éléments soit pour plus de commodité, les subtilités linguistiques, ou le nationalisme. Par exemple, les Allemands utilisent "Wasserstoff" pour "hydrogène" et "Sauerstoff" pour "l'oxygène", tandis que l'anglais et certains langues romanes utilisent "sodium" pour "natrium" et "potassium" pour "kalium", et les Français, les Grecs et les Polonais préfèrent "azote / Azot" pour "azote".
Mais pour le commerce international, le noms officiels des éléments chimiques à la fois anciens et récents sont décidées par le Union internationale de chimie pure et appliquée, qui a décidé sur une sorte de langage international anglais. Cette organisation a récemment prescrit que "aluminium" et "césium" prennent la place de l'orthographe «aluminium» États-Unis et "césium", tandis que le "soufre" US prend la place du "soufre" britannique. Mais les produits chimiques qui sont praticables à être vendus en vrac au sein de nombreux pays, cependant, ont encore des noms nationaux et ceux qui ne utilisent pas l' alphabet latin ne peut se attendre à utiliser le nom IUPAC. Selon IUPAC, le nom complet d'un élément ne est pas capitalisé, même se il est issu d'un nom propre comme éléments californium ou einsteinium (sauf se il serait capitalisé par un autre règle). Isotopes des éléments chimiques sont également en minuscule si elle était écrite sur: carbone-12 ou uranium-235.
Dans la seconde moitié du XXe laboratoires de physique de siècle est devenu capable de produire des noyaux des éléments chimiques qui ont une demi-vie trop courte pour eux de rester en quantités appréciables. Ceux-ci sont également nommés par l'IUPAC, qui adopte généralement le nom choisi par le découvreur. Cela peut conduire à la question controversée de quel groupe de recherche effectivement découvert un élément, une question qui a retardé la désignation des éléments de numéro atomique de 104 et plus élevé pour un temps considérable. (Voir élément nommer controverse).
Les précurseurs de ces controverses impliqués les dénominations nationalistes d'éléments à la fin du XIXe siècle. Par exemple, le lutétium a été nommé en référence à Paris, France. Les Allemands étaient réticents à renoncer droits de dénomination à la française, souvent appeler cassiopeium. Le découvreur britannique de niobium initialement nommé il niobium, en référence à la Nouveau Monde. Il a été largement utilisé comme tel par les publications américaines antérieures à la normalisation internationale.
Symboles chimiques
Éléments chimiques spécifiques
Avant la chimie est devenue une science, alchimistes avaient conçu symboles ésotériques pour les métaux et composés communs. Ces ont toutefois été utilisés comme des abréviations dans les diagrammes ou des procédures; il n'y avait pas de concept d'atomes se combinent pour former des molécules. Avec ses avancées dans la théorie atomique de la matière, John Dalton a conçu ses propres symboles simples, basées sur des cercles, qui devaient être utilisés pour décrire des molécules.
Le système actuel de notation chimique a été inventé par Berzelius. Dans ce système typographique symboles chimiques ne sont pas utilisés comme de simples abréviations - si chacun se compose de lettres de l' alphabet latin - ce sont des symboles destinés à être utilisés par les peuples de toutes les langues et alphabets. Le premier de ces symboles étaient destinés à être pleinement universelle; depuis latin était la langue commune de la science à cette époque, ils étaient basés sur les abréviations latines noms des métaux - Fe vient de Ferrum, Ag de Argentum. Les symboles ne ont pas été suivies d'une période (point) comme des abréviations étaient. Plus tard, les éléments chimiques ont également été attribuées symboles chimiques uniques, sur la base du nom de l'élément, mais pas nécessairement en anglais. Par exemple, le sodium a le symbole chimique «Na» après le natrium latine. La même chose se applique à "W" (wolfram) pour le tungstène , «Hg» (hydrargyrum) pour le mercure , "K" (kalium) pour le potassium , "Au" (Aurum) pour l'or , "Pb" (plumbum) pour le plomb , et «Sb» (stibium) pour l'antimoine .
Symboles chimiques sont compris à l'échelle internationale lorsque les noms d'éléments peuvent avoir besoin d'être traduit. Il ya parfois des différences; par exemple, les Allemands ont utilisé «J» au lieu de «je» pour l'iode, de sorte que le caractère ne serait pas être confondu avec un chiffre romain .
La première lettre d'un symbole chimique est toujours en majuscules, comme dans les exemples précédents, et les lettres suivantes, le cas échéant, sont toujours minuscules (petites lettres).
Symboles généraux chimiques
Il ya aussi des symboles pour les séries d'éléments chimiques, pour les formules comparatifs. Ce sont une lettre majuscule en longueur, et les lettres sont réservés afin qu'ils ne sont pas autorisés à donner les noms des éléments spécifiques. Par exemple, un «X» est utilisé pour indiquer un groupe de variables parmi une classe de composés (mais le plus souvent un atome d'halogène ), tandis que "R" est utilisé pour une radical, signifiant une structure composite telle qu'une chaîne hydrocarbonée. La lettre "Q" est réservé pour des "chaleur" dans une réaction chimique. "Y" est également souvent utilisé comme un symbole chimique générale, mais il est aussi le symbole de l'yttrium . "Z" est aussi fréquemment utilisé comme groupe de variables général. "L" est utilisé pour représenter un générale ligand en chimie inorganique et organométallique. "M" est également souvent utilisé à la place d'un métal général.
symboles isotopiques
Les trois principaux isotopes de l'élément hydrogène sont souvent écrites comme pour protium H, D pour deutérium et T pour tritium. Ce est dans le but de le rendre plus facile de les utiliser dans les équations chimiques, car il remplace le besoin d'écrire le nombre de masse pour chaque atome. Il est écrit comme ceci:
D 2 O ( eau lourde)
Au lieu d'écrire comme ceci:
²H 2 O
Abondance
Durant les premières phases de la Big Bang , nucleosynthesis de noyaux d'hydrogène conduit à la production d'hydrogène et d'hélium isotopes, ainsi que des quantités très minuscules (de l'ordre de 10 -10) de lithium et le béryllium. Il est l'argument de savoir si ou non certains de bore a été produit dans le Big Bang, comme cela a été observé dans certains très jeunes étoiles, mais aucun des éléments plus lourds que le bore ont été produites. En conséquence, l'abondance primordial d'atomes est composée d'environ 75% 1 H, 25% 4 He, et 0,01% deutérium. Enrichissement ultérieur de halos galactiques se sont produites en raison de Nucléosynthèse stellaire et Nucléosynthèse Supernova. Cependant l'espace intergalactique peut encore ressembler étroitement à l'abondance primordiale, sauf si elle a été enrichie par certains moyens.
Le tableau suivant montre les dix éléments les plus communs dans notre galaxie (estimée par spectroscopie), tel que mesuré en parties par million, en masse. Galaxies proches qui ont évolué dans le même sens ont un enrichissement correspondant d'éléments plus lourds que l'hydrogène et l'hélium. Les galaxies les plus éloignées sont considérés comme ils sont apparus dans le passé, de sorte que leurs abondances d'éléments semblent plus proches au mélange primordiale. Comme les lois et les processus physiques apparaissent dans toute la commune univers visible , cependant, il est prévu que ces galaxies seront également ont évolué abondances d'éléments similaires.
| Élément | Parties par million en masse |
|---|---|
| Hydrogène | 739000 |
| Hélium | 240000 |
| Oxygène | 10700 |
| Carbone | 4600 |
| Néon | 1340 |
| Fer | 1090 |
| Azote | 970 |
| Silicium | 650 |
| Magnésium | 580 |
| Soufre | 440 |
Récemment découvert éléments
La première élément de transuraniens (élément avec le numéro atomique supérieur à 92) a découvert était le neptunium en 1940. L'élément le plus lourd qui a été trouvée à ce jour est l'élément 118, ununoctium , qui a été synthétisé avec succès le 9 Octobre 2006, par le Flerov Laboratoire de réactions nucléaires dans Dubna, en Russie .
Element 117, Ununseptium, n'a pas encore été créé ou découvert, bien que sa place dans le tableau périodique est préétabli, et de même pour les éléments possibles au-delà de 118.

