
Distillation
Renseignements généraux
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . Une bonne façon d'aider d'autres enfants est de parrainer un enfant

La distillation est un procédé de séparation substances chimiques en fonction des différences dans leur volatilités dans un mélange liquide en ebullition. Distillation fait habituellement partie d'un processus chimique plus grande, et est donc considéré comme un fonctionnement de l'unité.
Commercialement, la distillation a un certain nombre d'utilisations. Il est utilisé pour séparer le pétrole brut en plusieurs fractions pour des usages spécifiques tels que le transport , la production d'électricité et le chauffage. De l'eau est distillé pour éliminer les impuretés, comme le sel de l'eau de mer. L'air est distillé pour séparer ses composantes - notamment l'oxygène , l'azote et l'argon - pour une utilisation industrielle. La distillation du fermentés solutions a été utilisé depuis l'antiquité pour produire les boissons distillées avec une forte teneur en alcool.
Histoire
Les premières formes de distillation ont été connus pour babyloniens alchimistes en Mésopotamie (dans ce qui est aujourd'hui l'Irak ) depuis au moins le 2e millénaire av. La distillation a été plus tard connu pour grecs alchimistes du 1er siècle après JC, et le développement ultérieur d'un appareil de distillation à grande échelle a eu lieu en réponse aux demandes pour les spiritueux. Hypathia d'Alexandrie est crédité d'avoir inventé un appareil de distillation début, et la première description exacte de l'appareil pour la distillation est donnée par Zosime d' Alexandrie au IVe siècle.

Au 8ème siècle, les alchimistes du Moyen-Orient produites processus de distillation pour purifier substances chimiques pour l'industrie des fins telles que l'isolement naturel les esters ( parfums) et produisant pur alcool . Le premier d'entre eux était le persan Jabir ibn Hayyan (Geber) vers 800 AD, qui est crédité de l'invention de nombreux appareils et les processus qui sont encore en usage aujourd'hui chimique. En particulier, son alambic a été le premier toujours avec autoclaves qui pourrait purifier complètement les produits chimiques, un précurseur de la alambic, et sa conception a servi d'inspiration pour appareils modernes de distillation à micro-échelle comme la tête de distillation Hickman. Petroleum a été distillé par un autre Persique , al-Razi (Rhazes) au 9ème siècle, pour la production kérosène, tandis que distillation à la vapeur a été inventé par Avicenne au début du 11ème siècle, pour la production d' huiles essentielles . Comme l'alchimie a évolué dans la science de la chimie , des navires appelés cornues se sont utilisés pour les distillations. Les deux alambics et cornues sont des formes de verrerie avec de longs cous pointant vers le côté à un angle vers le bas, qui ont agi comme l'air refroidi- condenseurs à condenser le distillat et la faire couler vers le bas pour la collecte.
Plus tard, des alambics de cuivre ont été inventés. Joints rivetés ont souvent été maintenues serrées en utilisant différents mélanges, par exemple une pâte à base de farine de seigle. Ces alambics souvent en vedette un système de refroidissement à travers le bec, en utilisant l'eau froide par exemple, qui a fait la condensation de l'alcool plus efficace. Ils ont été appelés alambics.
Aujourd'hui, les cornues et alambics ont été largement supplanté par des méthodes de distillation plus efficaces dans la plupart des procédés industriels. Cependant, l'alambic est encore largement utilisé pour l'élaboration de certains alcools fins tels que cognac, Scotch whisky et certains vodkas. Les alambics faites de divers matériaux (bois, argile, l'acier inoxydable) sont également utilisés par bootleggers dans divers pays. Alambics petits pots sont également vendus pour la production domestique de l'eau de fleur ou huiles essentielles .
Applications de la distillation
L'application de la distillation peut être divisée en quatre groupes: l'échelle du laboratoire , distillation industrielle , distillation d'herbes médicinales et de parfumerie ( Hydrolat) et la transformation des aliments . Les deux derniers sont distincts des deux précédentes, en ce que la distillation ne est pas utilisé comme une méthode de purification vrai, mais plus de transférer la totalité volatiles des matières de source pour le distillat.
La principale différence entre la distillation de l'échelle du laboratoire et la distillation industrielle est que la distillation de l'échelle du laboratoire est souvent effectuée en discontinu, alors que la distillation industrielle se produit souvent en continu. En distillation en discontinu, la composition de la matière d'origine, les vapeurs des composés de distillation et le distillat changement pendant la distillation. Dans la distillation discontinue, un reste est chargé (fourni) avec un lot de mélange d'alimentation, qui est ensuite séparé en ses fractions constitutives qui sont collectés séquentiellement à partir de la plus volatile à moins volatil, avec les fonds (restante de la fraction moins ou non volatiles) retirées à la fin. Le reste peut alors être rechargé et le processus est répété.
En distillation continue, les matières de source, des vapeurs et de distillat sont maintenus à une composition constante en reconstituant avec soin la matière d'origine et l'élimination des fractions à la fois de vapeur et de liquide dans le système. Il en résulte un meilleur contrôle du procédé de séparation.
Modèle idéalisé de distillation
Le point d'ébullition d'un liquide est la température à laquelle la la pression de vapeur du liquide est égale à la pression entourant le liquide. Le point d'ébullition normal d'un liquide est le cas particulier où la pression de vapeur du liquide est égale à la température ambiante pression atmosphérique. Un liquide dans un récipient à une pression inférieure à la pression atmosphérique va bouillir à la température inférieure au point d'ébullition normal, et un liquide dans un récipient à une pression supérieure à la pression atmosphérique va bouillir à une température supérieure au point d'ébullition normal. En d'autres termes, tous les liquides ont un nombre infini de points d'ébullition.
Ce est une idée fausse commune que dans un mélange liquide à une pression donnée, chaque composant revient au point d'ébullition correspondant à la pression donnée et les vapeurs de chaque composant séparément permettra de recueillir et purement. Ceci, cependant, ne se produit pas, même dans un système idéalisé. Modèles idéalisés de la distillation sont essentiellement régies par La loi de Raoult et La loi de Dalton.
La loi de Raoult suppose qu'un élément contribue au total la pression de vapeur du mélange en fonction de sa proportion du mélange et de sa pression de vapeur à l'état pur. Si l'on modifie le composant pression de vapeur d'un autre composant, ou si la volatilité d'un composant dépend de son pourcentage dans le mélange, la loi échouera.
La loi de Dalton indique que la pression de vapeur totale est la somme des pressions de vapeur de chaque composant dans le mélange. Quand un liquide multi-composant est chauffé, la pression de vapeur de chaque composant va augmenter, provoquant ainsi la pression de vapeur totale d'augmenter. Lorsque la pression de vapeur totale atteint la pression entourant le liquide, ébullition se produit et le liquide se transforme en gaz dans toute la masse du liquide. Notez qu'un mélange a donné un point à une pression donnée d'ébullition, lorsque les composants sont mutuellement solubles.
Le modèle idéalisé est exacte dans le cas des liquides chimiquement similaires, tels que le benzène et le toluène . Dans d'autres cas, les écarts graves de la loi de Raoult et la loi de Dalton sont observés, le plus connu dans le mélange d' éthanol et d'eau. Ces composés, lorsqu'ils sont chauffés ensemble, forment un azéotrope, dans lequel la température d'ébullition du mélange est inférieure à la température d'ébullition de chaque liquide distinct. Pratiquement tous les liquides, lorsqu'il est mélangé et chauffé, affichent un comportement azéotropique. Bien qu'il existe des méthodes de calcul pouvant être utilisés pour estimer le comportement d'un mélange de composants arbitraires, la seule façon d'obtenir exacte les données d'équilibre vapeur-liquide est en mesure.
Il ne est pas possible de purifier complètement un mélange de composants par distillation, car cela exigerait chaque composant dans le mélange pour avoir un zéro pression partielle. Si les produits ultra-purs sont le but, puis encore séparation chimique doit être appliqué.
Batch distillation
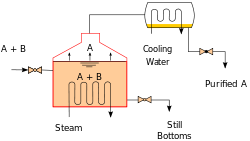
Le chauffage d'un mélange idéal de deux substances volatiles A et B (avec A ayant la plus grande volatilité, ou de point d'ébullition inférieur) dans une installation de distillation par lots (par exemple dans un appareil représenté sur la figure d'ouverture) jusqu'à ce que le mélange est en ébullition se traduit par une vapeur au-dessus du liquide qui contient un mélange de A et B. Le rapport entre A et B dans la vapeur sera différent du rapport dans le liquide: le rapport dans le liquide sera déterminé par la façon dont le mélange initial a été préparé, tandis que le rapport dans la vapeur sera enrichi en composé plus volatil, A (en raison de la loi de Raoult, voir ci-dessus). La vapeur passe par le condenseur et est retiré du système. Cela signifie que le rapport des composés dans le liquide restant est maintenant différent du rapport initial (ce est à dire plus riche en B que le liquide de départ).
Le résultat est que le rapport dans le mélange liquide se transforme, devenant plus riche en composant B. Cela provoque le point d'ébullition du mélange se élever, ce qui entraîne à son tour une augmentation de la température dans la vapeur, ce qui entraîne un changement de rapport de A: B dans la phase gazeuse (que la distillation se poursuit, il se agit d'une proportion croissante de B dans la phase gazeuse). Il en résulte un rapport de changement lentement A: B dans le distillat.
Si la différence de pression de vapeur entre les deux composants A et B est grande (généralement exprimé comme étant la différence des points d'ébullition), le mélange au début de la distillation est fortement enrichie en le composant A, et où le composant A est éliminé par distillation, le liquide en ébullition est enrichi dans le composant B.
La distillation en continu
Distillation continue est une distillation continue dans lequel un mélange liquide est continu (sans interruption) introduits dans le processus et les fractions séparées sont retirées en continu sous forme de flux de sortie comme le temps passe pendant l'opération. La distillation en continu produit au moins deux fractions de sortie, dont au moins une fraction de distillât volatil, qui a été capturé et bouilli séparément sous forme de vapeur condensée en un liquide. Il existe toujours une fraction fond (ou résidu), qui est le résidu moins volatil qui n'a pas été capturée séparément sous forme de vapeur condensée.
Améliorations générales
Les deux lots et en continu distillations peuvent être améliorées par l'utilisation d'un colonne de fractionnement au-dessus du ballon de distillation. La colonne améliore la séparation en fournissant une plus grande surface pour la vapeur et le condensat à entrer en contact. Cela lui permet de rester à l'équilibre pour aussi longtemps que possible. La colonne peut même consister en petites sous-systèmes («plateaux» ou de «plats») qui contiennent tous un, point d'ébullition du mélange liquide enrichi, toutes avec leur propre équilibre vapeur-liquide.
Il existe des différences entre l'échelle du laboratoire et de colonnes de fractionnement à l'échelle industrielle, mais les principes sont les mêmes. Exemples de colonnes de fractionnement à l'échelle laboratoire (en augmentant l'efficacité) comprennent:
- Condenseur Air
- Colonne de Vigreux (généralement l'échelle du laboratoire seulement)
- Paniers colonne (garnie de perles de verre, des pièces métalliques ou autre matériau chimiquement inerte)
- Spinning système de distillation de bande
Laboratoire distillation échelle
Laboratoire distillations d'échelle sont presque exclusivement gérées comme distillations de lots. Le dispositif utilisé dans la distillation, parfois appelée encore, se compose au minimum d'un rebouilleur ou un pot dans lequel le matériau source est chauffée, d'un condenseur dans lequel le chauffage de la vapeur est refroidie au liquide état , et un récepteur dans lequel le liquide concentré ou purifié, appelé le distillat, est recueillis. Plusieurs techniques de l'échelle du laboratoire pour la distillation existe (voir aussi types de distillation).
Distillation simple
En simple distillation, toutes les vapeurs chaudes produites sont immédiatement intégrées dans un condenseur qui refroidit et se condense les vapeurs. Par conséquent, le distillât sera pas pur - sa composition sera identique à la composition des vapeurs à la température et une pression données, et peut être calculée à partir de La loi de Raoult.
En conséquence, simple distillation est habituellement utilisé uniquement aux liquides distincts dont les points d'ébullition très différents (règle de base est de 25 ° C), ou pour séparer les liquides des solides ou des huiles non volatile. Dans ces cas, les pressions de vapeur des composants sont généralement suffisamment différents pour que la loi de Raoult peut être négligé en raison de la contribution insignifiante du composant moins volatil. Dans ce cas, le distillat peut être suffisamment pure pour son utilisation prévue.
Distillation fractionnée
Pour de nombreux cas, les points des composants dans le mélange à point d'ébullition seront suffisamment proches pour que la loi de Raoult doit être prise en considération. Par conséquent, la distillation fractionnée doit être utilisé afin de séparer les composants bien par des cycles répétés vaporisation-condensation dans une colonne de fractionnement à garnissage.
Comme la solution à purifier est chauffée, les vapeurs montent à la colonne de fractionnement. Comme il se élève, il se refroidit, la condensation sur les parois du condenseur et les surfaces du matériau d'emballage. Ici, le produit de condensation continue d'être chauffé par les vapeurs chauds ascendants; il se vaporise une fois de plus. Cependant, la composition des vapeurs frais sont déterminés de nouveau par la loi de Raoult. Chaque cycle évaporation-condensation (appelé plateau théorique) donnera une solution plus pur de la composante plus volatile. En réalité, chaque cycle à une température donnée ne se produit pas exactement à la même position dans la colonne de fractionnement; plateau théorique est donc un concept plutôt qu'une description précise.
Plus de plateaux théoriques conduisent à de meilleures séparations. Un filature système de distillation bande utilise une bande de filature Téflon ou en métal pour forcer les vapeurs ascendantes en contact étroit avec le condensat descendant, l'augmentation du nombre de plateaux théoriques.
Distillation à la vapeur
Comme distillation sous vide, distillation à la vapeur est un procédé de distillation des composés qui sont sensibles à la chaleur. Ce procédé implique l'utilisation de vapeur barbotage d'un mélange chauffé de la matière première. Par la loi de Raoult, une partie du composé cible se vaporise (en conformité avec sa pression partielle). Le mélange de vapeurs est refroidi et condensé, ce qui donne généralement une couche d'huile et une couche d'eau.
Distillation à la vapeur de divers herbes aromatiques et de fleurs peuvent donner lieu à deux produits; une huile essentielle ainsi que d'un liquide Hydrolat. Les huiles essentielles sont souvent utilisés en parfumerie et aromathérapie tandis que les distillats larmoyants ont de nombreuses applications dans aromathérapie, la transformation des aliments et soins de la peau.


1: Agitateur bar / des billes antiprojection 2: Toujours pot 3: colonne de fractionnement 4: Thermomètre température / point d'ébullition 5: Téflon robinet 1 6: froid doigt 7: L'eau de refroidissement à 8: L'eau de refroidissement dans le neuf: bouchon en Teflon 2 10: vide entrée / de gaz 11: bouchon en Teflon 3 12: récepteur Encore
La distillation sous vide
Certains composés ont des points d'ébullition très élevé. Pour faire bouillir de tels composés, il est souvent préférable d'abaisser la pression à laquelle ces composés sont bouillies plutôt que d'augmenter la température. Une fois que la pression est abaissée à la pression de vapeur du composé (à la température donnée), la cuisson et le reste du procédé de distillation peut commencer. Cette technique est appelée distillation sous vide et l'on trouve couramment dans le laboratoire sous la forme de la évaporateur rotatif.
Cette technique est également très utile pour des composés qui bouillent au-delà de leur température de décomposition à la pression atmosphérique et qui serait donc décomposé par toute tentative de les faire bouillir sous la pression atmosphérique.
Air sensible à une distillation sous vide
Certains composés ont des points d'ébullition élevés tout en étant sensible à l'air. Un système simple de distillation sous vide comme exemplifié ci-dessus peut être utilisé, de sorte que le vide est remplacé par un gaz inerte après la distillation est terminée. Cependant, ce est un système moins satisfaisant si l'on désire recueillir des fractions sous pression réduite. Pour ce faire, un adaptateur «porcin» peut être ajoutée à la fin du condenseur, ou pour de meilleurs résultats pour l'air ou bien des composés sensibles à un Appareil de Perkin triangle peut être utilisée.
Le triangle Perkin, présente des moyens par l'intermédiaire d'une série de verre ou Teflon tape permet de fractions à être isolés du reste de la encore, sans le corps principal de la distillation étant soit retiré de la source de vide ou à la chaleur, et peut ainsi rester dans un état de reflux. Pour ce faire, l'échantillon est d'abord isolé du vide par l'intermédiaire des robinets, le vide sur l'échantillon est ensuite remplacé par un gaz inerte (tel que l'azote ou l'argon ) et peut ensuite être bouché et retiré. Un récipient de collecte fraîche peut alors être ajouté au système, mis sous vide et relié dans le système de distillation par l'intermédiaire des robinets à recueillir une seconde fraction, et ainsi de suite, jusqu'à ce que toutes les fractions ont été recueillies.
Distillation à court trajet
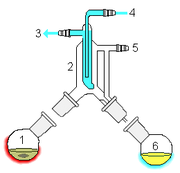
Distillation à court trajet est une technique de distillation qui comprend le distillat déplacement sur une courte distance, souvent quelques-uns seulement centimètres. Un exemple classique serait une distillation impliquant le déplacement de distillât une ampoule de verre à l'autre, sans avoir besoin d'un condenseur séparant les deux chambres. Cette technique est souvent utilisée pour des composés qui sont instables à des températures élevées. L'avantage est que la température de chauffage peut être considérablement plus faible (à cette pression réduite) que le point du liquide à la pression normale d'ébullition, et que le distillat ne dispose que de se déplacer sur une courte distance avant de se condenser.
D'autres types
- En evaporation rotative d'un appareil de distillation sous vide est utilisé pour enlever vrac solvants à partir d'un échantillon. Généralement, le vide est généré par un mélange eau ou un aspirateur Pompe à membrane.
- Dans un Kugelrohr (> 300 ° C) des composés d'un appareil de distillation à court trajet est généralement utilisé (généralement en combinaison avec un aspirateur (haut)) à haut point d'ébullition par distillation. L'appareil consiste en un four dans lequel le composé à distiller est placé, une partie de réception qui est à l'extérieur du four, et un moyen de rotation de l'échantillon. Le vide est normalement générée en utilisant une pompe à vide poussé.
- Le processus de distillation réactive consiste à utiliser le récipient de réaction en tant que reste. Dans ce procédé, le produit est généralement nettement plus faible point d'ébullition de ses réactifs. Comme le produit est formé à partir des réactifs, il est vaporisée et éliminée du mélange réactionnel. Cette technique est un exemple d'une constante par rapport à un procédé discontinu; avantages comprennent moins de temps d'arrêt de charger le récipient de réaction avec la matière de départ, et moins de retraitement.
- Distillation destructive implique le chauffage des solides solide (matière organique souvent) en l'absence d'oxygène (pour empêcher la combustion) de se évaporer divers liquides à haut point d'ébullition, ainsi que produits de thermolyse. Les gaz émis sont refroidis et condensés selon la distillation normale. La distillation destructive du bois pour donner du méthanol est la racine de son nom commun - alcool de bois.
- La pervaporation est un procédé pour la séparation de mélanges de liquides par vaporisation partielle d'une non-poreux membrane.
- Distillation sèche, malgré son nom, ne est pas vraiment la distillation, mais plutôt une réaction chimique connu sous le nom pyrolyse dans lequel les matières solides sont chauffés dans un fortement atmosphère réductrice et des fractions volatiles sont collectées.
- La distillation extractive est définie comme la distillation en présence d'un solvant miscible, point d'ébullition élevé, le composant relativement non volatile, le solvant, qui ne forme pas d'azéotrope avec les autres composants dans le mélange.
- Évaporation flash (ou évaporation partielle) est la vaporisation partielle qui se produit quand un courant de liquide saturé subit une réduction de pression par passage à travers un étranglement soupape ou un autre dispositif d'étranglement. Ce processus est une des opérations les plus simples de l'unité.
- Distillation gel est une méthode analogue de purification utilisant gel au lieu d'évaporation. Il ne est pas vraiment distillation, et ne produit pas de produits équivalents à une distillation. Ce procédé est utilisé dans la production de la bière glacée et vin de glace pour augmenter l'éthanol et du sucre contenu, respectivement.
- Co-distillation est une distillation qui est effectuée sur des mélanges dans lesquels les deux composés ne sont pas miscibles.
Distillation azéotropique
Les interactions entre les composants de la solution de créer des propriétés uniques de la solution, comme la plupart des procédés impliquent des mélanges non idéaux, où La loi de Raoult ne tient pas. Ces interactions peuvent conduire à une ébullition constante, azéotrope qui se comporte comme si ce était un composé pur (c.-à-bout à une température unique au lieu d'une gamme). A un azéotrope, la solution contient le composant donné dans la même proportion que la vapeur, de sorte que l'évaporation ne modifie pas la pureté et la distillation ne affecte pas la séparation. Par exemple, l'alcool éthylique et l'eau forment un azéotrope de 95% à 78,2 ° C.
Si l'azéotrope ne est pas considérée comme suffisamment pur pour être utilisé, il existe quelques techniques pour casser l'azéotrope pour donner un distillat pur. Cet ensemble de techniques sont connues que la distillation azéotropique. Certaines techniques parviennent en «saut» au-dessus de la composition azéotropique (par addition d'un composant supplémentaire pour créer un nouveau type azéotrope, ou par variation de la pression). D'autres travaillent par chimiquement ou physiquement enlever ou de séquestrer l'impureté. Par exemple, pour purifier de l'éthanol au-delà de 95%, un agent desséchant ou un agent desséchant tel que le carbonate de potassium peut être ajouté pour convertir l'eau soluble dans insoluble eau de cristallisation. Les tamis moléculaires sont souvent utilisés dans ce but également.
Liquides non miscibles, comme l'eau et le toluène, forment facilement des azéotropes. En général, ces azéotropes sont désignés comme un azéotrope à basse température d'ébullition, car le point d'ébullition de l'azéotrope est inférieure au point de chaque composant pur ébullition. La température et la composition de l'azéotrope est facilement prédites à partir de la pression de vapeur des corps purs, sans utilisation de la loi de Raoult. L'azéotrope est facilement rompu en une distillation mis en place à l'aide d'un séparateur liquide-liquide (un décanteur) pour séparer les deux couches liquides qui sont condensés en tête. Seule l'une des deux couches de liquide est chauffé à reflux à la distillation set-up.
Azéotropes à point d'ébullition élevé, comme un mélange de 20 pour cent en poids d'acide chlorhydrique dans de l'eau existent également. Comme son nom l'indique, le point de l'azéotrope d'ébullition est supérieur au point de chaque composant pur ébullition.
Pour briser distillations azéotropiques et croisées distillation limites, comme dans le problème DeRosier, il est nécessaire d'augmenter la composition de la touche de la lumière dans le distillat.
Briser un azéotrope avec la manipulation de pression unidirectionnel
Une distillation sous vide peut être utilisé pour «casser» un mélange azéotropique. La variation de la température de la vapeur lors de la génération ballon à distiller un azéotrope de froid au point d'ébullition des solutions ne produit pas un rapport de glissement continu de produit de contamination dans le distillat. Les deux points d'ébullition séparés restent, ils se chevauchent seulement; ceux-ci peuvent être considérées comme des énergies d'activation nécessaire pour la libération d'une vapeur particulière. En exposant un azéotrope à un vide, il est possible de polariser le point d'ébullition de l'un loin de l'autre en exploitant la différence entre chaque pression de vapeur des composants. Lorsque le biais est assez grand, les deux points d'ébullition ne se chevauchent plus et ainsi de la bande azéotropique disparaît.
Cette méthode ne est pas sans inconvénients. A titre d'exemple, l'exposition d'une solution d'eau et d'éthanol à un vide de 70 torr permettra d'éthanol absolu à distiller. Toutefois, en raison de l'atmosphère à faible pression, la vapeur d'éthanol nécessite une surface de condenseur sensiblement refroidisseur pour liquéfier, allant de 78,3 ° C à la pression atmosphérique à 24,5 ° C à 70 torrs; absence de tels résultats dans les vapeurs passant dans le condenseur et dans la source de vide. Cela peut aussi affecter l'efficacité du condenseur, la température de liquéfaction chute vers le minimum de l'équipement condensation peut refroidir à, le gradient thermique à travers les surfaces de liquéfaction réduit et, donc avec elle, la vitesse à laquelle la chaleur peut être extraite de la vapeur .
A l'inverse, l'augmentation d'une pression de distillation peut également briser un azéotrope, mais apportera avec elle la possibilité de décomposition thermique, des composés organiques, en particulier, et peut être plus avantageux pour les distillations à haute température tolérantes, tels que ceux des sels métalliques.
Pression-swing Distillation
Ce procédé de distillation peut être utilisée pour séparer des mélanges azéotropiques et se appuie sur un principe similaire à une distillation sous vide, cela étant la manipulation des points d'ébullition en modifiant la pression de l'atmosphère à laquelle est exposée une solution.
Il pourrait être choisi plus pur distillation sous vide d'un azéotrope si cette solution, par exemple, avait un tel point de liquéfaction faible à la pression nécessaire pour casser l'azéotrope que l'équipement était incapable de fournir pour elle, permettant au produit de flux de la condenseur et dans la source de vide. Ici, au lieu de manipuler un seul point d'ébullition, une ou plus sont modifiés l'un après l'autre; avec le nombre d'alternances de pression étant déterminé par le nombre de composants dans la solution d'alimentation considérés comme contaminants. Cela pourrait être bénéfique à une purification car il est susceptible de créer des exigences thermiques moins extrêmes. Simplement, au lieu de balancer pression de distillation dans un sens seul dans une tentative de briser l'azéotrope en une seule étape, la pause est effectuée en deux ou plusieurs étapes avec une pression basculé dans deux directions pour créer une bande d'exploitation centré autour des températures plus accessibles; peut-être passer d'une pression négative à la pression atmosphérique et à une pression positive. Essentiellement, à oscillation de pression distillation est une tentative pour réduire des conditions extrêmes en dispersant la charge de la manipulation à travers l'équipement de génération de l'environnement de distillation.
Si une alimentation continue est souhaitée, ou les pressions de distillation nécessaires sont assez extrême pour justifier la conception spécialisée, chaque étape peut exiger une colonne séparée physiquement. Si seulement un lot de fabrication est requise et la même colonne peut effectuer dans toutes les pressions nécessaires, cette colonne unique peut suffire; avec le flacon de génération de vapeur étant vidé après la première distillation, le premier distillat ramenées au début et à la reprise de distillation dans les conditions seconde de pression, et ainsi de suite.
La sélection des composants du distillat qui doit être sollicité vers peut être faite sur la base de l'énergie requise pour l'évaporer à partir de la solution d'alimentation.
Balançoire distillation à la pression est utilisé lors de la purification de l'acétate d'éthyle après sa synthèse catalytique dans l'éthanol.
Distillation industrielle

Applications de distillation industrielles à grande échelle comprennent à la fois lot et fractionnée en continu, vide, azéotropique, extraction et distillation à la vapeur. Les applications industrielles les plus largement utilisés de continu, l'état d'équilibre distillation fractionnée sont dans les raffineries de pétrole , la pétrochimie et les usines chimiques et les usines de traitement du gaz naturel.
Industrial distillation est généralement effectuée dans de grandes colonnes cylindriques verticales, appelées colonnes de distillation ou colonnes de distillation ayant des diamètres allant d'environ 65 cm à 16 mètres et la hauteur allant d'environ 6 mètres à 90 mètres ou plus. Lorsque l'alimentation du procédé a une composition diverse, comme dans la distillation de pétrole brut , sorties de liquide à des intervalles allant de la colonne permettant le retrait des différentes fractions ou de produits ayant des points d'ébullition ou des plages d'ébullition. Les produits "légers" (ceux dont le point d'ébullition le plus bas) de sortie par le haut des colonnes et les produits "lourds" (ceux dont le point d'ébullition le plus élevé), sortie par le bas de la colonne et sont souvent appelés les fonds.

Tours industrielles à grande échelle utilisent reflux pour obtenir une séparation plus complète de produits. Le reflux se réfère à la partie du produit de tête condensé liquide à partir d'une tour de distillation ou de fractionnement qui est renvoyée à la partie supérieure de la tour comme illustré dans le schéma de principe d'un, tour à grande échelle typique de distillation industrielle. A l'intérieur de la tour, le liquide de reflux écoulement vers le bas permet un refroidissement et la condensation des vapeurs d'écoulement vers le haut, augmentant ainsi l'efficacité de la tour de distillation. Plus reflux est prévu pour un nombre donné de plateaux théoriques, le mieux, ce est la séparation de la tour de matériaux d'ébullition inférieurs à partir de matériaux haut point d'ébullition. En variante, le plus reflux est prévu pour une séparation souhaitée donnée, les plateaux théoriques moins sont nécessaires.
Ces tours de fractionnement industrielle sont également utilisés dans la séparation de l'air, liquide produisant de l'oxygène , l'azote liquide de haute pureté et de l'argon . La distillation du chlorosilanes permet également la production de haute pureté silicium destiné à être utilisé en tant que semi-conducteur .

La conception et le fonctionnement d'une tour de distillation dépend de la charge et les produits souhaités. Compte tenu d'une alimentation en composants simple, binaire, des méthodes analytiques telles que la McCabe-Thiele méthode ou de la Fenske équation peut être utilisée. Pour une alimentation à plusieurs composants, modèles de simulation sont utilisés à la fois pour la conception et le fonctionnement. De plus, l'efficacité des dispositifs de contact vapeur-liquide (appelés "plaques" ou "plateaux") utilisés dans les tours de distillation sont typiquement inférieur à celui d'un théorique efficace à 100% stade d'équilibre. Par conséquent, une tour de distillation a besoin de plusieurs bacs que le nombre d'étages d'équilibre vapeur-liquide théoriques.
Dans les utilisations industrielles, parfois un matériau de garnissage est utilisé à la place de la colonne de plateaux, en particulier lorsque la pression chute bas à travers la colonne sont nécessaires, comme lors du fonctionnement sous vide.

Ce matériau d'emballage peut être soit aléatoire déversés emballage (1-3 "de large) tels que Anneaux de Raschig ou structuré tôle. Les liquides ont tendance à mouiller la surface de l'emballage et les vapeurs passent à travers cette surface mouillée, où transfert de masse a lieu. Contrairement plateau de distillation classique, dans laquelle chaque plateau représente un point d'équilibre vapeur-liquide séparé, la courbe d'équilibre vapeur-liquide dans une colonne garnie est continue. Cependant, lors de la modélisation des colonnes à garnissage, il est utile de calculer un nombre de plateaux théoriques "" pour indiquer l'efficacité de séparation de la colonne garnie par rapport à plateaux plus traditionnels. Contrairement emballages de forme ont des surfaces et de l'espace vide entre emballages. Ces deux facteurs influent sur la performance d'emballage.
Un autre facteur en plus de la forme de la garniture et la surface qui affecte les performances de garnissage en vrac ou structuré est la distribution de liquide et la vapeur entrant dans le lit tassé. Le nombre de étages théoriques nécessaires pour faire une séparation est calculée en utilisant une vapeur spécifique ratio liquide. Si le liquide et la vapeur ne sont pas répartis uniformément dans la zone superficielle de la tour comme il pénètre dans le lit garni, le liquide en vapeur rapport ne sera pas correct dans le lit garni et la séparation requise ne sera pas atteint. L'emballage sera semble ne pas fonctionner correctement. Le hauteur équivalente d'un plateau théorique (HETP) sera plus grand que prévu. Le problème ne vient pas de l'emballage lui-même mais la mauvaise distribution des fluides entrant dans le lit garni. Liquid mauvaise répartition est plus souvent le problème que de la vapeur. La conception des distributeurs de liquide utilisés pour introduire l'alimentation et le reflux d'un lit garni est essentielle pour faire l'emballage effectuer à elle une efficacité maximale. Méthodes d'évaluation de l'efficacité d'un distributeur de liquide pour distribuer uniformément le liquide entrant dans un lit garni peut être trouvée dans les références. Un travail considérable comme été fait sur ce thème par fractionnement Research, Inc. (communément connu sous le nom FRI).
La distillation dans la transformation des aliments
Boissons distillées
Acides gras saturés matières végétales -containing sont autorisés à fermenter, produisant une solution diluée d' éthanol dans le processus. Spiritueux tels que le whisky et le rhum sont préparés en distillant ces solutions diluées d'éthanol. D'autres éléments que l'éthanol sont recueillis dans le condensat, y compris l'eau, des esters, des alcools et d'autres qui représentent la saveur de la boisson.

