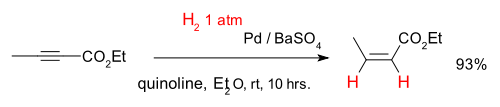Hidrogenação
Você sabia ...
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.

A hidrogenação é uma classe de reacções químicas que resultam na adição de um átomo de hidrogénio (H 2), geralmente a insaturados compostos orgânicos . O processo consiste na adição de hidrogénio átomos para o ligações duplas de uma molécula através do uso de um catalisador . O hidrogénio também aumenta a ligações triplas, se estiverem presentes. Substratos típicos incluem alcenos , alcinos, cetonas , nitrilos, e iminas. A maioria das hidrogenações envolvem a adição directa de hidrogénio diatómico (H 2), mas alguns envolvem as fontes alternativas de hidrogénio, não H2: estes processos são chamados hidrogenações transferência. A reacção inversa, a remoção de hidrogénio, é denominado desidrogenação. Uma reacção envolvendo a clivagem de hidrogénio e de um ligação carbono-oxigénio ou ligação carbono-azoto é chamado Hidrogenólise. A hidrogenação difere protonação ou Além hidreto (por exemplo, uso de boro-hidreto de sódio): em hidrogenação, os produtos que têm a mesma carga que os reagentes.
O exemplo clássico de uma hidrogenação é a adição de hidrogénio na insaturados ligações entre carbono átomos , convertendo alcenos com alcanos . Um exemplo simples é a hidrogenação de ácido maleico de ácido succínico representado à direita. Numerosas aplicações importantes encontram-se na petroquímicas, farmacêuticas e indústrias de alimentos.
Preocupações com a saúde associados com a hidrogenação de gorduras insaturadas para produzir gorduras saturadas e gorduras trans é um aspecto importante da consciência do consumidor atual.
Processo
Hidrogenação tem três componentes:
- o substrato insaturado,
- o (ou uma fonte de hidrogénio) de hidrogénio e, invariavelmente,
- um catalisador.
As utilizações tecnológicas maior escala de H 2 e são a hidrogenação reações de hidrogenólise associados a indústrias de produtos químicos, tanto pesados e multa. A hidrogenação é a adição de H 2 a insaturados compostos orgânicos , tais como alcenos para dar alcanos e aldeídos para dar álcoois . Reacções de hidrogenação requerem catalisadores de metais, muitas vezes aqueles compostos de platina ou similar metais preciosos.
A adição de H2 a uma alq e ne proporciona uma alq um NE na reacção protypical:
- RCH = CH2 + H 2 → RCH 2 CH 3 (R = alquilo , arilo)
Uma característica importante de alceno e alcino hidrogenações tanto homogéneos e heterogéneos é que a adição de hidrogénio ocorre com Além syn com hidrogénio entrar do lado menos prejudicada.
Catalisadores
Com excepção rara, sem reacção abaixo de 480 ° C ocorre entre H 2 e os compostos orgânicos na ausência de catalisadores de metal. O catalisador se liga simultaneamente o H 2 e o substrato insaturado e facilita a sua união. Metais do grupo da platina, especialmente platina , paládio , ródio e rutênio , são catalisadores altamente ativos. Os catalisadores altamente activos operam a temperaturas inferiores e pressões inferiores de H 2. Catalisadores de metais não preciosos, especialmente aqueles baseados em níquel (tais como Níquel de Raney e Urushibara níquel) também têm sido desenvolvidos como alternativas económicas mas são muitas vezes mais lento ou requerem temperaturas mais elevadas. A trade-off é atividade (velocidade da reacção) vs. custo do catalisador e o custo do aparelho necessário para a utilização de altas pressões.
Duas grandes famílias de catalisadores são conhecidos - homogêneo e heterogêneo. Catalisadores homogéneos dissolver no solvente que contém o substrato insaturado. Os catalisadores heterogéneos são sólidos que estão suspensos no mesmo solvente com o substrato ou são tratadas com substrato gasoso. Na indústria farmacêutica e para aplicações de produtos químicos especiais, solúvel " "Homogénea" "catalisador são por vezes empregues, tais como o ródio baseados composto conhecido como Catalisador de Wilkinson, ou o irídio baseados Catalisador de Crabtree.
A actividade e selectividade dos catalisadores pode ser ajustado mudando o ambiente em volta do metal, isto é, a esfera de coordenação. Diferente faces de um catalisador heterogéneo cristalino exibir actividades diferentes, por exemplo. Da mesma forma, os catalisadores heterogéneos são afectadas pelos seus suportes, isto é, o material em cima com o catalisador heterogéneo é ligado. Os catalisadores homogéneos são afectadas pela sua ligandos. Em muitos casos, altamente modificações empíricas envolver "venenos." Selectivos Assim, um catalisador cuidadosamente escolhida pode ser usado para hidrogenar alguns grupos funcionais, sem afectar os outros, tais como a hidrogenação de alcenos sem tocar os anéis aromáticos, ou a hidrogenação selectiva de alcinos usando a alcenos Catalisador de Lindlar. Para substratos pró-quirais, a selectividade do catalisador pode ser ajustado de tal modo que um produto enantiomérico é produzido.
Mecanismo de reacção
Devido à sua relevância tecnológica, catalisada por metal de "ativação" de H 2, tem sido objeto de estudo considerável, com foco na mecanismos de reação de metais pelo qual mediar essas reações. Em primeiro lugar marcação isotópica usando deutério pode ser utilizado para determinar o regioquímica da adição:
- RCH = CH2 + 2 D 2 D → RCHDCH
Essencialmente, o metal se liga a ambos os componentes para dar um alqueno-de metal intermediário (H) 2 complexo. A sequência geral de reacções é:
- ligação do hidrogénio, para dar um complexo dihydride ("adição oxidativa"):
- G N M + H 2 L n → MH 2
- ligação de alceno:
- G N H (η 2 H 2) + CH2 = CHR → L n-1 MH 2 (CH2 = CHR) + L
- transferência de um átomo de hidrogénio a partir do metal de carbono (de inserção migratório)
- L n-1 MH 2 (CH2 = CHR) n-L → 1 M (H) (CH 2 CH 2 R)
- transferência do segundo átomo de hidrogénio a partir do metal para o grupo alquilo com dissociação simultânea do alcano ("eliminação redutiva")
- L n-1 M (H) (CH 2 CH 2 R) → L n-1 + H CH 3 -CH 2 R
Precedendo a adição oxidativa de H2 é a formação de um complexo dihydrogen.
Temperaturas
A reacção é levada a cabo a diferentes temperaturas e pressões dependendo do substrato. A hidrogenação é fortemente reacção exotérmica. Na hidrogenação de óleos vegetais e ácidos gordos, por exemplo, o calor libertado é de cerca de 25 Kcal por mole (105 kJ / mol), suficiente para elevar a temperatura do óleo por 1,6-1,7 ° C por gota número de iodo.
Escopo
Os alcinos podem ser convertidos selectivamente em alcenos num chamado semihydrogenation, por exemplo com o composto 2-butinoato de etilo e um catalisador de paládio sobre e sulfato de bário quinolina (que desactiva o catalisador de reforço quimiosselectividade):
ou com 4- (trimetilsilil) -3-butin-1-ol:
- 4- (trimetilsilil) hidrogenação -3-butin-1-ol
A próxima reacção caracteriza carvona é um exemplo de ou seja, a catálise homogénea Catalisador de Wilkinson:
A hidrogenação é sensível às impedimento estérico explicar a selectividade para a reacção com o ligação dupla exocíclica mas não a ligação dupla interna.
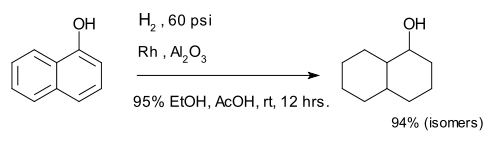
O composto 1-naftol ser completamente reduzida a uma mistura de decalina-ol isómeros.
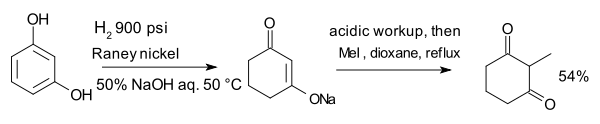
O composto resorcinol, com hidrogenada Níquel de Raney na presença de aqeous hidróxido de sódio constitui enolato que é alquilado com iodeto de metilo a 2-metil-1,3-cyclohexandione:
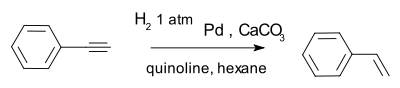
Um catalisador eficaz é a Catalisador de Lindlar, por exemplo, na conversão de fenilacetileno para estireno.
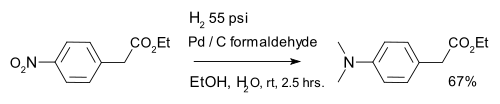
A hidrogenação também é usado em redução orgânica de nitro-compostos, por exemplo compostos nitro aromáticos em combinação com de paládio sobre carbono e formaldeído:
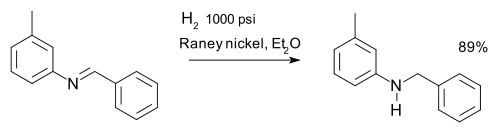
ou a redução de iminas, por exemplo, numa síntese de m-tolylbenzylamine:
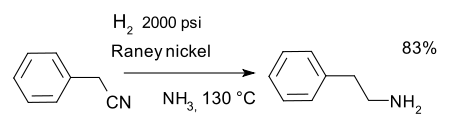
ou a redução de nitrilos, por exemplo numa síntese de fenetilamina com Raney níquel e amônia :
Na indústria de alimentos
| Tipos de gorduras em alimentos |
|---|
|
| Veja também |
|
A hidrogenação é amplamente aplicado para o tratamento de óleos vegetais e gorduras. Hidrogenação completa converte insaturados ácidos graxos para as saturadas. Na prática, o processo não é normalmente levada à conclusão. Uma vez que os óleos originais geralmente conter mais de um dupla ligação por molécula (isto é, eles são poli-insaturados), o resultado é geralmente descrito como o óleo vegetal parcialmente hidrogenado; que é alguns, mas geralmente não todos, das ligações duplas em cada molécula ter sido reduzida. Isso é feito limitando a quantidade de hidrogénio (ou agente redutor) deixado reagir com a gordura.
Resultados hidrogenação na conversão de vegetais líquidos óleos de gorduras sólidas ou semi-sólidas, tais como aqueles presentes em margarina. Alterando o grau de saturação da gordura muda algumas propriedades físicas importantes, tais como o ponto de fusão, que é por isso tornar-se óleos líquidos semi-sólido. Gorduras semi-sólidas são preferidas para cozer, porque a maneira como a mistura com farinha de gordura produz uma textura mais desejável no produto cozido. Uma vez que os óleos vegetais parcialmente hidrogenados são mais baratos do que as gorduras de origem animal, estão disponíveis em uma ampla gama de consistências, e tem outras características desejáveis (por exemplo, aumento da estabilidade oxidativa (maior vida de prateleira)), que são as gorduras predominantes utilizados na maioria dos produtos de panificação comercial . Misturas de gorduras formuladas para esta finalidade são chamados encurtamentos.
Implicações para a saúde
Um efeito colateral da hidrogenação ter implicações incompletos para a saúde humana é a isomerização das restantes ligações insaturadas de carbono. O configuração cis destas ligações duplas predomina nas gorduras não transformados em fontes de gordura mais comestíveis, mas hidrogenação incompleta converte parcialmente estas moléculas para isómeros trans, os quais foram implicados em doenças circulatórias incluindo doença de coração (veja gorduras trans). O processo de hidrogenação catalítica favorece a conversão a partir de cis para trans ligações porque a configuração trans tem uma energia menor do que o cis natural. Em equilíbrio, a razão de isómeros trans / cis é de cerca de 2: 1. A legislação alimentar em os EUA e códigos de prática na UE declaram rótulos o teor de gordura dos alimentos no comércio a retalho longo necessário, e, mais recentemente, também têm exigido declaração do teor de gordura trans.
Em 2006, Nova York adotou primeira grande proibição do US municipal em gorduras trans artificiais mais em restaurante de culinária.
História
A primeira é que a hidrogenação de platina catalisada adição de hidrogénio para oxigénio no Lâmpada de Döbereiner, um dispositivo comercializado já em 1823. O químico francês Paul Sabatier é considerado o pai do processo de hidrogenação. Em 1897 descobriu que a introdução de um traço de níquel como catalisador facilitou a adição de hidrogénio a moléculas de compostos de carbono gasosos em que é agora conhecido como o Processo de Sabatier. Para este trabalho Sabatier ganhou metade do 1912 Prêmio Nobel de Química . Wilhelm Normann recebeu uma patente na Alemanha em 1902 e na Grã-Bretanha em 1903 para a hidrogenação de óleos líquidos usando gás hidrogênio, que foi o início do que hoje é um mundo muito grande indústria de largura. A comercialmente muito importante Processo Haber-Bosch (hidrogenação amônia) foi descrita pela primeira vez em 1905 e menos Processo de Fischer-Tropsch (hidrogenação de monóxido de carbono) em 1922. Uma outra aplicação comercial é a processo oxo, (1938), um acoplamento mediado por hidrogénio de aldeídos com alcenos. Catalisador de Wilkinson foi o primeiro catalisador homogéneo desenvolvido nos anos 1960 e Noyori hidrogenação assimétrica (1987) uma das primeiras aplicações em síntese assimétrica. Um artigo de revisão de 2007 defendeu o uso de mais hidrogenações em reações de acoplamento CC, como o processo de oxo.
Hidrogenação livre de metais
Embora para todos os efeitos práticos hidrogenação requer um catalisador de metal existem alguns sistemas catalíticos livres de metal que são investigados na pesquisa acadêmica. Um tal sistema para a redução de cetonas consiste terc-butanol e terc-butóxido de potássio e temperaturas muito elevadas. A reacção descrita abaixo descreve a hidrogenação de benzofenona:
A estudo cinética química encontrada esta reação é primeira ordem em todos os três reagentes sugerindo uma cíclico de 6 membros estado de transição.
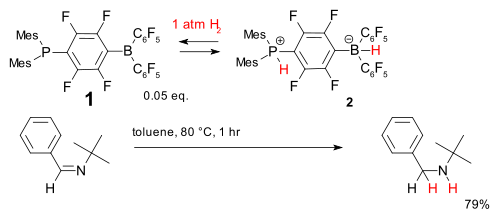
Outro sistema é baseado na phosphine- composto de borano (1). É reversível aceita dihidrogenofosfato a temperaturas relativamente baixas para formar o fosf�nio borato de 2, que é capaz de reduzir uma simples impedido imina.