
Nitrato
Fundo para as escolas Wikipédia
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Nitrato | |
|---|---|
 | |
 |  |
Nitrato | |
| Propriedades | |
| Fórmula molecular | NO - 3 |
| Massa molar | 62,0049 g mol-1 |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
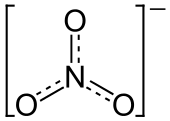
Nitrato é um ião poliatômico com a fórmula molecular NO 3 - e uma massa molecular de 62,0049 g / mol. Nitratos também descrevem a orgânica grupo funcional RONO 2. Estes ésteres de nitrato são uma classe especializada de explosivos.
Estrutura
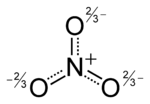
O anião é a base conjugada do ácido nítrico , que consiste em uma central de azoto átomo rodeado por três átomos de oxigénio ligados de forma idêntica numa arranjo planar trigonal. O ião nitrato transporta um acusação formal de -1. Isto resulta a partir de uma carga formal combinação em que cada um dos três oxigénios transporta um - 2/3 carga, enquanto que o átomo de azoto transporta uma carga de 1, todos estes adicionando-se a carga formal do ião nitrato poliatômico. Este arranjo é comumente utilizado como um exemplo de ressonância. Como o isoeletrônica carbonato de iões, o ião de nitrato podem ser representados por estruturas de ressonância:
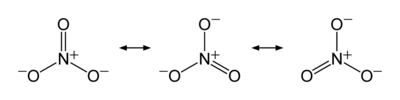
Propriedades
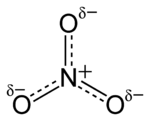
Quase todos os sais de nitrato inorgânico são solúveis em água em temperatura padrão e pressão. Um exemplo comum de um sal de nitrato inorgânico é o nitrato de potássio (salitre).
Ocorrência
Sais de nitrato são encontrados naturalmente na Terra como grandes depósitos, em especial dos Chile Salitre uma importante fonte de nitrato de sódio.
Os nitritos são produzidas por um número de espécies de bactérias nitrificantes, e os compostos à base de nitrato de pólvora (ver este tópico para mais) foram historicamente produzidos, na ausência de fontes de nitrato de minerais, por meio de vários processos de fermentação que utilizam urina e esterco.
Usos
Nitratos são produzidos principalmente para uso como fertilizantes na agricultura por causa de sua alta solubilidade e biodegradabilidade. Os principais são os nitratos de amónio, sódio, potássio, e sais de cálcio. Vários milhões de quilogramas são produzidos anualmente para esta finalidade.
Outros usos
A segunda maior aplicação de nitratos como agentes oxidantes, mais notavelmente em explosivos, onde a rápida oxidação de compostos de carbono liberta grandes volumes de gases (ver Gunpowder para um exemplo). Nitrato de sódio é utilizada para remover as bolhas de ar a partir de vidro fundido e algumas cerâmicas. As misturas de o sal fundido são usados para endurecer alguns metais.
Detecção
Iões nitrato livre em solução pode ser detectada por um nitrato eletrodo íon seletivo. Tais eléctrodos de modo análogo ao eléctrodo de pH selectivo. Esta resposta é parcialmente descrito pela Equação de Nernst.
Toxicidade
Toxicose
Nitrato de intoxicação pode ocorrer por meio de entero metabolismo do nitrato em nitrito de ser um intermediário. Nitritos oxidar o ferro em átomos hemoglobina a partir de ferro ferroso (2+) para ferro férrico (3+), tornando-o incapaz de transportar oxigênio. Este processo pode levar a generalizada falta de oxigênio no tecido do órgão e uma condição perigosa chamada metemoglobinemia. Embora nitrito converte a amónia , se houver mais do que nitrito pode ser convertido, o animal sofre lentamente de uma falta de oxigénio.
Efeitos na saúde humana
Os seres humanos são sujeitos a toxicidade nitrato, com lactentes sendo especialmente vulneráveis à metemoglobinemia devido à metabolização nitrato triglicerídeos presentes em concentrações mais elevadas do que em outros estágios de desenvolvimento. Metemoglobinemia em lactentes é conhecido como síndrome do bebê azul. Apesar de nitratos na água potável já foram pensadas para ser um fator contribuinte, existem agora dúvidas científicas significativas quanto à existência de um nexo de causalidade. Síndrome do bebê azul é agora pensado para ser o produto de uma série de fatores, que pode incluir qualquer fator que cause distúrbio gástrico, como infecção diarréica, intolerância à proteína, toxicidade do metal pesado etc., com nitratos jogar um papel menor. Nitratos, se um fator em um caso específico, seria mais frequentemente ser consumido pela criança na água potável de alta nitrato. No entanto, a exposição de nitrato podem também ocorrer se comer, por exemplo, vegetais contendo elevados níveis de nitrato. Alface podem conter nitratos em condições de crescimento elevado como a luz solar reduzida, undersupply do micronutrientes essenciais molibdênio (Mo) e ferro (Fe), ou altas concentrações de nitrato devido à reduzida assimilação de nitrato na planta. Altos níveis de nitrato de fertilização também contribuir para níveis elevados de nitrato na planta colhida.
Alguns adultos pode ser mais susceptíveis aos efeitos de nitrato do que outros. O redutase de metemoglobina enzima pode ser sub-produzido ou ausentes em certos pessoas que têm uma mutação herdada. Esses indivíduos não pode quebrar methemoglobin tão rapidamente quanto aqueles que têm a enzima, levando a níveis circulantes aumentados de meta-hemoglobina (o que implica que o seu sangue não é tão rico em oxigênio). Aqueles com insuficiente ácido do estômago (incluindo alguns vegetarianos e vegans) podem também estar em risco. É o aumento do consumo de vegetais de folhas verdes, que normalmente acompanham estes tipos de dietas podem levar a um aumento da ingestão de nitrato. Uma grande variedade de condições médicas, incluindo alergias alimentares, asma, hepatite e cálculos biliares podem estar ligados com baixa acidez estomacal; estes indivíduos também podem ser altamente sensíveis aos efeitos de nitrato.
Metemoglobinemia pode ser tratada com azul de metileno, o que reduz o ferro férrico (3+) em células do sangue afetadas de volta para o ferro ferroso (2+).
Toxicidade marinha
Em água doce ou sistemas estuarinos perto de terra, o nitrato pode atingir níveis elevados que podem potencialmente causar a morte de peixes. Enquanto nitrato é muito menos tóxico do que o amoníaco, os níveis acima de 30 ppm de nitrato pode inibir o crescimento, comprometer o sistema imune e causar o stress em algumas espécies aquáticas. No entanto, à luz dos problemas inerentes com protocolos anteriores em experiências de toxicidade aguda nitrato, o grau de toxicidade de nitrato tem sido o assunto de debate recente.
Na maioria dos casos de concentração de nitratos em excesso em sistemas aquáticos, a fonte primária é escoamento superficial da agricultura ou paisagísticos áreas que receberam excesso de fertilizante de nitrato. Isto é chamado eutrofização e pode levar à proliferação de algas. Bem como levando a água anoxia e zonas mortas, estas flores podem causar outras alterações função do ecossistema, favorecendo alguns grupos de organismos sobre os outros. Como consequência, como nitrato forma um componente de total de sólidos dissolvidos, eles são largamente usados como um indicador de qualidade da água.
Nitrato é também um subproduto de sistemas sépticos. Para ser mais específico, é um produto químico que ocorre naturalmente que é deixado após o colapso ou a decomposição de resíduos animais ou humano. A qualidade da água também pode ser afetado por meio de recursos de água do solo que têm um elevado número de sistemas sépticos em um divisor de águas. Séticos lixiviação para baixo em recursos de água subterrânea ou aquíferos e de abastecimento de corpos de água próximos. Lagos que dependem de águas subterrâneas são frequentemente afectados por nitrificação através deste processo.
Nitrato na água potável em níveis acima do padrão nacional representa uma ameaça imediata para as crianças. Os níveis excessivos podem resultar em uma condição conhecida como " síndrome do bebê azul ". Se não tratada, a doença pode ser fatal. Ferver a água contaminada com nitratos aumenta a concentração de nitratos eo risco potencial.
Toxicidade nitrato na pecuária
Envenenamento por nitrato é uma preocupação para produtores de gado, principalmente, mas também para outros produtores de ruminantes. O nitrato é naturalmente consumido por cultivo de plantas; no entanto, quando o crescimento é interrompido, as raízes das plantas continuará a ocupar o nitrato do solo, ea menos que o novo crescimento da planta ocorre, o nitrato vai acumular. Assim, a colheita após resultados acúmulo de nitrato em uma cultura que é rico em nitratos. Fatores que podem causar acúmulo de nitrato em plantas são geada, granizo, seca, ventos quentes e secos, os danos de pesticidas, herbicidas e danos de qualquer outra planta nanismo causas ambientais.
Os sintomas de envenenamento nitrato incluem aumento da freqüência cardíaca e respiração; em casos avançados de sangue e de tecido pode virar uma cor azul ou marrom. De alimentação pode ser testado para o nitrato; tratamento consiste em completar ou substituindo suprimentos existentes com menor material de nitrato. Níveis seguros de nitrato de vários tipos de gado são as seguintes:
| Categoria | NO 3% | % NO 3 -N | KNO 3% | Efeito |
|---|---|---|---|---|
| 1 | <0,5 | <0,12 | <0,81 | Geralmente segura para bovinos de corte e ovinos |
| 2 | 0,5-1,0 | 0,12-0,23 | 0,81-1,63 | Cuidado - alguns sintomas subclínicos podem aparecer em cavalos, ovelhas grávidas e bovinos de corte |
| 3 | 1.0 | 0.23 | 1.63 | Problemas de nitrato - perdas de morte e abortos podem ocorrer em bovinos de corte e ovinos |
| 4 | <1,23 | <0,28 | <2,00 | Nível seguro máximo para cavalos. Não alimente forragem elevados de nitratos para éguas grávidas |
Os valores acima são em uma base (livre de umidade) seco.
Resumo nitrato
| HNO3 | Ele | |||||||||||||||||
| LiNO3 | Seja (NO 3) 2 | B (NO 3) 3 | C | N | O | F | Ne | |||||||||||
| NaNO3 | Mg (NO 3) 2 | Al (NO 3) 3 | Si | P | S | ClONO 2 | Ar | |||||||||||
| KNO 3 | Ca (NO 3) 2 | Sc (NO 3) 3 | Ti | V | Cr (NO 3) 3 | Mn (NO3) 2 | Fe (NO 3) 3 | Co (NO 3) 2 | Ni (NO3) 2 | Cu (NO 3) 2 | Zn (NO 3) 2 | Ga | Ge | Como | Se | Br | Kr | |
| RbNO 3 | Sr (NO 3) 2 | Y | Zr | Nb | Mo | Tc | Ru | Rh | De Pd (NO3) 2 | AgNO3 | Cd (NO3) 2 | Em | Sn | Sb | Te | CI | Xe | |
| CsNO3 | Ba (NO 3) 2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg (NO 3) 2 | Tl | Pb (NO 3) 2 | Bi | Po | Em | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | UUP | Uuh | Uus | UUO | ||
| ↓ | ||||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd (NO3) 3 | Tuberculose | Dy | Ho | Er | Tm | Yb | Lu | ||||
| CA | Th | Pa | UO2 (NO3) 2 | Np | Pu | Sou | Cm | Bk | Cf | Es | Fm | Md | Não | Lr | ||||
