
O ródio (III), cloreto de
Você sabia ...
Esta seleção é feita para as escolas de caridade infantil leia mais . Todas as crianças disponíveis para apadrinhamento de crianças de Crianças SOS são cuidadas em uma casa de família pela caridade. Leia mais ...
| Os dados de segurança | |
|---|---|
 | |
Outros nomes Ródio trichloride | |
| Identificadores | |
| Número da CE | 233-165-4 |
| Número RTECS | VI9290000 |
| Propriedades | |
| Fórmula molecular | RhCl 3 |
| Massa molar | 209,26 g / mol (anidro) |
| Aparência | sólido vermelho escuro |
| Densidade | 5,38 g / cm 3, sólido |
| Ponto de fusão | 450 ° C (incerta) |
| Ponto de ebulição | 717 ° C |
| Solubilidade em água | solúvel |
| Acidez (p Ka) | em solução ácida |
| Estrutura | |
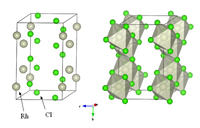
| A estrutura de cristal | Ycl 3 |
| Coordenação geometria | octaédrico |
| Termoquímica | |
| Entalpia padrão de formação Δ f H | -234 KJ / mol |
| Perigos | |
| Classificação da UE | não listado |
| Ponto de centelha | não inflamável |
| Os compostos relacionados | |
| Outros aniões | O ródio (III), fluoreto O ródio (III) brometo de O ródio (III), iodeto de |
| Outros cátions | O cobalto (II), cloreto de Irídio (III) cloreto de |
| Os compostos relacionados | Ruténio (III), cloreto de Paládio (II) cloreto de |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O ródio (III), cloreto geralmente refere-se a tricloreto de ródio hidratado, de um composto com a fórmula molecular RhCl 3 (H 2 O) 3. Outra cloreto de ródio é proeminente RhCl 3, um sólido polimérico com a estrutura AlCl3. Trabalhadores inexperientes às vezes confundem os dois cloretos de ródio, mas seu comportamento é completamente diferente. Mais química atribuída a "tricloreto de ródio" requer a utilização da forma hidratada. Alguns procedimentos que exigem um cloreto de ródio implicam a utilização de Na 3RhCl 6, que é também um molecular, portanto, reactivo, a forma de Rh (III).
Cloretos de ródio (III) são os produtos da separação de ródio da outra metais do grupo da platina.
Propriedades
RhCl 3 (H 2 O) x existe a vermelho escuro diamagnetic cristais. É moderadamente higroscópico. É solúvel em água para dar soluções avermelhado que, dependendo da idade da solução, contêm quantidades variáveis de RhCl 3 (H 2 O) 3, [RhCl 2 (H2O) 4] + e [RhCl (H 2 O) 5] 2+.
Preparação
RhCl 3 (H 2 O) 3 é produzido pela acção de ácido clorídrico em hidratada de ródio (III) óxido. RhCl 3 (H 2 O) 3 pode ser cristalizado a partir de uma solução concentrada de ácido clorídrico . Este método ajuda a remover o nitrogênio molecular contendo impurezas.
RhCl 3 é preparado por reacção do cloro com ródio esponja a 200-300 ° C. A reacção correspondente no fundido de cloreto de sódio proporciona 6 Na 3RhCl.
Complexos de coordenação
RhCl 3 (H 2 O) 3 é usado para preparar uma variedade de complexos, como ilustrado abaixo. Os complexos de Rh (III) são geralmente cineticamente inerte com geometria octaédrica. Rh (I) derivados tendem a ser planar quadrado.
Ammines
Soluções em etanol de RhCl 3 (H 2 O) 3 reage com amónia para se obter o cloreto de pentammine [RhCl (NH3) 5] 2+. Zinco redução deste catião seguido pela adição de sulfato dá o hidreto incolor [[RHH (NH 3) 5] SO 4. Note-se que os complexos de NH3 são geralmente referidos como "ammines".
Tio�eres
Etanólicos soluções de RhCl 3 (H 2 O) 3 reage com sulfuretos de dialquilo.
- RhCl 3 (H 2 O) 3 + 3 SR 2 → RhCl 3 (SR 2) 3 + 3 H2O
Ambos fac e mer estereoisómeros de tais compostos foram isolados.
Fosfinas terciárias
A reacção de 3 RhCl (H 2 O) 3 sob condições suaves com fosfinas terciárias proporciona aductos semelhante aos complexos de tioéter acima mencionados. Quando estas reacções são conduzidas em ebulição etanol solução, obtém-se Rh (I), tais como derivados de RhCl (PPh3) 3, Catalisador de Wilkinson. Neste caso, o etanol provavelmente serve como agente redutor, obtendo-se o acetaldeído.
- RhCl 3 (H 2 O) 3 + 3 PPh3 + CH 3 CH 2 OH → RhCl (PPh3) 3 + CH 3 CHO + 2 HCl + 3 H2O
Alternativamente, PPh3 / H2O poderia ser o agente redutor, obtendo-se OPPh 3 e HCl.
Piridina
Após a ebulição numa mistura de etanol e piridina (PY), RhCl 3 (H 2 O) 3 dá trans- [RhCl 2 (aa) 4)] Cl. A influência redutora do etanol é evidente porque a reacção correspondente na água proporciona fac-RhCl 3 (piridina) 3, análogos aos derivados de tioéter. A oxidação de uma solução etanólica aquosa de piridina e RhCl 3 (H 2 O) 3 por ar proporciona azul paramagnética [Cl (py) 4 Rh-O 2 Rh (py) 4 Cl] 5+.
Alkenes
A reacção de 3 RhCl (H 2 O) 3 com olefinas proporciona compostos do tipo Rh 2 Cl 2 (alceno) 4. Mais comumente, dialkenes são empregues nesta reacção, tal como norbornadieno e 1,5-ciclooctadieno. Ilustrativa da sua elevada reactividade dos seus complexos de alceno, em que 1,3-ciclooctadieno é tratada com 3 RhCl (H 2 O) 3, em etanol, obtém-se o complexo de 1,5-ciclooctadieno. Os ligandos de diolefina pode ser removido por descomplexação usando cianeto.
Monóxido de carbono
Agitando um metanol solução de RhCl 3 (H 2 O) 3 sob 1 bar de monóxido de carbono produz o anião dicarbonyldichlororhodate (I), [RhCl 2 (CO) 2] -. O tratamento de um sólido RhCl 3 (H 2 O) 3, com fluxo de CO dá [RhCl (CO) 2] 2, um sólido de cor vermelha que por sua vez se dissolve em álcoois na presença de cloreto, para dar o dicloreto acima mencionado.
Numerosos Rh-CO-PR 3 (R = grupo orgânico) compostos foram preparados no decurso de investigações extensivas sobre a catálise de hidroformilação. RhCl (PPh3) 3 reage com CO para dar trans-RhCl (CO) (PPh3) 2, análogo ao estequiometricamente mas menos reactivos do que Complexo de Vaska. Este mesmo composto pode ser preparado utilizando formaldeído no lugar de CO. Trans-RhCl (CO) (PPh3) 2 reage com uma mistura de NaBH4 e PPh3 dá RHH (CO) (PPh3) 3.
Ródio e catálise
Começando especialmente na década de 1960, RhCl 3 (H 2 O) 3 foi demonstrado ser cataliticamente activo para uma variedade de reacções envolvendo CO, H 2, e alceno . Por exemplo, RhCl 3 (H 2 O) 3 foi mostrado para dimerise eteno a uma mistura de cis e trans 2-buteno:
- 2 C 2 H 4 → CH3-CH = CH-CH 3
(Infelizmente essa reação falhar por alcenos mais elevados).
Nas décadas seguintes, no entanto, a catálise baseado em ródio tem enfatizado reacções em solventes orgânicos com ligandos orgânicos em lugar de H 2 O. Assim, a dimerização de etileno foi demonstrado que envolvem catálise por Rh 2 Cl 2 (C 2 H 4) 4. Isto e muitas descobertas relacionadas alimentada então jovem campo de "catálise homogénea", em que os catalisadores são dissolvidos no meio com o substrato. Anterior a essa época, a maioria dos catalisadores de metal eram "heterogêneo", ou seja, os catalisadores foram sólidos e os substratos foram líquido ou gases.
Um avanço significativo na área de catálise homogénea foi a descoberta de que PPh 3 -derived complexos foram particularmente activos cataliticamente, bem como solúvel em solventes orgânicos. Mais conhecido dos catalisadores suportados-fosfina é RhCl (PPh3) 3,:, que catalisa a hidrogenação e isomerização de alcenos. O hidroformilação. de alcenos é catalisada pela RHH relacionada (CO) (PPh3) 3. Catálise por ródio é tão eficiente que se deslocou de forma significativa a tecnologia anterior, com base em catalisadores de cobalto menos caros.
Segurança
Ródio (III) cloreto não está listado no Anexo I da Directiva 67/548 / CEE do Conselho, mas é geralmente classificado como nocivo, R22: Nocivo por ingestão. Alguns compostos Rh têm sido investigados como fármacos anti-cancro. O ródio não é um elemento essencial.
Ele é listado no inventário do Toxic Substances Control Act (TSCA).

