
Zinco
Sobre este escolas selecção Wikipedia
Este conteúdo da Wikipedia foi escolhida pela SOS Children para adequação nas escolas de todo o mundo. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.
| Zinco | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
30 Zn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
cinza-prata  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | zinco, Zn, 30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / z ɪ ŋ k / ZINGK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | de metal de transição alternativamente considerado um metais de transição pós- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 12, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 65,38 (2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 3d 10 4s 2 2, 8, 18, 2 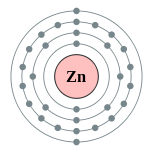 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Metalúrgicos indianas (antes 1000 aC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Andreas Sigismund Marggraf (1746) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconhecido como um único de metal pela | Rasaratna Samuccaya (800) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 7,14 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 6,57 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 692,68 K , 419,53 ° C, 787,15 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 1,180 K, 907 ° C, 1665 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 7,32 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 123,6 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 25,470 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, 1, 0 ( óxido anfotérico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,65 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 906,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1733,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3833 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 134 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 122 ± 16:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 59,0 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 116 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 30,2 pM · · K -1 m -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | ( rt) (laminado) 3850 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 108 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 70 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 412 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-66-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de zinco | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zinco, no comércio também spelter, é um metálico elemento químico ; ele tem o símbolo Zn e número atômico 30. É o primeiro elemento de grupo 12 da tabela periódica . O zinco é, em alguns aspectos, quimicamente semelhante à de magnésio , porque a sua ion é de tamanho semelhante e seu único comum estado de oxidação é 2. O zinco é o elemento mais abundante 24 na crosta da Terra e tem cinco estáveis isótopos . O zinco mais comum minério é esfalerite (blenda de zinco), uma de mineral de sulfureto de zinco. As maiores quantidades lavráveis são encontrados na Austrália, Ásia e Estados Unidos. Produção de zinco inclui flotação de minério, torrefação, e último extração usando eletricidade ( electrowinning).
Latão, que é um liga de cobre e zinco, tem sido usado desde pelo menos o século 10 aC. Impure metal de zinco não foi produzido em larga escala até o século 13 na Índia, enquanto o metal era desconhecido na Europa até o final do século 16. Alquimistas queimado zinco no ar para formar o que chamaram " lã de filósofo "ou" snow white ".
O elemento foi provavelmente nomeado pelo alquimista Paracelso após a palavra alemã Zinke. Químico alemão Andreas Sigismund Marggraf normalmente é dado o crédito para descobrir zinco metálico puro em 1746. O trabalho de Luigi Galvani e Alessandro Volta descobriu as propriedades eletroquímicas de zinco em 1800. Corrosão -resistente zincagem de ferro ( galvanização por imersão a quente) é o principal pedido de zinco. Outras aplicações são nas baterias, pequenas peças fundidas não estruturais, e ligas, como bronze. Uma variedade de compostos de zinco são comummente utilizados, tais como carbonato de zinco e gluconato de zinco (como suplementos nutricionais), cloreto de zinco (em desodorizantes), a piritiona de zinco (anti- caspa champôs), sulfureto de zinco (em tintas luminescentes), e zinco ou metil dietil-zinco em laboratório orgânico.
O zinco é um mineral essencial do "biológico excepcional e importância para a saúde pública". A deficiência de zinco afeta cerca de dois bilhões de pessoas no mundo em desenvolvimento e está associada a muitas doenças. Em crianças, causa atraso de crescimento, maturação sexual retardada, susceptibilidade a infecção, e a diarreia, o que contribui para a morte de crianças em todo o mundo cerca de 800.000 por ano. Enzimas com um átomo de zinco no centro reactivo são difundidos em bioquímica, tais como álcool desidrogenase em seres humanos. O consumo de excesso de zinco pode causar ataxia, letargia e deficiência de cobre.
Características
Propriedades físicas
O zinco, também referida em contextos nonscientific como zinco, é um brilhante branco-azulado,, de metal diamagnético, embora a maioria das classes comerciais comuns do metal têm um acabamento fosco. Ele é um pouco menos denso do que a ferro e tem uma hexagonal estrutura cristalina.
O metal é duro e quebradiço, no máximo, mas torna-se maleável temperaturas entre 100 e 150 ° C . Acima de 210 ° C, o metal torna-se quebradiça e pode ser novamente pulverizado por bater. O zinco é um justo condutor de eletricidade. Para um metal, zinco tem relativamente baixo ponto de fusão (° C 419,5, 787,1 M) e pontos de ebulição (907 ° C). Seu ponto de fusão é a mais baixa de todos os metais de transição para além de mercúrio e cádmio .
Muitos ligas contêm zinco, incluindo latão, uma liga de cobre e zinco. Outros metais longo conhecidos para formar ligas binárias com zinco são de alumínio , antimónio , bismuto , ouro , ferro, chumbo , mercúrio , prata , estanho , magnésio , cobalto , níquel , telúrio e sódio . Embora nem zinco nem de zircônio são ferromagnético, a sua liga ZrZn duas exposições ferromagnetismo abaixo de 35 K .
Ocorrência
O zinco torna-se cerca de 75 ppm (0,0075%) do crosta terrestre , tornando-se o elemento mais abundante 24. O solo contém 5-770 ppm de zinco, com uma média de 64 ppm. A água do mar tem apenas 30 ppb de zinco e a atmosfera contém 0,1-4 ug / m 3.

O elemento é normalmente encontrada em associação com outros metais básicos, como cobre e chumbo no minérios. O zinco é uma chalcophile, ou seja, o elemento tem uma baixa afinidade para óxidos e prefere se relacionar com sulfetos. Chalcophiles formada como a crosta solidificada sob a reduzindo as condições da atmosfera primitiva da Terra. Esfalerite, que é uma forma de sulfeto de zinco, é o minério contendo zinco mais minado porque a sua concentrado contém 60-62% de zinco.
Outros minerais a partir do qual o zinco é extraído incluir smithsonite (zinco carbonato ), hemimorphite (zinco silicato), wurtzita (outro sulfureto de zinco), e, por vezes, hydrozincite (básico carbonato de zinco). Com a excepção de wurtzite, Todos estes minerais foram formadas como um resultado da resistência processos nos sulfuretos de zinco primordiais.
Recursos de zinco do mundo identificadas totalizam cerca de 1,9 bilhão toneladas. Grandes depósitos são, na Austrália, Canadá e Estados Unidos, com as maiores reservas em Iran . No ritmo atual de consumo, essas reservas são estimadas para ser esgotado em algum momento entre 2027 e 2055. Cerca de 346 milhões de toneladas foram extraídas ao longo da história a 2002, e uma estimativa descobriu que cerca de 109 milhões de toneladas de que permanece em uso.
Isótopos
Cinco isótopos de zinco ocorre na natureza. 64: Zn é o isótopo mais abundante (48,63% abundância natural). Este isótopo tem um tal longa meia-vida , em 4,3 × 10 18 um, que a sua radioactividade pode ser ignorado. Do mesmo modo, 70 de Zn (0,6%), com uma semi-vida de 1,3 x 10 16 um não é geralmente considerado para ser radioactivo. Os outros isótopos encontrados na natureza são 66 Zn (28%), 67 de Zn (4%) e 68 de Zn (19%).
Várias dezenas radioisótopos têm sido caracterizados. Zn 65, que tem uma meia-vida de 243,66 dia, é o radioisótopo mais longa duração, seguido de Zn 72, com uma semi-vida de 46,5 horas. O zinco tem 10 nuclear isômeros. 69m Zn tem a meia-vida mais longa, 13.76 h. O expoente m indica um isótopo metastável. O núcleo de um isótopo metastável é numa estado animado e vai voltar para o estado fundamental ao emitir um fotão na forma de um Gamma Ray. 61 Zn tem três estados excitados e 73 Zn tem dois. Os isótopos de Zn 65, 71 Zn, 77 Zn e Zn 78 cada um tem apenas um estado animado.
O mais comum modo de decaimento de um radioisótopo de zinco com um número de massa menor do que 66 está captura de elétrons. O produto deterioração resultante de captura de elétrons é um isótopo de cobre.
- n
30 Zn + e - n →
29 Cu
O modo de decaimento mais comum de um radioisótopo de zinco com um número de massa maior do que 66 é decaimento beta (β -), que produz um isótopo de gálio .
- n
30 Zn → n
31 Ga + e - + ν
e
Compostos e química
Reatividade
O zinco tem uma configuração eletrônica do [Ar] 3d 10 4s 2 e é um membro da grupo 12 da tabela periódica . É um metal reactivo e moderadamente forte agente redutor. A superfície do metal puro escurece rapidamente, eventualmente formando um protector passivating camada da base carbonato de zinco, Zn 5 (OH) 6 (CO 3) 2, por reacção com atmosférica dióxido de carbono . Esta camada ajuda a evitar a reacção adicional com ar e água.
Zinco queima no ar com uma chama brilhante verde-azulado, exalando fumaça de óxido de zinco. Zinco reage prontamente com ácidos , álcalis e outros não-metais. Extremamente zinco puro reage apenas lentamente à temperatura ambiente com ácidos. Ácidos fortes, tais como o clorídrico ou ácido sulfúrico , é possível remover a camada de passivação e subsequente reacção com a água liberta gás hidrogénio.
A química de zinco é dominado pelo estado de oxidação +2. Quando os compostos neste estado de oxidação são formados a externa electrões de s são perdidos, o que produz um ião zinco nua com a configuração eletrônica [Ar] 3d 10. Em solução aquosa de um complexo octaédrico, [Zn (H2O) 6] 2+ é a espécie predominante. O volatilização de zinco em combinação com cloreto de zinco a temperaturas superiores a 285 ° C indica a formação de Zn 2 Cl 2, um composto de zinco com um estado de oxidação +1. Não há compostos de zinco em estados de oxidação, exceto um ou dois são conhecidos. Os cálculos indicam que um composto de zinco com o estado de oxidação de +4 é improvável que existam.
Química de zinco é semelhante à química do final do primeiro-fileira metais de transição de níquel e cobre, embora tenha um revestimento d cheio, para que os compostos são diamagnético e principalmente incolor. O raios iônicos de zinco e magnésio acontecer de ser quase idêntico. Devido a isto alguns dos seus sais têm a mesma estrutura de cristal e em circunstâncias em que raio iónico é um fator determinante de zinco e magnésio químicas têm muito em comum. Caso contrário, há pouca semelhança. Zinco tende a formar ligações com um maior grau de covalência e forma muito mais estáveis complexos com N - e S - doadores. Complexos de zinco são principalmente 4- ou 6- coordenar embora 5 coordenada complexos são conhecidos.
Veja também Redução de Clemmensen.
Zinco (I) compostos
Zinco (I) os compostos são raros, e requer ligantes volumosos para estabilizar o baixo estado de oxidação. A maior parte do zinco (I), compostos contém formalmente o [Zn 2] 2+ núcleo, que é análogo ao [Hg 2] 2+ catião dimérica presente em mercúrio (I) compostos. O diamagnetic natureza do íon confirma a sua estrutura dimérica. O primeiro composto de zinco (I) contendo a ligação de Zn-Zn, (Η 5 -C 5 Me 5) 2 Zn 2, é também o primeiro dimetallocene. A [Zn 2] 2+ rapidamente disproportionates em metal de zinco e de zinco (II), e apenas tem sido obtido como um vidro amarelo formado por arrefecimento de uma solução de zinco metálico em ZnCl2 fundido.
Zinco (II) compostos


Compostos binária de zinco são conhecidos para a maior parte do metalóides e todo o não-metais, excepto os gases nobres . O óxido de ZnO é um pó branco que é quase insolúvel em soluções aquosas neutras, mas é anfotérico, dissolvendo-o em ambas as soluções básicas e ácidas fortes. O outro (chalcogenides ZnS, ZnSe, e ZnTe) tem variadas aplicações em eletrônica e óptica. (Pnictogenides Zn 3 N 2, Zn 3 P 2, Como Zn 3 2 e Zn 3 Sb 2), o peróxido ( ZnO 2), o hidreto de ( ZNH 2), e o carboneto (ZNC 2) são também conhecidos. Dos quatro halogenetos, ZnF 2 tem o personagem mais iônica, enquanto os outros ( ZnCl2 , ZnBr2, e ZnI2) têm pontos de fusão relativamente baixos e são considerados como tendo carácter mais covalente.
Em soluções básicas fracas que contêm iões de Zn2 +, o hidróxido de Zn (OH) 2 forma como um branco precipitar. Em soluções alcalinas mais fortes, hidróxido este é dissolvido para formar zincatos ( [Zn (OH) 4] 2 ~). O nitrato Zn (NO 3) 2, clorato Zn (ClO 3) 2, sulfato ZnSO4, fosfato Zn 3 (PO 4) 2, molibdato ZnMoO 4, cianeto Zn (CN) 2, Zn arsenito (ASO 2) 2, arseniato de Zn (ASO 4) 2 · 8H 2 O e o cromato ZnCrO 4 (um dos poucos compostos de zinco de cor) são alguns exemplos de outros compostos inorgânicos comuns de zinco. Um dos exemplos mais simples de um composto orgânico de zinco é o de etilo ( Zn (O 2 CCH 3) 2).
Compostos de organozinco são aqueles que contêm ligações covalentes zinco-carbono. Dietilzinco ( (C 2 H 5) 2 Zn) é um reagente na química de síntese. Foi relatada pela primeira vez em 1848 a partir da reacção de zinco e iodeto de etilo, e foi o primeiro composto conhecido por conter um metal-carbono ligação sigma.
História
Uso antigo

Vários exemplos isolados da utilização de zinco impuro em tempos antigos foram descobertos. Uma estatueta possivelmente pré-histórico que contém 87,5% de zinco foi encontrado em um Sítio arqueológico em Dacian Transilvânia (atual Romênia). Ornamentos feitos de ligas que contêm 80-90% de zinco com chumbo, ferro, antimônio e outros metais que compõem o restante, foram encontrados que são 2500 anos de idade. O Berna tablet zinco é um votiva placa de namoro para Roman Gaul feito de uma liga que é principalmente zinco. Além disso, alguns escritos antigos parecem mencionar zinco. O historiador grego Estrabão, em uma passagem tirada de um escritor no início do século 4 aC, menciona "gotas de prata falsa", que, quando misturado com cobre make bronze. Isto pode referir-se pequenas quantidades de zinco por-produto de fundição minérios de sulfureto. O Charaka Samhita, que teria sido escrito em 500 aC ou antes, menciona um metal que, quando oxidado, produz pushpanjan, pensado para ser o óxido de zinco.
Minérios de zinco foram utilizados para fazer as zinco-cobre da liga de latão muitos séculos antes da descoberta de zinco, tal como um elemento separado. Bronze da Judéia de 14 a séculos 10 aC contém 23% de zinco. O livro de Gênesis, escrito entre o 10º eo quinto séculos aC, menciona (na tradução King James) Tubal-Caim como um "instrutor de cada artesão em bronze e ferro" ( Gênesis 4:22), mas desde que a palavra nechosheth, traduzido como "bronze", também significa "cobre", o significado disso não é claro. O conhecimento de como produzir bronze espalhou para Grécia Antiga por volta do século 7 aC, mas algumas variedades foram feitas.
A fabricação de bronze era conhecido pelos romanos em cerca de 30 BC. Eles fizeram de bronze por aquecimento em pó calamina (zinco silicato ou carbonato), carvão e cobre em conjunto num cadinho. O resultado calamina bronze foi então quer lançar ou martelado em forma e foi utilizado em armas. Algumas moedas cunhadas pelos romanos na era cristã são feitas de que é provavelmente calamina bronze. No Ocidente, zinco impuro era conhecido desde a antiguidade até existir nos restos em fornos de fusão, mas foi geralmente descartados, como ele foi pensado para ser inútil.
Minas de zinco em Zawar, perto Udaipur, na Índia, têm estado activos desde o Período de Mauryan no final do primeiro milênio antes de Cristo. A fundição de zinco metálico aqui no entanto parece ter começado por volta do século 12 dC. Uma estimativa é que este local produziu um número estimado de milhões de toneladas de zinco metálico e óxido de zinco de 12 a 16 séculos. Outra estimativa dá uma produção total de 60.000 toneladas de zinco metálico durante este período. O Rasaratna Samuccaya, escrito aproximadamente no século AD 13, menciona dois tipos de minérios contendo zinco; utilizado para extracção de metais e outro utilizado para fins medicinais.
Os primeiros estudos e nomeação
O zinco foi claramente reconhecido como um metal sob a designação de Yasada ou Jasada no léxico médico atribuída ao rei Hindu Madanapala e escrito sobre o ano de 1374. Fundição e extracção de zinco impuro através da redução de calamina com lã e outras substâncias orgânicas foi realizada no século 13 na Índia. Os chineses não aprendeu a técnica até o século 17.

Alquimistas queimado zinco metálico em ar e recolhido a óxido de zinco, resultando numa condensador. Alguns alquimistas chamado este zinco philosophica lana óxido, latim para "lã de filósofo", porque ele coletadas em tufos peludos enquanto outros pensavam que parecia neve branca e nomeou-o álbum nix.
O nome do metal foi provavelmente o primeiro documentado por Paracelso, um alquimista alemão nascido na Suíça, que se refere ao metal como "Zincum" ou "zinken" em seu livro Liber Mineralium II, no século 16. A palavra provavelmente é derivado do alemão Zinke, e supostamente significava "dente-like, pontiagudas ou irregulares" (cristais de zinco metálico tem uma aparência em forma de agulha). Zink também poderia implicar "tin-like" por causa de sua relação com o alemão zinn significando estanho. Ainda uma outra possibilidade é que a palavra é derivado do Palavra persa que significa pedra سنگ Seng. O metal também foi chamado indiana estanho, tutanego, calamina, e Spinter.
Metalúrgico alemão Andreas Libavius recebeu uma quantidade do que ele chamou de "Calay" de Malabar de um navio de carga capturado do Português em 1596. Libavius descritas as propriedades da amostra, o que pode ter sido zinco. O zinco foi regularmente importado para a Europa a partir do Oriente nos séculos 18 17o e cedo, mas às vezes era muito caro.
O isolamento do elemento puro

O isolamento do zinco metálico no Ocidente pode ter sido conseguida por várias pessoas independentemente. Dicionário Universal de Postlewayt, uma fonte contemporânea que dá informação tecnológica na Europa, não mencionou zinco antes de 1751, mas o elemento foi estudado antes.
Metalúrgico Flamengo PM de Respour informou que ele extraiu zinco metálico a partir do óxido de zinco em 1668. Na virada do século, Étienne François Geoffroy descreveu como o óxido de zinco condensa como cristais amarelos em barras de ferro colocados acima minério de zinco sendo fundido. Na Grã-Bretanha, John Lane disse ter realizado experimentos para fundir zinco, provavelmente em Landore, antes de sua falência em 1726.
Em 1738, William Champion patenteado na Grã-Bretanha um processo para extrair zinco a partir de calamina na posição vertical smelter estilo retorta. Sua tecnologia era um pouco semelhante ao utilizado em minas de zinco em Zawar Rajasthan mas não há nenhuma evidência de que ele visitou o Oriente. Processo de campeão foi utilizada através de 1851.
Químico alemão Andreas Marggraf normalmente recebe crédito para a descoberta de zinco metálico puro, embora químico sueco Anton von Swab destilada zinco a partir de calamina quatro anos antes. Na sua experiência 1746, Marggraf aquecida uma mistura de calamina e carvão vegetal num recipiente fechado, sem cobre para se obter um metal. Este procedimento tornou-se comercialmente viável por 1.752.
Trabalho mais tarde

O irmão de William Champion, John, patenteou um processo em 1758 para calcinação de sulfureto de zinco em óxido utilizável no processo de retorta. Antes de isso só calamina pode ser usado para produzir zinco. Em 1798, Johann Christian Ruberg melhorada no processo de fundição com a construção da primeira réplica fundição horizontal. Jean-Jacques Daniel Dony construído um tipo diferente de fundição de zinco horizontal na Bélgica, que processou ainda mais zinco. Médico italiano Luigi Galvani descobriram em 1780 que o ligando espinal medula de um sapo recém-dissecado para um trilho de ferro presa por um gancho bronze causou a perna do sapo a se contorcer. Ele incorretamente achou que tinha descoberto uma capacidade de nervos e músculos para criar eletricidade e chamado de efeito " eletricidade animal ". A célula galvânica e do processo de galvanização foram ambos nomeados por Luigi Galvani e essas descobertas abriram o caminho para baterias elétricas, galvanização e proteção catódica.
Amigo de Galvani, Alessandro Volta, continuou a investigar este efeito e inventou o Pilha de volta em 1800. A unidade básica de pilha de Volta foi um simplificado célula galvânica, que é feito de uma placa de cobre e uma placa de zinco ligados uns aos outros e separados externamente por um electrólito. Estes foram empilhadas em série para fazer a pilha voltaica, que por sua vez produzida electricidade, orientando electrões do zinco para o cobre e o zinco permitindo a corrosão.
O caráter não-magnético de zinco e sua falta de cor em solução adiada descoberta da sua importância para a bioquímica e nutrição. Isso mudou em 1940, quando anidrase carbónica, uma enzima que esfrega dióxido de carbono a partir de sangue, foi demonstrado que têm de zinco na sua sítio ativo. A enzima digestiva carboxipeptidase tornou-se a segunda enzima contendo zinco conhecidos em 1955.
Produção
Mineração e processamento
| Categoria | País | Toneladas |
|---|---|---|
| 1 | | 3500000 |
| 2 | | 1520000 |
| 3 | | 1,450,000 |
| 4 | | 750.000 |
| 5 | | 720.000 |
| 6 | | 670.000 |
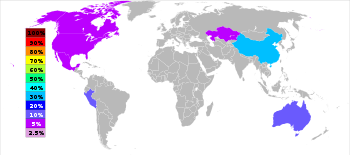
O zinco é o quarto metal mais comum em uso, ficando atrás apenas de ferro, alumínio e cobre com uma produção anual de cerca de 12 milhões de toneladas. Maior produtora de zinco do mundo é Nyrstar, uma fusão do Australian OZ Minerals e da Bélgica Umicore. Cerca de 70% de zinco do mundo provém de mineração, enquanto os restantes 30% vem da reciclagem de zinco secundário. Zinco puro comercialmente é conhecido como Special High Grade, SHG muitas vezes abreviado, e é 99,995% puro.
Em todo o mundo, 95% do zinco é extraído a partir de sulfidic depósitos de minério, na qual esfalerite ZnS é quase sempre misturados com os sulfuretos de cobre, chumbo e ferro. Há minas de zinco em todo o mundo, com as principais áreas de mineração, sendo China, Austrália e Peru. A China produziu 29% da produção mundial de zinco em 2010.
O zinco metálico é produzido usando metalurgia extrativa. Após a trituração do minério, flutuação de espuma, que separa selectivamente minerais ganga, tirando partido das diferenças na sua hidrofobicidade, é usado para obter um concentrado de minério. Uma concentração final de zinco de cerca de 50% é atingido pelo presente processo com o restante sendo o concentrado de enxofre (32%), ferro (13%), e SiO2 (5%).
Torrefacção converte o concentrado de sulfureto de zinco produzidos durante o processamento de óxido de zinco:
- 2 ZnS + 3 O 2 → 2 ZnO + 2 SO 2
O dióxido de enxofre é utilizado para a produção de ácido sulfúrico, que é necessário para o processo de lixiviação. Se os depósitos de carbonato de zinco, silicato de zinco ou zinco espinélio, como o Skorpion Depósito na Namíbia são utilizados para a produção de zinco da torrefação pode ser omitida.
Para processamento adicional dois métodos básicos são utilizados: pirometalurgia ou electrowinning. Processamento Pirometalurgia reduz o óxido de zinco com carbono ou monóxido de carbono a 950 ° C (1740 ° F) no interior do metal, que é destilado na forma de vapor de zinco. O vapor de zinco é coletado em um condensador. O conjunto de equações abaixo demonstram este processo:
- 2 ZnO + C → 2 Zn + 2 CO
- ZnO + CO → Zn + CO 2
Processamento de separação electrolítica de zinco lixiviado do concentrado de minério de ácido sulfúrico :
- ZnO + H 2 SO 4 → ZnSO 4 + H2O
Após este passo de electrólise é utilizado para a produção de metal de zinco.
- 2 ZnSO 4 + 2 H2O → 2 Zn + 2 H 2 SO 4 + O2
O ácido sulfúrico regenerado é reciclado para o passo de lixiviação.
Impacto ambiental
A produção de minérios de zinco sulfidic produz grandes quantidades de dióxido de enxofre e cádmio vapor. Smelter escórias e outros resíduos de processo também conter quantidades significativas de metais pesados. Cerca de 1,1 milhões de toneladas de zinco metálico e 130 mil toneladas de chumbo foram minadas e fundidos nas cidades belgas de La Calamine e Plombières entre 1806 e 1882. Os depósitos das operações de mineração últimos valores de lixiviação significativas de zinco e cádmio, e, como resultado, os sedimentos do Rio geul contêm quantidades significativas de metais pesados. Cerca de dois mil anos atrás, as emissões de zinco de mineração e fundição totalizaram 10.000 toneladas por ano. Após um aumento de 10 vezes de 1850, as emissões de zinco atingiu um pico de 3,4 milhões de toneladas por ano na década de 1980 e recusou-se a 2,7 milhões de toneladas na década de 1990, apesar de um estudo da troposfera Arctic 2005 descobriu que as concentrações não fez refletem o declínio. Emissões Anthropogenic e naturais ocorrem em uma proporção de 20 para 1.
Os níveis de zinco em rios que atravessam zonas industriais ou de mineração pode ser tão elevada como 20 ppm. Eficaz tratamento de esgoto reduz muito este; tratamento ao longo do Reno , por exemplo, diminuiu os níveis de zinco a 50 ppb. As concentrações de zinco tão baixo como 2 ppm afeta negativamente a quantidade de oxigênio que o peixe pode transportar no seu sangue.

Solos contaminados com zinco através da extracção de minérios que contenham zinco, refinação, ou onde as lamas contendo zinco é usado como fertilizante, pode conter vários gramas de zinco por quilo de solo seco. Os níveis de zinco em excesso de 500 ppm no solo interferir com a capacidade das plantas para absorver outra metais essenciais, tais como ferro e manganês . Os níveis de zinco de 2.000 ppm para 180 mil ppm (18%) foram registrados em algumas amostras de solo.
Aplicações
As principais aplicações de zinco incluem (os números são dados para os EUA)
- Galvanização (55%)
- Ligas (21%)
- Latão e bronze (16%)
- Diversos (8%)
Anti-corrosão e baterias

O metal é mais vulgarmente utilizado como um agente anti-corrosão. A galvanização, que é o revestimento de ferro ou de aço para proteger os metais contra a corrosão , é a forma mais conhecida de zinco usando nesta forma. Em 2009, nos Estados Unidos, 55% ou 893 mil toneladas do metal de zinco foi usado para galvanização.
O zinco é mais reativo do que ferro ou aço e, portanto, vai atrair quase todos oxidação local até que completamente corrói distância. Uma camada protectora de óxido de superfície e de carbonato de (5 Zn (OH) 6 (CO 3) 2) formas como as corrói zinco. Essa proteção dura mesmo depois da camada de zinco está riscado, mas degrada ao longo do tempo como o zinco corrói distância. O zinco é aplicada electroquimicamente ou como zinco fundido por galvanização por imersão a quente ou a pulverização. Galvanização é usado em cercas elo da cadeia, guarda-corpos, pontes suspensas, lightposts, telhados de metal, trocadores de calor, e carrocerias.
A reactividade relativa de zinco e a sua capacidade para atrair a oxidação em si torna-se uma eficiente ânodo de sacrifício em proteção catódica (CP). Por exemplo, a protecção catódica de uma conduta enterrada pode ser conseguido ligando os ânodos feitos a partir de zinco para o tubo. O zinco age como o ânodo (terminal negativo) por lentamente corroendo distância que passa corrente elétrica para o encanamento de aço. O zinco também é usado para proteger catodicamente metais que estão expostos à água do mar a partir de corrosão. Um disco de zinco anexado ao leme de um navio de ferro lentamente vai corroer, enquanto o leme permanece inatacada. Outros usos similares incluem um plugue de zinco ligado a uma hélice ou a guarda de proteção de metal para a quilha do navio.
Com um potencial de eléctrodo padrão (SEP) de -0,76 volt , o zinco é utilizado como um material de ânodo para pilhas. (Lítio mais reactivo (SEP -3,04 V) é utilizado para ânodos em baterias de lítio). Zinco em pó é utilizado nesta forma em pilhas e folhas de zinco metálico alcalinas formar os casos para e agir como ânodos em pilhas de zinco-carbono. O zinco é usado como ânodo ou do combustível célula de bateria / combustível zinco-ar.
Alloys
Uma liga amplamente utilizada, que contém o zinco é de latão, em que o cobre está ligado com qualquer lugar a partir de 3% a 45% de zinco, dependendo do tipo de bronze. O bronze é geralmente mais dúctil e mais forte do que o cobre e tem excelente resistência à corrosão . Estas propriedades torná-lo útil em equipamentos de comunicação, hardware, instrumentos musicais, e válvulas de água.

Outras ligas amplamente usados que contenham zinco incluem prata níquel, máquina de escrever metal, macia e alumínio solda, e comercial bronze. O zinco também é usado em órgãos de tubos contemporâneos como um substituto para a liga de chumbo / estanho em tubos tradicional. As ligas de 85-88% de zinco, 4-10% de cobre, e 2-8% de alumínio encontrar uso limitado em certos tipos de rolamentos de máquinas. O zinco é o metal principal utilizado em fazer Americana moedas de um cent desde 1982. O núcleo de zinco é revestida com uma fina camada de cobre para dar a impressão de uma moeda de cobre. Em 1994, 33.200 toneladas (36.600 toneladas curtas) de zinco foram usados para produzir 13,6 bilhões de moedas de um centavo nos Estados Unidos.
As ligas de principalmente zinco com pequenas quantidades de cobre, alumínio, magnésio e são úteis no fundição, bem como girar casting, especialmente nas indústrias elétrica e hardware automotivo. Estas ligas são comercializados sob o nome Zamak. Um exemplo disto é alumínio zinco. O baixo ponto de fusão em conjunto com a baixa viscosidade da liga torna a produção de pequenas e formas intrincadas possível. A baixa temperatura de trabalho leva a refrigeração rápida dos produtos fundidos e montagem rápida, por conseguinte, é possível. Outra liga, comercializado sob o nome de marca Prestal, contém 78% de zinco e 22% de alumínio e é relatada como sendo quase tão forte como aço, mas como maleável como o plástico. Este superplasticidade da liga permite que ele seja moldado usando moldes de matrizes de cerâmica e de cimento.
Ligas semelhantes com a adição de uma pequena quantidade de chumbo pode ser laminada a frio em folhas. Uma liga de 96% de zinco e 4% de alumínio é usado para fazer matrizes de estampar para aplicações de baixo ciclo de produção para os quais as fieiras de metais ferrosos seria muito caro. Na construção de fachadas, telhados ou outras aplicações nas quais o zinco é usado como folha de metal e para métodos tais como estampagem profunda, rolo de formação ou Curvar-se, ligas de zinco com titânio e cobre são usados. Zinco não ligado que é demasiado frágil para estes tipos de processos de fabricação.
Como um material denso barato, facilmente trabalhado, o zinco é utilizado como uma ligação de substituição. Na esteira da preocupações de chumbo, zinco aparece em pesos para diversas aplicações que vão desde a pesca saldos de pneus e volantes.
Telureto de cádmio e zinco (CZT) é um semicondutor de liga que pode ser dividida em uma matriz de pequenos dispositivos de detecção. Estes dispositivos são semelhantes a um circuito integrado e pode detectar a energia de entrada fótons de raios gama. Quando colocada por detrás de uma máscara de absorção, o conjunto de sensores CZT também pode ser utilizado para determinar a direcção dos raios.
Outros usos industriais

Cerca de um quarto de todas as saídas de zinco nos Estados Unidos (2009), é consumido sob a forma de compostos de zinco; uma variedade dos quais são usados industrialmente. O óxido de zinco é amplamente usado como um pigmento branco nas tintas, e, como catalisador no fabrico de borracha. É também usado como um dispersor de calor para a borracha e actua de modo a proteger os seus polímeros de radiação ultravioleta (UV a mesma protecção que é conferido ao plástico que contêm óxido de zinco). Os semicondutores propriedades do óxido de zinco torná-lo útil em varistores e produtos fotocopiadora. O ciclo de zinco-óxido de zinco é um dois passos termoquímico processo com base em zinco e óxido de zinco para produção de hidrogênio.
O cloreto de zinco é frequentemente adicionado a madeira como um retardadora de fogo e pode ser usado como uma madeira conservante. É também usado para fazer outros produtos químicos. Metil Zinco (Zn (CH 3 2)) é utilizado em uma série de compostos orgânicos sínteses. Sulfureto de zinco (ZnS) é usado em pigmentos luminescentes, como nas mãos de relógios, Raios-X e telas de televisão, e tintas luminosas. Cristais de ZnS são usados em lasers que operam em meados da década parte infravermelha do espectro. O sulfato de zinco é um produto químico em corantes e pigmentos. Piritiona de zinco é usado na tintas anti-incrustantes.
Pó de zinco é por vezes usado como um propulsor foguetes modelo. Quando uma mistura comprimida de 70% de zinco e 30% de enxofre em pó é inflamada há uma reacção química violenta. Isto produz o sulfureto de zinco, em conjunto com grandes quantidades de gás quente, calor e luz. Folha de metal de zinco é utilizado para fazer de zinco bares.
64 Zn , o isótopo mais abundante de zinco, é muito susceptível a activação de neutrões, sendo transmutado altamente radioactivos para o 65 Zn , o qual tem uma meia-vida de 244 dias, e produz intensa radiação gama. Devido a isso, óxido de zinco utilizado em reactores nucleares como um anti- agente de corrosão está esgotado de 64 Zn antes da utilização, isto é chamado de óxido de zinco esgotado. Pela mesma razão, o zinco tem sido proposto como um material de salga para armas nucleares ( cobalto é outra, melhor conhecido material de salga). Um revestimento de isotopicamente enriquecido 64 de Zn iria ser irradiado pela intensa de neutrões do fluxo de alta energia a partir de uma arma termonuclear explodir, a formação de uma grande quantidade de 65 Zn, aumentando significativamente a radioactividade da arma cair. Tal arma não é conhecida como tendo sido já construída, testado, ou usado. 65 Zn também é utilizado como um marcador para estudar como ligas que contêm zinco desgaste, ou o caminho e o papel do zinco em organismos.
Complexos ditiocarbamato de zinco são usadas como agrícolas fungicidas; esses incluem Zineb, metirame, propinebe e Ziram. Naftenato de zinco é usado na preservação da madeira. O zinco, sob a forma de ZDDP, também é usado como um aditivo anti-desgaste de peças metálicas em óleo do motor.
Suplemento alimentar

O zinco é incluído na maioria dos tablets único over-the-counter vitaminas e diárias suplementos minerais. As preparações incluem óxido de zinco, acetato de zinco, e gluconato de zinco. Acredita-se que possuem antioxidantes , propriedades que podem proteger contra o envelhecimento acelerado da pele e dos músculos do corpo; estudos diferem quanto à sua eficácia. O zinco também ajuda a acelerar o processo de cicatrização após uma lesão. É também benéfico para o sistema imunitário do corpo. De facto, a deficiência de zinco pode ter efeitos sobre praticamente todas as partes do sistema imunitário humano. O zinco ajuda a estimular a ação de mais de 100 enzimas e ajuda a estimular o sentido do olfato.
A eficácia de compostos de zinco, quando usado para reduzir a duração ou gravidade defriosintomas é controverso. A 2011 revisão sistemática conclui que a suplementação produz uma ligeira diminuição na duração e gravidade dos sintomas da constipação.
O zinco serve como uma ferramenta simples, barata, e crítico para o tratamento de episódios de diarréia entre as crianças no mundo em desenvolvimento. O zinco torna-se empobrecido no organismo durante a diarréia , mas estudos recentes sugerem que a reposição de zinco com um curso de 10 a 14 dias de tratamento pode reduzir a duração e gravidade dos episódios de diarréia e pode também prevenir futuros episódios por até três meses.
O Age-Related Eye Disease Study determinado que o zinco pode ser parte de um tratamento eficaz para a degeneração macular relacionada com a idade. A suplementação com zinco é um tratamento eficaz para acrodermatite enteropática, uma absorção de zinco doença genética que afeta que anteriormente era fatal para bebês nascidos com ele.
A gastroenterite é fortemente atenuado pela ingestão de zinco, e este efeito pode ser devido a orientar a acção antimicrobiana dos iões de zinco no tracto gastrointestinal, ou para a absorção do zinco e re-libertação a partir de células imunitárias (todos os granulócitos secretar zinco), ou ambos. Em 2011, pesquisadores da Faculdade John Jay de Justiça Criminal informou que suplementos de zinco na dieta pode mascarar a presença de drogas na urina. Alegações semelhantes foram feitas em fóruns da web sobre o assunto.
Embora ainda não testados como uma terapia em seres humanos, um crescente corpo de evidência indica que o zinco pode matar preferencialmente as células de cancro da próstata. Porque o zinco naturalmente casas para a próstata e porque a próstata é acessível com procedimentos relativamente não invasivos, o seu potencial como um agente quimioterapêutico, neste tipo de cancro mostrou-se promissor. No entanto, outros estudos demonstraram que o uso crônico de suplementos de zinco em excesso da dose recomendada pode realmente aumentar a chance de desenvolver câncer de próstata, também provavelmente devido ao acúmulo natural desse metal pesado na próstata.
O uso tópico
A administração tópica das preparações de zinco incluem aqueles usados sobre a pele, muitas vezes sob a forma de óxido de zinco. preparações de zinco pode proteger contra a queimadura solar no verão e no inverno windburn. Aplicado numa camada fina área de fralda de um bebê ( períneo) com cada mudança de fralda, ele pode proteger contra assaduras.
Zinco lactato é usado em pasta de dentes para evitar halitose. piritionato de zinco é aplicada extensamente em xampus devido à sua função anti-caspa. Íons de zinco são eficazes agentes antimicrobianos, mesmo em baixas concentrações.
Utilização em química orgânica

Há muitos importantes compostos de organozinco. Organozinco química é a ciência de compostos organo descrevendo suas propriedades físicas, síntese e reações. Entre as aplicações importantes é a reacção Frankland-Duppa em que um oxalato éster (ROCOCOOR) reage com um halogeneto de alquilo R'X, zinco e ácido clorídrico para os ésteres hidroxicarboxílico-α RR'COHCOOR, a reacção que converte Reformatskii α-halo-ésteres e aldeídos a-hidroxi-ésteres β, a reacção de Simmons-Smith, em que o iodeto de carbenóides (iodometil) de zinco reage com alceno (ou alcino) e converte-os a ciclopropano, a reacção de adição de compostos de organozinco para compostos de carbonilo. O reacção Barbier (1899), que é o equivalente de zinco do magnésio reacção de Grignard e é melhor dos dois. Na presença de praticamente qualquer água a formação do haleto organomagn�io irá falhar enquanto a reação Barbier pode até mesmo ter lugar na água. Nas organozincs descendentes são muito menos do que nucleof�ico Grignards, são caros e difíceis de lidar. Comercialmente disponíveis são compostos diorganozinc dimetilzinco, dietilzinco e difenilzinco. Em um estudo activo o composto de organozinco é obtido a partir de muito mais barata precursores organobromadas:
O Acoplamento de Negishi é também uma importante reacção para a formação de novas ligações carbono-carbono entre os átomos de carbono não saturados em alquenos, arenos e alcinos. Os catalisadores estão níquel e paládio. Um passo chave no ciclo catalítico é uma transmetalação no qual um halogeneto de zinco troca seu substituinte orgânico para outro halogénio com o centro metálico de paládio (níquel). O Fukuyama acoplamento é uma outra reacção de acoplamento, mas desta vez com um tioéster como reagente formar uma cetona.
Papel biológico
O zinco é um elemento essencial oligoelemento, necessário para plantas, animais, e microrganismos. zinco é encontrado em quase 100 específicas enzimas (outras fontes dizem 300), serve como íons estruturais nos fatores de transcrição e são armazenados e transferidos em metalotioneinas. É ", tipicamente o segundo mais abundante de metal de transição em organismos" depois de ferro e é o único metal que aparece em todas as classes de enzimas.
Em proteínas, os iões Zn são frequentemente coordenado para as cadeias laterais de aminoácido de ácido aspártico, ácido glutâmico, cisteína e histidina. A descrição teórica e computacional desta ligação em proteínas de zinco (assim como o de outros metais de transição) é difícil.
Há 2-4 gramas de zinco distribuídas por todo o corpo humano. A maior parte do zinco é no cérebro, músculo, osso, rim, fígado e, com as concentrações mais elevadas na próstata e partes do olho. Semen é particularmente rico em zinco, que é um fator chave na função da glândula da próstata e crescimento órgão reprodutor.
Nos seres humanos, o zinco desempenha funções biológicas "omnipresentes". Interage com "uma ampla gama de orgânicos ligandos ", e tem papéis no metabolismo de RNA e DNA, a transdução de sinal, e a expressão do gene. também regula apoptose. Um estudo de 2006 estima-se que cerca de 10% das proteínas humanas (2800) se ligam potencialmente zinco, além a centenas que transportam tráfego e zinco; um semelhante in silico estudo na planta Arabidopsis thaliana encontrados 2.367 proteínas relacionadas com zinco.
No cérebro, o zinco é armazenado em específicos vesículas sinápticas por neurónios glutamatérgicos e pode "modular a excitabilidade cerebral". Ela desempenha um papel fundamental na plasticidade sináptica e assim na aprendizagem. No entanto, tem sido chamado de "cavalo escuro do cérebro", uma vez que também pode ser uma neurotoxina, sugerindo zinco homeostase desempenha um papel fundamental no funcionamento normal do cérebro e sistema nervoso central.
Enzimas
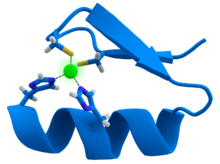
O zinco é um eficiente ácido de Lewis, tornando-se um agente catalisador útil na hidroxilação e outras reacções enzimáticas. O metal também tem uma forma flexível geometria de coordenação, que permite que as proteínas de usá-lo a deslocar-se rapidamente conformações para realizar reacções biológicas. Dois exemplos de enzimas contendo zinco são anidrase carbónica e carboxipeptidase, que são vitais para os processos de dióxido de carbono ( CO 2 ) a regulação e digestão de proteínas, respectivamente.
Em sangue de vertebrados, anidrase carbónica converte CO 2 em bicarbonato e a mesma enzima transforma o bicarbonato de volta em CO 2 para a exalação através dos pulmões. Sem esta enzima, esta conversão ocorreria cerca de um milhão de vezes mais lento no sangue normal de pH de 7 ou exigiria um pH de 10 ou mais. A anidrase carbónica β-não-relacionado é necessária em plantas para a formação de folha, a síntese de indol ácido acético (auxina) e fermentação alcoólica.
Cliva as ligações peptídicas carboxipeptidase durante a digestão de proteínas. A coordenam ligação covalente formada entre o péptido de terminal e um grupo C = O ligado ao zinco, que dá ao carbono uma carga positiva. Isto ajuda a criar uma bolsa hidrofóbica sobre a enzima perto do zinco, o que atrai a parte não polar de a proteína ser digerida.
Outras proteínas
O zinco tem um papel puramente estrutural em dedos de zinco, torções e clusters. Os dedos de zinco formar partes de alguns factores de transcrição, que são proteínas que reconhecem sequências de bases de ADN durante a replicação e transcrição de ADN . Cada um dos nove ou dez Zn 2+ iões em um dedo de zinco ajuda a manter a estrutura do dedo por coordenadamente ligação a quatro aminoácidos no factor de transcrição. O factor de transcrição envolve a hélice de DNA e utiliza os seus dedos para se ligar de forma precisa para a sequência de ADN.
Em O plasma sanguíneo, o zinco está ligado a e transportada por albumina (60%, de baixa afinidade) e transferrina (10%). Desde transferrina também transporta ferro, ferro excessiva reduz a absorção de zinco, e vice-versa. Uma reacção semelhante ocorre com o cobre. A concentração de zinco no plasma sanguíneo permanece relativamente constante, independentemente da ingestão de zinco. As células na glândula salivar, próstata, sistema imunológico e à utilização intestino sinalização de zinco como uma maneira para comunicar com outras células.
Zinco pode ser realizada em reservas metalotioneína dentro de microorganismos ou nos intestinos ou fígado dos animais. Metalotioneina nas células intestinais é capaz de ajustar a absorção de zinco por 15-40%. No entanto, a ingestão inadequada ou excessiva de zinco pode ser prejudicial; o excesso de zinco em particular prejudica a absorção de cobre porque absorve metalotioneína ambos os metais.
A ingestão alimentar

Em os EUA, o Recommended Dietary Allowance (RDA) é de 8 mg / dia para mulheres e 11 mg / dia para homens. Consumo médio em os EUA por volta de 2000 foi de 9 mg / dia para mulheres e 14 mg / dia nos homens. Ostras, lagosta e carnes vermelhas, especialmente carne bovina , de cordeiro e fígado têm algumas das maiores concentrações de zinco em alimentos.
A concentração de zinco nas plantas varia de acordo com os níveis do elemento no solo. Quando existe zinco suficiente no solo, as plantas alimentares que contêm a maior parte do zinco são trigo (germe e farelo) e várias sementes ( sésamo , papoila, alfafa, aipo , mostarda). O zinco também é encontrado em feijões , nozes , amêndoas , cereais integrais, sementes de abóbora, sementes de girassol e groselha.
Outras fontes incluem alimentos fortificados e suplementos dietéticos, que vêm em várias formas. Uma avaliação 1998 concluiu que o óxido de zinco, um dos suplementos mais comuns nos Estados Unidos, e carbonato de zinco são quase insolúveis e fracamente absorvidos no corpo. Esta avaliação citou estudos que encontraram as concentrações plasmáticas de zinco depois de óxido de zinco e carbonato de zinco foram consumidas em comparação com as observadas após o consumo de acetato de zinco e sais de sulfato. No entanto, a suplementação excessiva prejudicial é um problema entre os relativamente afluente, e provavelmente não deve exceder 20 mg / dia, em pessoas saudáveis, embora o Conselho Nacional de Pesquisa dos Estados Unidos estabeleceu um ingestão tolerável de 40 mg / dia.
Para fortificação, no entanto, uma revisão de 2003 recomendado óxido de zinco em cereais como baratas, estável, e como facilmente absorvida como formas mais caros. Um estudo de 2005 descobriu que vários compostos de zinco, incluindo óxido e sulfato, não apresentaram diferenças estatisticamente significativas na absorção quando adicionados como fortificantes ao milho tortillas. Um estudo de 1987 descobriu que o picolinato de zinco foi melhor absorvido do que gluconato de zinco ou citrato de zinco. No entanto, um estudo publicado em 2008 determinou que glicinato de zinco é o melhor absorvido um dos quatro tipos de suplementos alimentares disponíveis.
Deficiência
A deficiência de zinco é geralmente devido à ingestão insuficiente, mas pode ser associado a má absorção, acrodermatite enteropática, doença hepática crônica, doença renal crônica, doença falciforme, diabetes, câncer e outras doenças crônicas. Os sintomas de deficiência de zinco leve são diversas. Os resultados clínicos incluem crescimento, diarréia, impotência e de maturação sexual, retardados deprimido alopecia, lesões de pele e olhos, apetite prejudicada, cognição alterada, Propriedades defesa do hospedeiro prejudicada, defeitos de utilização de carboidratos, e teratogênese reprodutiva. Deficiência de zinco leve deprime a imunidade, apesar de zinco excessivo faz também. Os animais com uma dieta deficiente em zinco exigem duas vezes mais alimentos, a fim de atingir o mesmo ganho de peso como animais que receberam zinco suficiente.
Os grupos de risco para a deficiência de zinco incluem os idosos, crianças em países em desenvolvimento, e aqueles com insuficiência renal. O zinco quelante de fitato, encontrada em sementes e cereais farelo , pode contribuir para a má absorção de zinco.
Apesar de algumas preocupações, os vegetarianos e vegans ocidentais não foram encontrados a sofrer de deficiências de zinco evidentes mais do que comedores de carne. As principais fontes vegetais de zinco incluem feijão cozido secas, vegetais do mar, cereais fortificados, soyfoods, nozes, ervilha e sementes. No entanto, fitatos em muitos grãos integrais e fibras em muitos alimentos podem interferir com efeitos a absorção de zinco e ingestão marginal de zinco tem mal compreendidos. Há algumas evidências que sugerem que mais do que a RDA dos EUA (15 mg) de zinco por dia, pode ser necessário em aqueles cuja dieta é alta em fitatos, tais como alguns vegetarianos. Estas considerações devem ser ponderados com o fato de que há uma escassez de zinco adequados biomarcadores, eo indicador mais utilizado, zinco plasma, tem uma fraca sensibilidade e especificidade. Diagnóstico de deficiência de zinco é um desafio persistente.
Cerca de dois bilhões de pessoas no mundo em desenvolvimento são deficientes em zinco. Em crianças, causa um aumento na infecção e diarreia, que contribui para a morte de crianças em todo o mundo cerca de 800.000 por ano. A Organização Mundial da Saúde defende a suplementação de zinco para desnutrição severa e diarréia. Suplementos de zinco ajudar a prevenir doenças e reduzir a mortalidade, especialmente entre crianças com baixo peso ao nascer ou o crescimento atrofiado. No entanto, os suplementos de zinco não deve ser administrado sozinho, uma vez que muitas pessoas no mundo em desenvolvimento têm várias deficiências, e zinco interage com outros micronutrientes.
A deficiência de zinco é a deficiência de micronutrientes mais comum plantas de cultura '; é particularmente comum em solos de pH alto. Zinco com deficiência de solo é cultivado na área plantada de cerca de metade da Turquia e da Índia, um terço da China, e mais da Austrália Ocidental, e as respostas substanciais ao zinco fertilização foram relatados nestas áreas. As plantas que crescem em solos que são deficientes de zinco são mais susceptíveis à doença. O zinco é adicionado principalmente para o solo através do intemperismo das rochas, mas os seres humanos têm adicionado zinco através da combustão de combustíveis fósseis, resíduos de minas, fertilizantes fosfatados, calcário, estrume, lamas de depuração, e partículas de superfícies galvanizadas. O excesso de zinco é tóxico para as plantas, embora a toxicidade de zinco é muito menos comum.
Precauções
Toxicidade
Embora o zinco é um requisito essencial para a boa saúde, o excesso de zinco pode ser prejudicial. Absorção em excesso de zinco suprime a absorção de cobre e ferro. O ião de zinco livres em solução é altamente tóxico para as plantas, invertebrados e vertebrados mesmo peixe. O Modelo de atividade livre de iões está bem estabelecida na literatura, e mostra que apenas quantidades micromolares de ião livre mata alguns organismos. Um exemplo recente mostrou 6 micromolar matando 93% de toda a Daphnia em água.
O íon zinco livre é um poderoso ácido de Lewis até ao ponto de ser corrosivo. O ácido do estômago contém ácido clorídrico , no qual o zinco metálico se dissolve facilmente para dar o cloreto de zinco corrosivo. A ingestão de uma americana uma pós-1982 peça cento (97,5% de zinco) podem causar danos no revestimento do estômago devido à elevada solubilidade do ião de zinco no ácido do estômago.
Há evidências de induzida deficiência de cobre em baixa ingestão de 100-300 mg Zn / dia; um recente julgamento teve hospitalizações mais elevados para complicações urinárias em comparação com placebo entre os homens idosos a tomar 80 mg / dia. O USDA RDA é de 11 e 8 mg Zn / dia para homens e mulheres, respectivamente. Níveis ainda mais baixos, mais perto da RDA, pode interferir com a utilização de cobre e ferro ou afetar negativamente o colesterol. Os níveis de zinco em excesso de 500 ppm no solo interferir com a capacidade das plantas de absorver outros metais essenciais, tais como ferro e manganês. Há também uma condição chamada os batidos de zinco ou de zinco "" calafrios que podem ser induzidas pela inalação de óxido de zinco recentemente formado formado durante a soldadura de materiais galvanizados. O zinco é um ingrediente comum de prótese creme que pode conter entre 17 e 38 mg de zinco por grama. Houve casos de deficiência ou mesmo morte devido ao uso excessivo desses produtos.
Os EUA Food and Drug Administration (FDA) declarou que danifica zinco receptores nervosos no nariz, que podem causar anosmia. Relatos de anosmia também foram observadas na década de 1930, quando as preparações de zinco foram usados em uma tentativa fracassada para impedir pólio infecções. Em 16 de junho de 2009, a FDA disse que os consumidores devem parar de usar intranasais produtos frios à base de zinco e ordenou a sua remoção das prateleiras das lojas. O FDA disse que a perda de olfato pode ser fatal porque as pessoas com cheiro danificada não pode detectar vazamento de gás ou fumaça e não pode dizer se a comida estragou antes de comê-lo. Pesquisas recentes sugerem que o piritionato de zinco tópica antimicrobiana é um potente indutor de resposta ao choque térmico que pode prejudicar a integridade genômica com a indução da crise energética dependente de PARP em humanos cultivados queratinócitos e melanócitos.
Intoxicação
Em 1982, o United States Mint começou a cunhagem de moedas de um centavo revestidos em cobre, mas essencialmente à base de zinco. Com as novas moedas de zinco, existe o potencial para a toxicose de zinco, que pode ser fatal. Um caso relatado de ingestão crônica de 425 moedas de um centavo (mais de 1 kg de zinco) resultou em morte devido a bactérias e fungos gastrointestinal sepse, enquanto outro paciente, que ingeriu 12 gramas de zinco, só mostrou letargia e ataxia (gross falta de coordenação dos movimentos musculares) . Vários outros casos foram relatados de seres humanos que sofrem intoxicação pela ingestão de zinco de moedas de zinco.
Centavos e outras moedas pequenas são por vezes ingerido pelos cães, resultando na necessidade de tratamento médico para remover o corpo estranho. O teor de zinco de algumas moedas pode causar toxicidade do zinco, que é normalmente fatal em cães, onde causa uma severa anemia hemolítica, e também lesões no fígado e no rim; vômitos e diarréia são possíveis sintomas. O zinco é altamente tóxico em papagaios e envenenamento muitas vezes pode ser fatal. O consumo de sucos de frutas armazenados em latas galvanizadas resultou em envenenamentos papagaio em massa com zinco.
