
Disprosio
Sabías ...
SOS Children han producido una selección de artículos de Wikipedia para escuelas desde 2005. Niños Patrocinadoras ayuda a los niños en el mundo en desarrollo para aprender también.
| Disprosio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
66 Dy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanco plateado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | disprosio, Dy, 66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / d ɪ s p r oʊ z yo ə m / dis- PROH -zee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | lantánidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 6, F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 162.500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 10 6s 2 2, 8, 18, 28, 8, 2 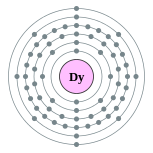 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Lecoq de Boisbaudran (1886) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 8,540 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 8,37 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1680 K , 1407 ° C, 2565 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2840 K, 2562 ° C, 4653 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 11.06 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 280 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 27.7 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 (Débilmente óxido básico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,22 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 573.0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1130 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2200 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 178 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 192 ± 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético a 300 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | ( rt) (α, poli) 926 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 10.7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | ( rt) (α, poli) 9,9 m / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 2710 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | (Forma α) 61,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | (Forma α) 24,7 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | (Forma α) 40,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | (Forma α) 0,247 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 540 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7429-91-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de disprosio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Disprosio es un elemento químico con el símbolo Dy y número atómico 66. Es un elemento tierra rara con un brillo de plata metálica. Disprosio nunca se encuentra en la naturaleza como un elemento libre, a pesar de que se encuentra en varios minerales, tales como xenotima. Naturalmente disprosio ocurriendo está compuesto de 7 isótopos , el más abundante de que es 164 Dy.
Disprosio se identificó por primera vez en 1886 por Paul Émile Lecoq de Boisbaudran, pero no fue aislado en forma pura hasta el desarrollo de técnicas de intercambio de iones en la década de 1950. Disprosio se utiliza para la sección transversal de absorción de neutrones térmicos de alta su en la toma de las barras de control en reactores nucleares, por su alto susceptibilidad magnética en aplicaciones de almacenamiento de datos, y como un componente de Terfenol-D. Sales de disprosio solubles son ligeramente tóxico, mientras que las sales insolubles se consideran no tóxicos.
Características
Propiedades físicas

Disprosio es una raro elemento tierra que tiene un metálico, el lustre plateado brillante. Es lo suficientemente suave para ser cortado con un cuchillo, y se puede mecanizar sin provocar si se evita el sobrecalentamiento. Las características físicas del disprosio se verá muy afectada incluso por pequeñas cantidades de impurezas.
Disprosio y holmio tienen las fortalezas magnéticos más altos de los elementos, especialmente a bajas temperaturas. Disprosio tiene un sencillo ordenamiento ferromagnético a temperaturas inferiores a 85 K (-188,2 ° C). Por encima de 85 K (-188,2 ° C), se convierte en un helicoidal Estado antiferromagnética en el que todos los momentos atómicos en una determinada capa de plano basal son paralelas, y se orienta en un ángulo fijo a los momentos de capas adyacentes. Esta inusual antiferromagnetismo transforma en una desordenada ( paramagnético) estado en 179 K (-94 ° C).
Propiedades químicas
Disprosio de metal empaña lentamente en el aire y se quema fácilmente para formar disprosio (III) óxido de:
- 4 Dy + 3 O 2 → 2 Dy 2 O 3
Disprosio es muy electropositivo y reacciona lentamente con el agua fría y bastante rápidamente con agua caliente para formar hidróxido de disprosio:
- 2 Dy (s) + 6 H2O (l) → 2 Dy (OH) 3 (ac) + 3 H 2 (g)
Disprosio metálico reacciona vigorosamente con todos los halógenos por encima de 200 ° C:
- 2 Dy (s) + 3 F 2 (g) → 2 DyF 3 (s) [verde]
- 2 Dy (s) + 3 Cl 2 (g) → 2 DyCl 3 (s) [blanco]
- 2 Dy (s) + 3 Br 2 (g) → 2 DyBr 3 (s) [blanco]
- 2 Dy (s) + 3 I 2 (g) → 2 dyi 3 (s) [verde]
Disprosio se disuelve fácilmente en diluida de ácido sulfúrico para formar soluciones que contienen el Dy amarillo (III) iones, que existen como un [Dy (OH 2) 9] 3+ complejos:
- 2 Dy (s) + 3 H 2 SO 4 (ac) → 2 Dy 3+ (ac) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Compuestos

Halogenuros de disprosio, como DyF 3 y DyBr 3, tienden a tomar un color amarillo. Óxido de disprosio, también conocido como disprosio, es un polvo blanco que es altamente magnético , más que el óxido de hierro.
Disprosio combina con varios no metales a altas temperaturas para formar compuestos binarios con diferentes composición y estados de oxidación 3 y 2 veces, como DyN, DyP, Dyh 2 y Dyh 3; DyS, DyS 2, Dy 2 S 3 y Dy 5 S 7; Dyb 2, Dyb 4, 6 y Dyb Dyb 12, así como Dy 3 C y Dy 2 C 3.
Carbonato de disprosio, Dy 2 (CO 3) 3, y sulfato de disprosio, Dy 2 (SO 4) 3, el resultado de reacciones similares. La mayoría de los compuestos de disprosio son solubles en agua, aunque tetrahidrato de carbonato de disprosio (Dy 2 (CO 3) 3 · 4H 2 O) y oxalato de decahidrato de disprosio (Dy 2 (C 2 O 4) 3 · 10H 2 O) son ambos insolubles en agua.
Isótopos
Naturalmente disprosio ocurriendo está compuesto de 7 isótopos : 156 Dy, 158 Dy, 160 Dy, 161 Dy, 162 Dy, 163 Dy, y 164 Dy. Estos son todos considerados estables, aunque 156 Dy desintegra desintegración alfa con una vida media de más de 1 × 10 18 años. De los isótopos naturales, 164 Dy es el más abundantes en 28%, seguido por 162 Dy al 26%. Lo menos abundante es 156 Dy en 0,06%.
Veintinueve radioisótopos también se han sintetizado, que van en la masa atómica de 138 a 173. El más estable de estos es 154 Dy con una vida media de aproximadamente 3 × 10 6 años, seguido por 159 Dy, con una vida media de 144,4 días. El menos estable es 138 Dy, con una vida media de 200 ms. Los isótopos que son más ligeros que los isótopos estables tienden a decaer principalmente por β + decadencia, mientras que los que son más pesados tienden a decaer por β -. decaimiento, con algunas excepciones 154 Dy decae principalmente por la desintegración alfa, y 152 y 159 Dy decadencia Dy principalmente por captura de electrones. Disprosio también tiene al menos 11 isómeros metaestables, que van en la masa atómica de 140 a 165. El más estable de estos es 165m Dy, que tiene una vida media de 1,257 minutos. 149 Dy tiene dos isómeros metaestables, el segundo de los cuales, 149m2 Dy, tiene una media vida de 28 ns.
Historia
En 1878, erbio se encontraron minerales que contienen los óxidos de holmio y tulio . Químico francés Paul Émile Lecoq de Boisbaudran, mientras se trabaja con óxido de holmio, separa óxido de disprosio de él en París en 1886. Su procedimiento para aislar el disprosio involucrados disolver óxido de disprosio en ácido, a continuación, añadir amoníaco para precipitar el hidróxido. Él sólo fue capaz de aislar disprosio de su óxido después de más de 30 intentos de su procedimiento. Al suceder, él nombró el elemento disprosio de los dysprositos griegos (δυσπρόσιτος), que significa "difícil de conseguir". Sin embargo, el elemento no se aisló en forma relativamente pura hasta después del desarrollo de técnicas de intercambio iónico por Frank Spedding en Universidad del Estado de Iowa a principios de 1950.
En 1950, Glenn T. Seaborg, Albert Ghiorso, y Stanley G. Thompson bombardeados 241 Am con iones de helio, que produjeron átomos con un número atómico de 97 y que se parecía mucho al de los lantánidos vecina terbio . Debido terbio fue nombrado después Ytterby, la ciudad en la que él y varios otros elementos fueron descubiertos, este nuevo elemento fue nombrado berkelium para la ciudad en la que se sintetiza. Sin embargo, cuando el equipo de investigación elemento 98 sintetiza, no podían pensar en una buena analogía para disprosio, y en su lugar el nombre del elemento californio en honor al estado en el que se sintetiza. El equipo de investigación llegó a "señalar que, en reconocimiento del hecho de que el disprosio es nombrado sobre la base de una palabra griega que significa" difícil de conseguir en, 'que los buscadores de otro elemento de un siglo atrás encontraron difícil llegar a California ".
Aparición

Disprosio nunca se encuentra como elemento libre, pero se encuentra en muchos minerales , incluyendo xenotima, fergusonite, gadolinita, euxenite, polycrase, blomstrandine, monacita y bastnäsite; a menudo con erbio y de holmio o de otros elementos de tierras raras. Actualmente, la mayoría de disprosio se obtiene a partir de los minerales de arcilla de iones de adsorción del sur de China, y las fuentes futuras incluirá la región Halls Creek en Australia Occidental. En el alto de itrio versión de estos, disprosio pasa a ser el más abundante de los pesados lantánidos , que comprende hasta 7-8% del concentrado (en comparación con aproximadamente el 65% de itrio). La concentración de Dy en la corteza terrestre es de aproximadamente 5,2 mg / kg y en agua de mar 0,9 ng / L.
Producción
Disprosio se obtiene principalmente de arena monacita, una mezcla de varios fosfatos. El metal se obtiene como un subproducto en la extracción comercial de itrio. En el aislamiento de disprosio, la mayor parte de los metales no deseados se pueden eliminar magnéticamente o por una proceso de flotación. Disprosio puede entonces ser separado de otros metales de tierras raras por una intercambio iónico proceso de desplazamiento. Los iones de disprosio resultante puede reaccionar con cualquiera de flúor o cloro para formar fluoruro de disprosio, DyF 3, o cloruro de disprosio, DyCl 3. Estos compuestos se pueden reducir utilizando calcio o metales de litio en las siguientes reacciones:
- 3 Ca + 2 DyF 3 → 2 Dy + 3 CaF 2
- 3 Li + DyCl 3 → Dy + 3 LiCl
Los componentes se colocan en un tantalio crisol y dispararon en un helio atmósfera. A medida que progresa la reacción, los compuestos de haluro resultantes y disprosio fundido se separan debido a las diferencias en la densidad. Cuando la mezcla se enfría, el disprosio se puede cortar lejos de las impurezas.
Cerca de 100 toneladas de disprosio se producen en el mundo cada año, con el 99% de ese total producido en China. Precios de disprosio han subido casi veinte veces, pasando de $ 7 por libra en el 2003, a $ 130 la libra a finales de 2010. De acuerdo con la Departamento de Energía, la amplia gama de su actual Unidos y proyecta usos, junto con la falta de reemplazo de inmediato adecuado, hace disprosio el elemento más crítico para las nuevas tecnologías de energía limpia - incluso sus la mayoría de las proyecciones conservadoras predicen un déficit de disprosio antes 2015.
Aplicaciones
Se usa disprosio, junto con vanadio y otros elementos, en la fabricación de láser materiales y la iluminación comercial. Debido a la alta del disprosio la absorción de neutrones térmicos sección transversal, disprosio-óxido de níquel cermets se utilizan en las barras de control de absorción de neutrones en reactores nucleares. Dysprosium- cadmio calcogenuros son fuentes de la radiación infrarroja que es útil para el estudio de las reacciones químicas. Debido disprosio y sus compuestos son altamente susceptibles a la magnetización, que se emplean en diversas aplicaciones de almacenamiento de datos, tales como en discos duros.
Neodimio imanes -Hierro-boro pueden tener hasta 6% de la neodimio sustituido con disprosio para elevar la coercitividad para aplicaciones tales como motores de accionamiento para vehículos eléctricos híbridos exigente. Esta sustitución requeriría un máximo de 100 gramos de disprosio por coche híbrido producido. Basado en Proyectadas 2 millones de unidades de Toyota por año, el uso de disprosio en aplicaciones como esta agotarían rápidamente la oferta disponible del metal. La sustitución disprosio también puede ser útil en otras aplicaciones, ya que mejora la resistencia a la corrosión de los imanes.
Disprosio es uno de los componentes de Terfenol-D, junto con el hierro y el terbio. Terfenol-D tiene la mayor temperatura ambiente magnetostricción de cualquier material conocido; esta propiedad se emplea en transductores de banda ancha resonadores mecánicos y de alta precisión inyectores de combustible líquido.
Disprosio se utiliza en dosímetros para medir radiación ionizante. Los cristales de sulfato de calcio o fluoruro de calcio se dopan con disprosio. Cuando estos cristales están expuestos a la radiación, los átomos de disprosio se convierten emocionado y luminiscente. La luminiscencia puede medirse para determinar el grado de exposición a la que el dosímetro ha sido sometido.
Las nanofibras de compuestos de disprosio tienen alta resistencia y gran área de superficie; por lo tanto, pueden ser utilizados para el refuerzo de otros materiales y, como un catalizador. Fibras de fluoruro de óxido de disprosio se pueden producir por calentamiento de una solución acuosa de DyBr 3 y NaF a 450 ° C a 450 bar de presión durante 17 horas. Este material es extraordinariamente robusta, sobreviviendo a más de 100 horas en varias soluciones acuosas a temperaturas superiores a 400 ° C sin volver a disolver o agregación.
Yoduro de disprosio y bromuro de disprosio se utilizan en la iluminación de alta intensidad. Estos compuestos se disocian cerca del centro caliente de la lámpara de la liberación de átomos aislados disprosio. La luz re-emitir este último en la parte verde y roja del espectro produciendo de esta manera eficazmente la luz brillante.
Precauciones
Al igual que muchos polvos, polvo de disprosio puede presentar un riesgo de explosión cuando se mezcla con el aire y cuando una fuente de ignición está presente. Láminas delgadas de la sustancia también pueden ser encendidos por chispas o por electricidad estática. Incendios disprosio no pueden ser expulsados por el agua. Se puede reaccionar con agua para producir inflamable de hidrógeno gas. Incendios cloruro disprosio, sin embargo, pueden ser extinguidos con agua, mientras que el fluoruro de disprosio y óxido de disprosio no son inflamables. Nitrato de disprosio, Dy (NO 3) 3, es un fuerte agente oxidante y se inflame fácilmente al entrar en contacto con sustancias orgánicas.
Sales de disprosio soluble, tal como cloruro de disprosio y nitrato de disprosio, son ligeramente tóxico cuando se ingiere. Las sales insolubles, sin embargo, no son tóxicos. Sobre la base de la toxicidad del cloruro de disprosio a los ratones , se estima que la ingesta de 500 gramos o más podría ser fatal para un ser humano.

