
Cinética enzimática
Antecedentes
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. patrocinio SOS Niño es cool!

La cinética enzimática es el estudio de las reacciones químicas que están catalizadas por enzimas, con un enfoque en sus velocidades de reacción . El estudio de una enzima de cinética revela el mecanismo catalítico de esta enzima, su papel en metabolismo, cómo se controla su actividad, y cómo una fármaco o un veneno fuerza inhibir la enzima.
Las enzimas son generalmente proteínas moléculas que manipulan otras moléculas - las enzimas ' sustratos. Estas moléculas diana se unen a una enzima de sitio activo y se transforman en productos a través de una serie de pasos conocido como el mecanismo enzimático. Estos mecanismos se pueden dividir en los mecanismos de un solo sustrato y de múltiples sustratos. Los estudios cinéticos de enzimas que se unen sólo un sustrato, tales como isomerasa triosafosfato, el objetivo de medir la afinidad con la que la enzima se une este sustrato y la tasa de rotación.
Cuando las enzimas se unen múltiples sustratos, tales como dihidrofolato reductasa (a la derecha), la cinética enzimática también puede mostrar la secuencia en que estos sustratos se unen y la secuencia en que se efectúe el despacho. Un ejemplo de las enzimas que se unen un único sustrato y liberan múltiples productos son proteasas, que escinden un sustrato de proteína en dos productos polipéptido. Otros se unen dos sustratos entre sí, tales como ADN polimerasa vinculación de un de nucleótidos a ADN . Aunque estos mecanismos son a menudo una compleja serie de pasos, hay típicamente un paso determinante de la velocidad que determina la cinética global. Este paso determinante de la velocidad puede ser una reacción química o una cambio conformacional de la enzima o sustratos, tales como los implicados en la liberación de producto (s) de la enzima.
El conocimiento de la la estructura de la enzima es útil en la interpretación de los datos cinéticos. Por ejemplo, la estructura puede sugerir cómo sustratos y productos se unen durante la catálisis; qué cambios ocurren durante la reacción; e incluso el papel de determinados aminoácidos residuos en el mecanismo. Algunas enzimas cambian de forma significativa durante el mecanismo; En tales casos, es útil para determinar la estructura de la enzima con y sin análogos de sustrato unidos que no se someten a la reacción enzimática.
No todos los catalizadores biológicos son enzimas de proteínas; Catalizadores basados en ARN, tales como ribozimas y ribosomas son esenciales para muchas funciones celulares, tales como Empalme de ARN y traducción. La principal diferencia entre las ribozimas y enzimas es que los catalizadores de ARN realizar un conjunto más limitado de reacciones, aunque su mecanismos de reacción y la cinética pueden ser analizados y clasificados por los mismos métodos.
Principios generales

La reacción catalizada por una enzima usa exactamente los mismos reactivos y produce exactamente los mismos productos que la reacción no catalizada. Al igual que otros catalizadores , las enzimas no alteran la posición de equilibrio entre sustratos y productos. Sin embargo, a diferencia de las reacciones químicas no catalizada, las reacciones catalizadas por enzimas muestran cinética de saturación. Para una concentración de enzima dada y para concentraciones relativamente bajas de sustrato, la velocidad de reacción aumenta linealmente con la concentración de sustrato; las moléculas de enzima son en gran parte libre para catalizar la reacción, y el aumento de la concentración de sustrato significa un ritmo creciente en la que las moléculas de enzima y sustrato encuentran el uno al otro. Sin embargo, a concentraciones relativamente elevadas de sustrato, la velocidad de reacción asintóticamente se acerca al máximo teórico; los sitios de enzimas activas son casi todos ocupados y la velocidad de reacción se determina por la tasa de rotación intrínseca de la enzima. La concentración de sustrato a mitad de camino entre estos dos casos límite se denota por K M.
Las dos propiedades cinéticas más importantes de una enzima son la rapidez con la enzima se satura con un sustrato particular, y la tasa máxima que puede alcanzar. Sabiendo estas propiedades sugiere lo que podría hacer una enzima en la célula y puede mostrar cómo la enzima responderá a los cambios en estas condiciones.
Los ensayos enzimáticos

Los ensayos enzimáticos son procedimientos de laboratorio que miden la velocidad de las reacciones enzimáticas. Debido a que las enzimas no son consumidas por las reacciones que catalizan, ensayos enzimáticos suelen seguir los cambios en la concentración de cualquiera de los sustratos o productos para medir la velocidad de reacción. Hay muchos métodos de medición. Ensayos espectrofotométricos observan cambios en el absorbancia de luz entre productos y reactivos; ensayos radiométricos implican la incorporación o liberación de radiactividad para medir la cantidad de producto fabricado con el tiempo. Ensayos espectrofotométricos son los más convenientes ya que permiten la velocidad de la reacción que se mide continuamente. Aunque los ensayos radiométricos requieren la extracción y el recuento de las muestras (es decir, son ensayos discontinuos) por lo general son extremadamente sensibles y pueden medir niveles muy bajos de actividad de la enzima. Un enfoque análogo es utilizar espectrometría de masas para monitorizar la incorporación o la liberación de isótopos estables como sustrato se convierte en producto.
Los ensayos enzimáticos más sensibles utilizan láseres enfocados a través de un microscopio para observar los cambios en las moléculas de enzimas que catalizan individuales como sus reacciones. Estas mediciones, ya sea cambios en el uso de la la fluorescencia de cofactores durante mecanismo de reacción de una enzima, o de colorantes fluorescentes añadidos en sitios específicos de la proteína para informar de los movimientos que se producen durante la catálisis. Estos estudios proporcionan una nueva visión de la cinética y la dinámica de las enzimas individuales, en oposición a la cinética enzimática tradicionales, que observa el comportamiento promedio de las poblaciones de millones de moléculas de enzima.
A la izquierda se muestra una curva de progreso típico para un ensayo enzimático. La enzima produce producto a un lineal tasa inicial al comienzo de la reacción. Más adelante en esta curva de progreso, la tasa disminuye a medida que el sustrato se agota o productos se acumulan. La duración del período de tasa inicial depende de las condiciones de ensayo y puede variar desde milisegundos a horas. Los ensayos enzimáticos generalmente se establecen para producir una tasa inicial que dura más de un minuto, para realizar mediciones más fácil. Sin embargo, el equipo para mezclar líquidos rápidamente permite mediciones cinéticas rápidas en las tasas iniciales de menos de un segundo. Estos ensayos muy rápidos son esenciales para medir la cinética de pre-estado de equilibrio, que se discuten a continuación.
La mayoría de los estudios de cinética enzimática se concentran en esta parte inicial, lineal de reacciones enzimáticas. Sin embargo, también es posible medir la curva de reacción completa y encajar estos datos a un no lineal ecuación de velocidad. Esta forma de medición de las reacciones enzimáticas se denomina análisis de progreso de la curva. Este enfoque es útil como una alternativa a la cinética rápida cuando la tasa inicial es demasiado rápido para medir con precisión.
Reacciones Single-sustrato
Enzimas con mecanismos-sustrato incluyen sola isomerasas tales como triosefosfatoisomerasa o bifosfoglicerato mutasa, intramolecular liasas tales como adenilato ciclasa y la ribozima cabeza de martillo, un ARN liasa. Sin embargo, algunas enzimas que sólo tienen un único sustrato no entran en esta categoría de mecanismos. La catalasa es un ejemplo de esto, como la enzima reacciona con una primera molécula de peróxido de hidrógeno sustrato, se convierte oxidado y se reduce luego por una segunda molécula de sustrato. Aunque un único sustrato está implicada, la existencia de una enzima modificada medios intermedios que el mecanismo de catalasa es en realidad un mecanismo de ping-pong, un tipo de mecanismo que se describe en la sección de reacciones Multi-sustrato a continuación.
La cinética de Michaelis-Menten


Como las reacciones catalizadas por enzimas son saturable, su velocidad de catálisis no muestra una respuesta lineal a la creciente sustrato. Si la velocidad inicial de la reacción se mide en un rango de concentraciones de sustrato (indicada como [S]), la velocidad de reacción (v) aumenta a medida que [S] aumenta, como se muestra a la derecha. Sin embargo, como [S] se hace mayor, la enzima se satura con sustrato y la tasa alcanza V max, tasa máxima de la enzima.
La Michaelis-Menten modelo cinético de una reacción de sustrato solo se muestra a la derecha. Hay una inicial reacción bimolecular entre la enzima y el sustrato S E para formar la ES complejos enzima-sustrato. Aunque el mecanismo enzimático para la reacción unimolecular 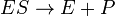 reacción puede ser bastante complejo, no es típicamente un paso determinante de la velocidad enzimática que permite que el mecanismo para ser modelado como una única etapa catalítica de tasa constante k 2.
reacción puede ser bastante complejo, no es típicamente un paso determinante de la velocidad enzimática que permite que el mecanismo para ser modelado como una única etapa catalítica de tasa constante k 2.
![\ Begin {matriz} v = k_2 [\ mbox {ES}] \ end {matriz}](../../images/557/55719.png) (Ecuación 1).
(Ecuación 1).
k 2 se llama también k gato o el número de volumen de negocios, el número máximo de reacciones enzimáticas catalizadas por segundo.
A bajas concentraciones de sustrato [S], existe la enzima en un equilibrio entre tanto la forma libre E y el ES complejos enzima-sustrato; aumentando asimismo aumenta [S] [ES] a expensas de [E], desplazando el equilibrio de unión a la derecha. Puesto que la velocidad de la reacción depende de la concentración [ES], la tasa es sensible a pequeños cambios en la [S]. Sin embargo, a muy alta [S], la enzima está completamente saturado con sustrato, y sólo existe en la forma ES. En estas condiciones, la velocidad (v ≈ k 2 [E] tot = V max) es insensible a pequeños cambios en la [S]; aquí, [E] tot es la concentración total de enzima
que es aproximadamente igual a la concentración [ES] bajo condiciones de saturación.
La Ecuación de Michaelis-Menten se describe cómo la velocidad de reacción v depende de la posición de la unión al sustrato de equilibrio y de la constante de velocidad k 2. Michaelis y Menten mostró cuando k 2 es mucho menor que k -1 (llamado el supuesto de equilibrio) que podrían derivar la siguiente ecuación:
![v = \ frac {V_ \ max [\ mbox {S}]} {K_m + [\ mbox {S}]}](../../images/557/55721.png) (Ecuación 2)
(Ecuación 2)
Esta ecuación de Michaelis-Menten es la base para la mayoría de la cinética de enzima-sustrato único.
La constante de Michaelis K m se define como la concentración a la que la velocidad de la reacción de la enzima es un medio V max. Esto puede ser verificada mediante la sustitución de [S] = K m en la ecuación de Michaelis-Menten. Si el paso enzimático determinante de la velocidad es lenta en comparación con el sustrato de disociación (k 2 << k-1), la constante de Michaelis K m es más o menos el constante de disociación del complejo ES, aunque esta situación es relativamente poco frecuente.
La situación más normal en la que k 2> k -1 a veces se llama Briggs Cinética de Haldane. La ecuación de Michaelis-Menten todavía lleva a cabo bajo estas condiciones más generales, como puede ser derivado de la aproximación del estado estacionario. Durante el periodo de velocidad inicial, la velocidad de reacción v es más o menos constante, lo que indica que [ES] es igualmente constante (cf. ecuación 1):
Por lo tanto, la concentración de [ES] está dada por la fórmula
donde se define la constante de Michaelis K m
([E] es la concentración de enzima libre). Tomados en conjunto, la fórmula general para la velocidad de reacción v es de nuevo la ecuación de Michaelis-Menten:
La constante de especificidad 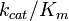 es una medida de la eficiencia con una enzima convierte un sustrato en producto. Usando la definición de la constante de Michaelis
es una medida de la eficiencia con una enzima convierte un sustrato en producto. Usando la definición de la constante de Michaelis 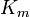 , La ecuación de Michaelis-Menten se puede escribir en la forma
, La ecuación de Michaelis-Menten se puede escribir en la forma
donde [E] es la concentración de enzima libre. Por lo tanto, la constante de especificidad es un eficaz tasa constante de enzima libre de segundo orden para reaccionar con sustrato libre para formar producto. La constante de especificidad está limitada por la frecuencia con la que el sustrato y la enzima encontrar entre sí en solución, tan alto como 10 10 M -1 s -1. Sorprendentemente, este tipo máximo apenas se ve afectada por el tamaño de ya sea el sustrato o la enzima. La relación de las constantes de especificidad para dos sustratos es una comparación cuantitativa de lo eficiente es la enzima en la conversión de los sustratos. La pendiente de la gráfica de Michaelis-Menten a una concentración de sustrato de baja [S] (cuando [S] << K m) también se obtiene la constante de especificidad.
Gráficos lineales de la ecuación de Michaelis-Menten
El uso de una cinética de Michaelis-Menten tutorial interactivo en la Universidad de Virginia, los efectos sobre el comportamiento de una enzima de la variación de las constantes cinéticas se pueden explorar.
La trama de v frente a [S] de arriba no es lineal; aunque lineal inicialmente a baja [S], se agacha para saturar a alta [S]. Antes de la era moderna de de ajuste de curva no lineal en los equipos, esta no linealidad podría hacer más difícil la estimación de K m y V max precisión. Por lo tanto, varios investigadores desarrollaron linealizaciones de la ecuación de Michaelis-Menten, como el Lineweaver-Burk, el Diagrama de Eadie-Hofstee y la Parcela Hanes-Woolf. Todas estas representaciones lineales pueden ser útiles para la visualización de datos, pero ninguno se debe utilizar para determinar los parámetros cinéticos, como software de ordenador está fácilmente disponible que permite la determinación más precisa por métodos de regresión no lineal.
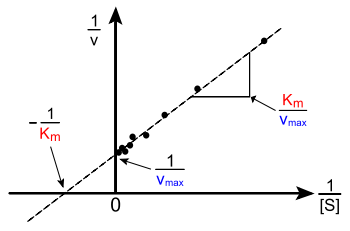
La Lineweaver-Burk o parcela doble recíproco es la forma común de ilustrar los datos cinéticos. Esto se produce mediante la adopción de la recíproco de ambos lados de la ecuación de Michaelis-Menten. Como se muestra a la derecha, esta es una forma lineal de la ecuación de Michaelis-Menten y produce una línea recta con la ecuación y = m x + c con un equivalente de interceptación y de 1 / V max y una interceptación x de la gráfica representando -1 / K m.
Naturalmente, no hay valores experimentales se pueden tomar en negativo 1 / [S]; el valor límite inferior 1 / [S] = 0 (la interceptación y) corresponde a una concentración de sustrato infinito, donde 1 / v = 1 / V max como se muestra a la derecha; Por lo tanto, la interceptación x es una extrapolación de los datos experimentales tomados en concentraciones positivos. De manera más general, la representación de Lineweaver-Burk sesga la importancia de las mediciones realizadas a bajas concentraciones de sustrato y, por lo tanto, puede producir estimaciones inexactas de V max y K m. Un método de trazado lineal más precisa es la Parcela Eadie-Hofstee. En este caso, v se representa frente a v / [S]. En la tercera representación lineal común, el Diagrama de Hanes, [S] / v se representa frente a [S]. En general, la normalización de datos puede ayudar a disminuir la cantidad de trabajo experimental y puede aumentar la fiabilidad de los resultados, y es adecuado tanto para el análisis gráfico y numérico.
El significado práctico de las constantes cinéticas
El estudio de la cinética enzimática es importante por dos razones básicas. En primer lugar, ayuda a explicar cómo funcionan las enzimas, y en segundo lugar, ayuda a predecir cómo se comportan las enzimas en los organismos vivos. Las constantes cinéticas definidas anteriormente, K m y V max, son fundamentales para intentos de comprender cómo las enzimas trabajan juntos para controlar metabolismo.
Hacer estas predicciones no es trivial, incluso para sistemas simples. Por ejemplo, oxaloacetato está formado por malato deshidrogenasa en la mitocondria . El oxaloacetato puede entonces ser consumido por citrato sintasa, carboxiquinasa fosfoenolpiruvato o aspartato aminotransferasa, la alimentación en el ciclo del ácido cítrico, gluconeogénesis o la biosíntesis de ácido aspártico, respectivamente. Ser capaz de predecir la cantidad de oxaloacetato que entra en la vía requiere el conocimiento de la concentración de oxalacetato, así como la concentración y la cinética de cada una de estas enzimas. Este objetivo de predecir el comportamiento de las vías metabólicas alcanza su expresión más compleja en la síntesis de grandes cantidades de cinética y los datos de expresión de genes en modelos matemáticos de organismos enteros. Aunque este objetivo está lejos en el futuro para cualquier eucariota , se están realizando intentos para lograr esto en bacterias , con modelos de metabolismo de Escherichia coli que se están producidas y probadas.
Reacciones Multi-sustrato
Reacciones Multi-sustrato siguen ecuaciones de velocidad complejas que describen cómo los sustratos se unen y en qué secuencia. El análisis de estas reacciones es mucho más simple si la concentración de sustrato A se mantiene constante y el sustrato B variada. Bajo estas condiciones, la enzima se comporta como una enzima-sustrato único y una parcela de v por [S] da aparente K m y V max constantes de sustrato B. Si no se realiza un conjunto de estas mediciones en diferentes concentraciones fijas de A, estos datos se pueden utilizar para trabajar lo que el mecanismo de la reacción es. Para una enzima que lleva dos sustratos A y B y los convierte en dos productos P y Q, hay dos tipos de mecanismos: complejo ternario y ping-pong.
Mecanismos ternario complejos
En estas enzimas, ambos sustratos se unen a la enzima al mismo tiempo para producir un complejo ternario EAB. El orden de unión puede estar al azar (en un mecanismo aleatorio) o sustratos que se unen en una secuencia particular (en un mecanismo ordenado). Cuando un conjunto de v por [S] curvas (fijo A, variando B) de una enzima con un mecanismo complejo ternario se trazan en un Lineweaver-Burk, el conjunto de líneas producidas se cruzará.
Enzimas con mecanismos ternario complejos incluyen glutatión S transferasa, dihidrofolato reductasa y ADN polimerasa. Los siguientes enlaces muestran animaciones cortas de los mecanismos de complejo ternario de las enzimas dihidrofolato reductasa y ADN polimerasa.
Mecanismos de ping-pong
Como se muestra a la derecha, enzimas con un mecanismo de ping-pong puede existir en dos estados, E y una forma modificada químicamente de la enzima E *; esta enzima modificada se conoce como una intermedio. En tales mecanismos, el sustrato se une a una, cambia la enzima para E *, por ejemplo, la transferencia de un grupo químico al sitio activo, y se libera a continuación. Sólo después de que el primer sustrato se libera puede sustrato B se unen y reaccionar con la enzima modificada, regenerando el formulario E sin modificar. Cuando un conjunto de v por [S] curvas (A fijo, variando B) a partir de una enzima con un mecanismo de ping-pong se trazan en un gráfico de Lineweaver-Burk, se producirá un conjunto de líneas paralelas.
Las enzimas con mecanismos de ping-pong incluyen algunos oxidorreductasas tales como peroxidasa tiorredoxina, transferasas tales como cytydilyltransferase acylneuraminate y serina proteasas tales como tripsina y quimotripsina. Las proteasas de serina son una familia muy común y diversa de enzimas, incluyendo enzimas digestivas (tripsina, quimotripsina, y elastasa), varias enzimas de la cascada de coagulación de la sangre y muchos otros. En estas proteasas de serina, la E * intermedia es una especie acil-enzima formadas por el ataque de un sitio activo residuo de serina en una enlace peptídico en un sustrato de proteína. Un corto de animación que muestra el mecanismo de la quimotripsina se vincula aquí.
Cinética no Michaelis-Menten
Algunas enzimas producen una sigmoide v por parcela [S], que a menudo indica la unión cooperativa de sustrato al sitio activo. Esto significa que la unión de una molécula sustrato afecta a la unión de moléculas de sustrato posteriores. Este comportamiento es más común en enzimas multiméricas con varios sitios activos que interactúan. Aquí, el mecanismo de cooperación es similar a la de la hemoglobina, con la unión del sustrato a un sitio activo alterar la afinidad de los otros sitios activos para moléculas de sustrato. Cooperatividad positiva se produce cuando la unión de la primera molécula de sustrato aumenta la afinidad de los otros sitios activos para sustrato. Cooperatividad negativa ocurre cuando la unión del primer sustrato disminuye la afinidad de la enzima por otras moléculas de sustrato.
Enzimas alostéricos incluyen tirosil ARNt-sintetasa de mamíferos, que muestra cooperatividad negativa, y bacteriana aspartato transcarbamilasa y fosfofructoquinasa, que muestran cooperatividad positiva.
Cooperatividad es sorprendentemente común y puede ayudar a regular las respuestas de enzimas a los cambios en las concentraciones de sus sustratos. Cooperatividad positiva hace que las enzimas mucho más sensible a [S] y sus actividades puede mostrar grandes cambios a lo largo de un rango estrecho de concentración de sustrato. Por el contrario, la cooperatividad negativa genera enzimas insensibles a pequeños cambios en [S].
La Ecuación de Hill se utiliza a menudo para describir el grado de cooperatividad cuantitativamente en cinética no Michaelis-Menten. Los derivados coeficiente de Hill n mide la cantidad de la unión de sustrato a un sitio activo afecta a la unión de sustrato a los demás sitios activos. Un coeficiente de Hill de <1 indica cooperatividad negativa y un coeficiente de> 1 indica positivo cooperatividad.
Cinética de estado pre-estacionario
En el primer momento después de una enzima se mezcla con el sustrato, ningún producto ha sido formado y sin existen intermedios. El estudio de los próximos pocos milisegundos de la reacción se llama la cinética de estado pre-estacionario. Cinética de estado Pre-constante es, por tanto, de que se trate con la formación y el consumo de productos intermedios de enzima-sustrato (como ES o E *) hasta su Las concentraciones en estado estacionario se alcanzan.
Este enfoque se aplicó primero a la reacción de hidrólisis catalizada por quimotripsina. A menudo, la detección de un compuesto intermedio es una pieza vital de las pruebas en las investigaciones de qué mecanismo sigue una enzima. Por ejemplo, en los mecanismos de ping-pong que se muestran anteriormente, mediciones cinéticas rápidas pueden seguir la liberación del producto P y medir la formación de la enzima modificada intermedio E *. En el caso de la quimotripsina, este intermedio se forma por el ataque del sustrato por la serina nucleófilo en el sitio activo y la formación de la acil-enzima intermedio.
En la figura de la derecha, la enzima produce E * rápidamente en los primeros segundos de la reacción. La tasa entonces se desacelera a medida que se alcanza el estado de equilibrio. Esta fase de ráfaga rápida de la reacción mide una sola rotación de la enzima. En consecuencia, la cantidad de producto liberado en esta explosión, que se muestra como la intersección con el eje y de la gráfica, también da la cantidad de enzima funcional que está presente en el ensayo.
Mecanismo químico
Un objetivo importante de la medición de la cinética enzimática es determinar el mecanismo químico de una reacción enzimática, es decir, la secuencia de pasos químicos que transforman sustrato en producto. Los enfoques cinéticos discutidos anteriormente mostrarán en qué tasas intermedios se forman e inter-convertidos, pero no pueden identificar exactamente lo que estos intermediarios son.
Mediciones cinéticas tomadas bajo diferentes condiciones de la solución o en modificaron ligeramente enzimas o sustratos menudo arrojar luz sobre este mecanismo químico, ya que revelan el paso o intermedios determinante de la velocidad en la reacción. Por ejemplo, la rotura de una enlace covalente a un hidrógeno átomo es un paso determinante de la velocidad común. ¿Cuál de las posibles transferencias de hidrógeno es determinante de la velocidad se puede demostrar mediante la medición de los efectos cinéticos de la sustitución de hidrógeno por deuterio, su establo isótopo . La tasa cambiará cuando se sustituye el hidrógeno crítico, debido a una primaria efecto isotópico cinético, que se produce porque los bonos a deuterio son más difíciles de romper luego bonos de hidrógeno. También es posible medir efectos similares con otras sustituciones de isótopos, tales como 13 C / 12 C y 18 O / 16 O, pero estos efectos son más sutiles.
Los isótopos también pueden usarse para revelar el destino de varias partes de las moléculas de sustrato en los productos finales. Por ejemplo, a veces es difícil de discernir el origen de un oxígeno átomo en el producto final; ya que puede haber venido de agua o de una parte del sustrato. Esto puede ser determinado mediante la sustitución sistemática de isótopos estables de oxígeno 18 O en las diversas moléculas que participan en la reacción y la verificación para el isótopo en el producto. El mecanismo químico también puede ser dilucidado mediante el examen de la cinética y efectos isotópicos bajo diferentes condiciones de pH, mediante la alteración de los iones metálicos u otros unido cofactores, por mutagénesis dirigida a sitio de residuos de aminoácidos conservados, o mediante el estudio del comportamiento de la enzima en presencia de análogos de sustrato (s).
La inhibición enzimática
Los inhibidores enzimáticos son moléculas que reducen o suprimen la actividad enzimática. Estos son ya sea reversible (es decir, la eliminación del inhibidor restaura la actividad de la enzima) o irreversible (es decir, el inhibidor de la enzima inactiva permanentemente).
Inhibidores reversibles
Inhibidores de la enzima reversibles se pueden clasificar como competitivo, no competitivo y no competitivo o mixta, en función de sus efectos sobre la K m y V max. Estos efectos diferentes resultan de la unión a la enzima E inhibidor, a las ES complejos enzima-sustrato, o a ambos, como se muestra en la figura a la derecha y la tabla de abajo. El tipo particular de un inhibidor puede discernirse mediante el estudio de la cinética enzimática como una función de la concentración de inhibidor. Los cuatro tipos de producir la inhibición Lineweaver-Burke y Parcelas Eadie-Hofstee que varían en formas distintivas con la concentración de inhibidor. Por razones de brevedad, se utilizan dos símbolos:
![\ Alpha = 1 + \ frac {[\ mbox {I}]} {K_ {i}}](../../images/557/55760.png) y
y ![\ Alpha ^ {\ prime} = 1 + \ frac {[\ mbox {I}]} {K_ {i} ^ {\ prime}}](../../images/557/55761.png)
donde K i y K 'i son la constantes de disociación para la unión a la enzima y al complejo enzima-sustrato, respectivamente. En presencia del inhibidor reversible, aparente K m y V max de la enzima se convierten en (α / α ') K m y (1 / α') V max, respectivamente, como se muestra a continuación para los casos comunes.
| Tipo de inhibición | K m aparente | V max aparente | ||
| Ki sólo | ( 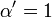 ) ) | competitivo | 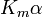 | 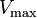 |
| K i 'sólo | ( 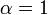 ) ) | no competitivo | 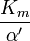 |  |
| Ki = K i ' | ( 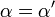 ) ) | no competitivo | 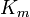 |  |
| K i ≠ K i ' | ( 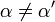 ) ) | mixto | 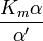 |  |
Ajustes de regresión no lineal de los datos de cinética de enzimas a las ecuaciones de velocidad arriba pueden producir estimaciones precisas de la constantes de disociación K i y K 'i.
Los inhibidores irreversibles
Inhibidores de la enzima también pueden inactivar de forma irreversible las enzimas, generalmente modificando covalentemente residuos del sitio activo. Estas reacciones, que pueden ser llamados sustratos suicidas, siguen funciones de decrecimiento exponencial y suelen ser saturable. Debajo de la saturación, siguen de primer orden con respecto a la cinética de inhibidor.
Mecanismos de catálisis
El modelo preferido para la interacción enzima-sustrato es el modelo de ajuste inducido. Este modelo propone que la interacción inicial entre la enzima y el sustrato es relativamente débil, pero que estas interacciones débiles inducir rápidamente cambios conformacionales en la enzima que fortalecen la unión. Estos cambios conformacionales también traen residuos catalíticos en el sitio activo cerca de los enlaces químicos en el sustrato que serán alteradas en la reacción. Después de la unión se lleva a cabo, uno o más mecanismos de catálisis reducir la energía de la reacción de transición de estado proporcionando una vía química alternativa para la reacción. Mecanismos de catálisis incluyen la catálisis por la cepa enlace; por la proximidad y orientación; por sitio activo donantes de protones o aceptantes; covalente catálisis y túnel cuántico.
Cinética de enzimas no pueden probar que los modos de catálisis son utilizados por una enzima. Sin embargo, algunos datos cinéticos pueden sugerir posibilidades de ser examinados por otras técnicas. Por ejemplo, un mecanismo de ping-pong con una cinética de ráfaga de fase de estado constante pre-sugeriría la catálisis covalente podría ser importante en el mecanismo de esta enzima. Alternativamente, la observación de un efecto fuerte pH en V max, pero no K m podrían indicar que un residuo en el sitio activo necesita estar en una determinada estado de ionización para que se produzca la catálisis.

![[\ Mbox {E}] _ \ mathrm {tot} \ \ stackrel {\ mathrm {def}} {} = \ [\ mbox {E}] + [\ mbox {ES}]](../../images/557/55720.png)
![\ Frac {d} {dt} [\ mbox {ES}] = k_ {1} [\ mbox {E}] [\ mbox {S}] - k_ {2} [\ mbox {ES}] - k _ {- 1} [\ mbox {ES}] \ aprox 0.](../../images/557/55722.png)
![[\ Mbox {ES}] \ aprox \ frac {[\ mbox {E}] _ \ mathrm {tot} [\ mbox {S}]} {[\ mbox {S}] + K_ {m}}](../../images/557/55723.png)
![K_ {m} \ \ stackrel {\ mathrm {def}} {=} \ \ frac {k_ {2} + k _ {- 1}} {k_ {1}} \ aprox \ frac {[\ mbox {E}] [\ mbox {S}]} {[\ mbox {ES}]}](../../images/557/55724.png)
![v = k_ {2} [\ mathrm {ES}] = \ frac {k_ {2} [\ mbox {E}] _ \ mathrm {tot} [\ mbox {S}]} {[\ mbox {S}] + K_ {m}} = \ frac {V_ \ max [\ mbox {S}]} {[\ mbox {S}] + K_ {m}}.](../../images/557/55725.png)
![v = k_ {2} [\ mathrm {ES}] = \ frac {k_ {2}} {K_ {m}} [\ mbox {E}] [\ mbox {S}]](../../images/557/55728.png)
![\ Frac {1} {v} = \ frac {K_ {m}} {V_ \ max [\ mbox {S}]} + \ frac {1} {V_ \ max}](../../images/557/55736.png)





