Estado de oxidación
Sabías ...
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. Ver http://www.soschildren.org/sponsor-a-child para averiguar sobre el apadrinamiento de niños.
El estado de oxidación es un indicador del grado de oxidación de un átomo en un compuesto químico . El estado de oxidación formal es la hipotética carga que un átomo tendría si todos los enlaces a los átomos de diferentes elementos eran 100% iónica. Estados de oxidación son típicamente representados por números enteros , que puede ser positivo, negativo o cero. En algunos casos, el estado de oxidación medio de un elemento es una fracción, tal como 8/3 de hierro en magnetita (Fe 3 O 4). El estado de oxidación más alto conocido es 8 en los tetróxidos de rutenio, xenón, osmio, iridio , y hassio , y algunos complejos que involucran plutonio , mientras que el estado de oxidación más bajo conocido es -4 para algunos elementos de la grupo de carbono.
El aumento en el estado de oxidación de un átomo a través de una reacción química se conoce como una reacción de oxidación; una disminución en el estado de oxidación se conoce como una reducción. Tales reacciones implican la transferencia formal de electrones, una ganancia neta de electrones que son una reducción y una pérdida neta de electrones siendo una oxidación. Para los elementos puros, el estado de oxidación es igual a cero.
La definición del estado de oxidación listado por IUPAC es la siguiente:
Estado de oxidación: Una medida del grado de oxidación de un átomo en una sustancia. Se define como la carga de un átomo puede ser imaginado tener cuando se cuentan los electrones de acuerdo a un acuerdo sobre un conjunto de reglas:Por ejemplo, los estados de oxidación del azufre en H 2 S, S 8 (azufre elemental), SO 2, SO 3 y H 2 SO 4 son, respectivamente: -2, 0, 4, 6 y 6. Cuanto mayor sea el estado de oxidación de un átomo dado mayor es su grado de oxidación; cuanto menor es el estado de oxidación mayor es su grado de reducción.
- (1) el estado de oxidación de una elemento libre (elemento sin combinar) es cero
- (2) para un ion sencilla (monoatómico), el estado de oxidación es igual a la carga neta en el ion
- (3) El hidrógeno tiene un estado de oxidación de 1 y el oxígeno tiene un estado de oxidación de -2 cuando están presentes en la mayoría de los compuestos. (Las excepciones a esto son que el hidrógeno tiene un estado de oxidación de -1 en hidruros de metales activos, por ejemplo, LiH , y el oxígeno tiene un estado de oxidación de -1 en peróxidos, por ejemplo, H 2 O 2
- (4) la suma algebraica de los estados de oxidación de todos los átomos en una molécula neutra debe ser cero, mientras que en los iones de la suma algebraica de los estados de oxidación de los átomos constituyentes debe ser igual a la carga del ion.
Algunas reglas generales para la determinación de los estados de oxidación sin el uso de estructuras de Lewis
Estas son las reglas generales para los compuestos simples, sin fórmulas estructurales:
- Cualquier elemento puro (incluso si forma moléculas diatómicas como el cloro, Cl 2) tiene un tate o xidation s (OS) de cero. Ejemplos de esto son Cu o O 2.
- Para iones monoatómicos, el sistema operativo es el mismo que la carga del ión. Por ejemplo, S 2- tiene un sistema operativo de -2, mientras que Li + tiene un sistema operativo de 1.
- La suma de los sistemas operativos para todos los átomos en una molécula o ión poliatómico es igual a la carga de la molécula o ion, de modo que el sistema operativo de un elemento puede ser calculada desde el sistema operativo de los otros elementos. Por ejemplo, en SO 2-
3 ( ion sulfito), la carga total del ion es -2, y cada uno de oxígeno se supone que tiene su estado de oxidación habitual de -2. La suma de los sistemas operativos es entonces OS (S) + 3 (-2) = OS (S) - 6 = -2, por lo que OS (S) = 4.
Para resumir: La suma algebraica de los estados de oxidación de todos los átomos en una neutral molécula debe ser cero, mientras que en iones poliatómicos la suma algebraica de los estados de oxidación de los átomos constituyentes debe ser igual a la carga del ion. Este hecho, combinado con el hecho de que algunos elementos casi siempre tienen ciertos estados de oxidación (debido a su muy alta electropositividad o electronegatividad), le permite a uno para calcular los estados de oxidación de los átomos restantes (tales como metales de transición) en compuestos simples.
Las siguientes reglas que se utilizan para asignar inicialmente estados de oxidación para ciertos elementos, en compuestos simples:
- El flúor tiene un estado de oxidación de -1 cuando está unido a cualquier otro elemento, ya que tiene el más alto electronegatividad de todos los elementos reactivos.
- Los halógenos distintos de flúor tienen un estado de oxidación de -1, excepto cuando están unidos a oxígeno, nitrógeno, u otro halógeno (más electronegativo). Por ejemplo, el estado de oxidación de cloro en monofluoruro de cloro (CLF) es 1. Sin embargo, en bromuro de cloro (o cloruro de bromo) (BrCl) el estado de oxidación de Cl es -1.
- El hidrógeno tiene una estado de oxidación de 1, excepto cuando se une a los elementos más electropositivos, tales como sodio , aluminio y boro , como en NaH, NaBH4, LiAlH4 , donde cada H tiene un estado de oxidación de -1.
- En compuestos, oxígeno normalmente tiene un estado de oxidación -2, aunque hay excepciones que se enumeran a continuación . Un ejemplo es peróxidos (por ejemplo, peróxido de hidrógeno H 2 O 2) cuando se tiene un sistema operativo de -1.
- Los metales alcalinos tienen un estado de oxidación de +1 en prácticamente la totalidad de sus compuestos (excepción, véase alkalide).
- Metales alcalinotérreos tienen un estado de oxidación de +2 en prácticamente la totalidad de sus compuestos.
Ejemplo de una sal compleja: En Cr (OH) 3, el oxígeno tiene un estado de oxidación de -2 (no hay enlaces presentes flúor o O-O), y el hidrógeno tiene un estado de 1 (unido a oxígeno). Así, cada uno de los tres hidróxido de grupos tiene un estado de oxidación de -2 + 1 = -1. Como el compuesto es neutro, Cr tiene un estado de oxidación de +3.
Para moléculas con átomos no equivalentes de un mismo elemento, el método de suma algebraica da sólo un estado de oxidación promedio. Vamos a considerar a continuación cómo encontrar el estado de oxidación de cada átomo con la ayuda de una estructura de Lewis.
Estado de oxidación y carga formal
El estado de oxidación de un átomo es a menudo diferente de la carga formal incluye a menudo en las estructuras de Lewis (cuando no es cero). El estado de oxidación se calcula suponiendo que cada enlace químico (excepto entre átomos idénticos) es iónico de modo que ambos electrones se asignan al átomo enlazado más electronegativo. En contraste, la carga formal se calcula suponiendo que cada bonos es covalente de modo que un electrón se asigna a cada átomo enlazado. Por ejemplo, en ion amonio (NH 4 +) el estado de oxidación del nitrógeno es -3, ya que todos los ocho electrones de valencia se asignan al átomo de nitrógeno que es más electronegativo que el hidrógeno. Sin embargo, la acusación formal es 1, calculado mediante la asignación de sólo cuatro electrones de valencia (uno por bono) a nitrógeno. Para la comparación, el nitrógeno en amoniaco (NH 3) tiene estado de oxidación -3 también, pero una carga formal de cero. En protonación del amoníaco la carga formal sobre los cambios de nitrógeno, pero su estado de oxidación no lo hace.
Cálculo de estados de oxidación formales con una estructura de Lewis
Hay dos formas comunes de calcular el estado de oxidación de un átomo en un compuesto. La primera es la técnica simple suma algebraica anterior, utilizado en compuestos que no requieren una Estructura de Lewis. La segunda se utiliza para moléculas cuando uno tiene una Estructura de Lewis.
Debe recordarse que el estado de oxidación de un átomo no representa la carga "real" en ese átomo: Esto es particularmente cierto de los estados de alta oxidación, donde el energía de ionización requerida para producir un ion positivo se multiplican son mucho mayores que las energías disponibles en las reacciones químicas. La asignación de electrones entre los átomos en el cálculo de un estado de oxidación es puramente un formalismo, pero es un útil para la comprensión de muchas reacciones químicas.
Para más información sobre problemas con el cálculo de cargas atómicas, consulte carga parcial.
La estructura de Lewis
Cuando una Estructura de Lewis de una molécula está disponible, los estados de oxidación pueden ser asignados por el cálculo de la diferencia entre el número de electrones de valencia que un átomo neutro de ese elemento tendrían y el número de electrones que "pertenecer" a que en la estructura de Lewis. Para los propósitos de cálculo de estados de oxidación, los electrones en un enlace entre los átomos de diferentes elementos pertenecen a la más átomo electronegativo; electrones en un enlace entre los átomos de un mismo elemento se dividen por igual, y los electrones en una par solitario pertenece sólo al átomo con el par solitario.
Por ejemplo, considere el ácido acético :
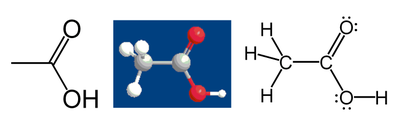
La metil átomo de carbono del grupo tiene 6 electrones de valencia de sus bonos a los átomos de hidrógeno porque el carbono es más electronegativo que el hidrógeno. También, 1 de electrones se obtiene a partir de su unión con el otro átomo de carbono debido a que el par de electrones en el Enlace C-C se divide por igual, dando un total de 7 electrones. Un átomo de carbono neutral tendría 4 electrones de valencia, porque el carbono está en grupo 14 de la tabla periódica. La diferencia, 4 - 7 = -3, es el estado de oxidación de ese átomo de carbono. Es decir, si se supone que todos los enlaces eran 100% iónica (que en realidad no lo son), el carbono se describe como C 3-.
Siguiendo las mismas reglas, el ácido carboxílico átomo de carbono tiene un estado de oxidación de 3 (que sólo se pone un electrón de valencia del enlace C-C; los átomos de oxígeno obtener todos los otros electrones porque el oxígeno es más electronegativo que el carbono). Los átomos de oxígeno ambos tienen un estado de oxidación de -2; Consiguen 8 electrones cada uno (4 de los pares libres y 4 de los bonos), mientras que un átomo de oxígeno neutral tendría 6. Los átomos de hidrógeno todos tienen estado de oxidación +1, ya que entregan su electrón a los átomos más electronegativos a los que están en condiciones de servidumbre.
Inequivalentes átomos de un elemento

Un ejemplo de una molécula con átomos no equivalentes del mismo elemento es el ion tiosulfato (S 2 O 3 2-), para el que la regla de suma algebraica se obtiene el valor medio 2 para el azufre, donde los dos electrones ionizantes se asignan al átomo de azufre terminal. Sin embargo, el uso de una estructura y de electrones Lewis recuento muestra que los dos átomos de azufre son diferentes. El azufre central se le asigna un único electrón de valencia del enlace SS y no hay electrones de valencia de los bonos así, en comparación con seis electrones de valencia para un átomo de azufre libre, por lo que el estado de oxidación del azufre central es 5. El átomo de azufre terminal se le asigna el otro electrón desde el enlace SS más tres pares solitarios para un total de siete electrones de valencia, por lo que su estado de oxidación es -1.
Las reacciones redox
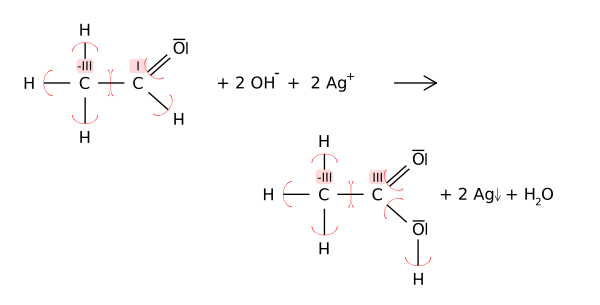
Estados de oxidación pueden ser útiles para equilibrar las ecuaciones químicas para la oxidación-reducción (o redox), debido a los cambios en los átomos oxidados tienen que ser equilibrada por los cambios en los átomos reducidos. Por ejemplo, en la reacción de acetaldehído con el Reactivo de Tollens a ácido acético (mostrado a continuación), el átomo de carbono del carbonilo cambia su estado de oxidación 1-3 (oxidación). Esta oxidación se equilibra mediante la reducción de dos equivalentes de plata de Ag + a Ag 0.
En tales diagramas estructurales para la química orgánica, estados de oxidación están representados por números romanos para distinguirlos de cargos formales (calculados con todos los enlaces covalentes).
Elementos con múltiples estados de oxidación
La mayoría de los elementos tienen más de un estado de oxidación posible. El carbono tiene nueve estados de oxidación número entero, y también hay moléculas en las que el grado medio de oxidación de varios carbonos es fraccionada.
Estados de oxidación enteros de carbono con ejemplos
- -4: CH 4
- -3: C 2 H 6
- -2: CH 3 Cl
- -1: C 2 H 2
- 0: CH 2 Cl 2
- 1: CHCl 2 - CHCl 2
- 2: CHCl 3
- 3: C 2 Cl 6
- 4: CCl4
Ejemplos de estados de oxidación fraccionarias para el carbono
- - (6/5): C 5 H 5 -
- - (6/7): C 7 H 7 +
- - (5/4): C 8 H 8 2-
El oxígeno tiene 8 estados de oxidación diferentes
- -2 En óxidos, por ejemplo, ZnO, CO 2 , H 2 O
- -1 En peróxidos, por ejemplo, H 2 O 2
- - (01.02) en superóxidos, por ejemplo, KO 2
- - (1/3) en inorgánica ozónidos, por ejemplo, OCH 3
- 0 en O 2
- + (1/2) en Dioxigenil, por ejemplo Dioxigenil hexafluoroarseniato O 2 + [AsF 6] -
- 1 en O F 2 2
- 2 en DE 2
Tenga en cuenta que, dado que el flúor es más electronegativo que el oxígeno, O 2 F 2 y DE 2 fluoruros son considerados, en lugar de, respectivamente, un peróxido y un óxido.
Estados de oxidación fraccionarios
Estados de oxidación fraccionarios se utilizan a menudo para representar los estados de oxidación medio de varios átomos en una estructura. Por ejemplo, en KO 2, la ion superóxido tiene una carga de -1 dividida entre dos átomos equivalentes, por lo que cada oxígeno se le asigna un estado de oxidación de -½, Este ion se describe como una híbrido de resonancia de dos estructuras de Lewis, y cada uno de oxígeno tiene estado de oxidación 0 en una estructura y -1 en la otra.
Para el ciclopentadienilo ion C 5 H 5 -, el estado de oxidación de C es (-1) + (-1/5) = -6/5. El -1 se produce porque cada C está unido a uno menos electronegativo H, y la -1/5 porque la carga iónica total se divide entre cinco equivalente C.
Si el promedio se refiere a átomos que no son equivalentes, el estado de oxidación promedio puede no ser representativa de cada uno de los átomos. Esto es cierto en magnetita Fe 3 O 4, cuya fórmula conduce a un estado de oxidación medio de +8/3. De hecho, dos tercios de los iones de hierro son Fe 3+, y un tercio de Fe 2+.
Asimismo, el ozónido ion O 3 - tiene un estado de oxidación medio de -1/3. Este ion es con un oxígeno central, que no es equivalente a los otros dos y no se puede supone que tienen el mismo estado de oxidación en forma de V.
Número de oxidación
El estado de oxidación términos y número de oxidación se usan indistintamente. Sin embargo, número de oxidación se utiliza en química de coordinación con un significado ligeramente diferente. En la química de coordinación, las normas utilizadas para contar los electrones son diferentes: cada electrón en un enlace metal-ligando pertenece a la ligando, independientemente de electronegatividad. Además, los números de oxidación son convencionalmente representados con números romanos, mientras que los estados de oxidación utilizan números indo-arábigos.
Historia
El concepto actual de "estado de oxidación" fue introducido por WM Latimer en 1938. La oxidación en sí fue estudiada por primera vez por Antoine Lavoisier , quien cree que la oxidación era siempre el resultado de reacciones con oxígeno , de ahí el nombre. Aunque la idea de Lavoisier ha demostrado ser incorrecta, el nombre que propone todavía se utiliza, aunque de forma más general.
Estados de oxidación fueron uno de los "peldaños" intelectuales Mendeleev utiliza para derivar la tabla periódica moderna.
Estados de oxidación formales inusuales
Estados de oxidación formales inusuales de metales son importantes en los procesos bioquímicos, los notables son Fe (IV) y Fe (V) en El citocromo P450 sistemas -Con.