
Fósforo
Sabías ...
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Fósforo | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
15 P | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
incoloro, blanco ceroso, amarillo, escarlata, rojo, violeta, negro  blanco ceroso (corte amarillo), rojo (gránulos centro izquierda, centro trozo derecha), y violeta fósforo | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | fósforo, P, 15 | ||||||||||||||||||||||||
| Pronunciación | / F ɒ s F del ər ə s / FOS -fər-əs | ||||||||||||||||||||||||
| Categoría Elemento | no metal | ||||||||||||||||||||||||
| Grupo, período, bloque | 15 (pnictogens), 3, p | ||||||||||||||||||||||||
| Peso atómico estándar | 30.973762 (2) | ||||||||||||||||||||||||
| Configuración electrónica | [ Ne ] 3s 2 3p 3 2, 8, 5 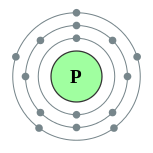 | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Descubrimiento | Hennig Brand (1669) | ||||||||||||||||||||||||
| Reconocido como un elemento de | Antoine Lavoisier (1777) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Densidad (cerca rt) | (Blanco) 1.823, (rojo) ≈ 2,2 a 2,34, (violeta) 2.36, (negro) 2,69 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | (Blanco) de 44,2 ° C, (negro) 610 ° C | ||||||||||||||||||||||||
| Punto de sublimación | (Rojo) ≈ 416-590 ° C, (violeta) 620 ° C | ||||||||||||||||||||||||
| Punto de ebullicion | (Blanco) 280,5 ° C | ||||||||||||||||||||||||
| Calor de fusión | (Blanco) 0,66 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | (Blanco) 12,4 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | (Blanco) 23.824 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión de vapor (blanco) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Presión de vapor (rojo, pb. 431 ° C) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 5, 4, 3, 2, 1, -1, -2, -3 (Levemente ácida óxido) | ||||||||||||||||||||||||
| Electronegatividad | 2,19 (escala de Pauling) | ||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 1011,8 kJ · mol -1 | ||||||||||||||||||||||||
| Segundo: 1907 kJ · mol -1 | |||||||||||||||||||||||||
| Tercero: 2914,1 kJ · mol -1 | |||||||||||||||||||||||||
| Radio covalente | 107 ± 15:00 | ||||||||||||||||||||||||
| Van der Waals radio | 180 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | triclínica 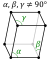 | ||||||||||||||||||||||||
| Ordenamiento magnético | (Blanco, rojo, violeta, negro) diamagnético | ||||||||||||||||||||||||
| Conductividad térmica | (Blanco) 0.236, (negro) 12.1 W · m -1 · K -1 | ||||||||||||||||||||||||
| Módulo de volumen | (Blanco) 5, (rojo) 11 GPa | ||||||||||||||||||||||||
| Número de registro del CAS | 7723-14-0 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de fósforo | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El fósforo es un elemento químico con el símbolo P y número atómico 15. Un multivalente no metal de la grupo de nitrógeno, fósforo como un mineral está casi siempre presente en su estado oxidado al máximo, como inorgánica rocas de fosfato. Existe fósforo elemental en dos grandes formas- fósforo blanco y fósforo rojo pero debido a su alta reactividad, el fósforo se encontraron nunca como elemento libre en la Tierra.
La primera forma de fósforo elemental a ser producido (fósforo blanco, en 1669) emite un débil resplandor sobre la exposición a oxígeno - de ahí su nombre que se da a partir de la mitología griega, Φωσφόρος que significa "portador de luz" (América Lucifer), refiriéndose a la " Estrella de la Mañana ", el planeta Venus . El término " fosforescencia ", lo que significa resplandor después de la iluminación, originalmente deriva de esta propiedad de fósforo, aunque esta palabra ya que se ha utilizado durante un proceso físico diferente que produce un brillo. El resplandor de fósforo en sí origina a partir de la oxidación del blanco (pero no rojo) de fósforo - un proceso que ahora se denomina quimioluminiscencia.
La gran mayoría de los compuestos de fósforo se consumen como fertilizantes . Otras aplicaciones incluyen el papel de los compuestos organofosforados en detergentes, pesticidas y agentes nerviosos, y partidos.
El fósforo es esencial para la vida. Como fosfato, que es un componente de ADN , ARN, ATP , y también el fosfolípidos que forman todas las membranas celulares. Demostrada la relación entre el fósforo y la vida, fósforo elemental fue históricamente aislado por primera vez de la orina humana, y la ceniza de hueso fue una importante fuente de fosfato temprano. Minerales de fosfato son los fósiles. Los bajos niveles de fosfato son un límite importante al crecimiento en algunos sistemas acuáticos. El uso comercial jefe de compuestos de fósforo para la producción de fertilizantes se debe a la necesidad de sustituir el fósforo que las plantas eliminan del suelo.
Características
Físico

El fósforo existe como varias formas ( alótropos ) que exhiben sorprendentemente diferentes propiedades. Los dos alótropos más comunes son fósforo blanco y fósforo rojo. Otra forma, fósforo escarlata, se obtiene lo que permite una solución de fósforo blanco en disulfuro de carbono se evapore en la luz del sol. Fósforo Negro se obtiene calentando el fósforo blanco bajo presiones altas (cerca de 12.000 atmósferas estándar o 1,2 gigapascales). En apariencia, las propiedades y la estructura, se asemeja grafito, siendo negro y escamosa, un conductor de la electricidad, y ha fruncido láminas de átomos enlazados. Otra alótropo es difósforo; contiene un fósforo dímero como una unidad estructural y es altamente reactivo.


La forma más importante de fósforo elemental desde la perspectiva de las aplicaciones y la literatura química es fósforo blanco. Se compone de P 4 moléculas tetraédricas, en el que cada átomo está unido a las otras tres átomos por un enlace sencillo. Esta P 4 tetraedro también está presente en fósforo líquido y gaseoso a la temperatura de 800 ° C cuando se inicia la descomposición de P a 2 moléculas. Existe un sólido blanco en dos formas. A bajas temperaturas-la forma β es estable. A temperaturas altas la forma α es predominante. Estas formas difieren en cuanto a las orientaciones relativas de la constituyente P 4 tetraedros.
El fósforo blanco es el menos estable, el más reactivo, el más volátil, el menos denso , y el más tóxico de los alótropos. El fósforo blanco cambia gradualmente de fósforo rojo. Esta transformación se acelera por la luz y el calor, y las muestras de fósforo blanco casi siempre contienen algo de fósforo rojo y, en consecuencia aparece de color amarillo. Por esta razón también se le llama fósforo amarillo. Brilla en la oscuridad (cuando se expone al oxígeno) con un tinte muy débil de verde y azul, es altamente inflamable y pirofórico (encendido automático) al contacto con el aire y es tóxico (que causa daño hepático severo en la ingestión). Debido a su piroforicidad, fósforo blanco se utiliza como un aditivo en napalm. El olor de la combustión de este formulario tiene un olor característico del ajo, y las muestras se suelen recubrir con blanco "(di) pentóxido de fósforo ", que consiste en P 4 O 10 tetraedros con oxígeno insertado entre los átomos de fósforo y en sus vértices. El fósforo blanco es insoluble en agua pero soluble en disulfuro de carbono.
Termólisis (cracking) de P 4 en 1100 kelvin) da difósforo, P 2. Esta especie no es estable como un sólido o líquido. La unidad dimérica contiene un triple enlace y que es análoga a N 2. También puede ser generado como un intermedio transitorio en solución mediante termólisis de reactivos precursores organofosforados. A temperaturas aún más altas, P 2 se disocia en atómica P.
Aunque el término fosforescencia se deriva de fósforo, la reacción que da fósforo su brillo se llama propiamente quimioluminiscencia (brillante debido a una reacción química en frío), no fosforescencia (luz que anteriormente cayó sobre una sustancia y excitado que re-emisor de luz).


El fósforo rojo
El fósforo rojo es polimérico en estructura. Puede ser visto como un derivado de P 4, en el que un enlace PP se rompe, y un enlace adicional se forma con el tetraedro vecino que resulta en una estructura como una cadena. El fósforo rojo se pueden formar mediante el calentamiento de fósforo blanco a 250 ° C (482 ° F) o mediante la exposición de fósforo blanco a la luz solar. El fósforo después de este tratamiento es amorfo. Tras un calentamiento adicional, este material se cristaliza. En este sentido, el fósforo rojo no es un alótropo, sino más bien una fase intermedia entre el fósforo blanco y violeta, y la mayoría de sus propiedades tienen un rango de valores. Por ejemplo, recién preparada, fósforo rojo brillante es altamente reactivo y enciende a aproximadamente 300 ° C, aunque todavía es más estable que el fósforo blanco, que se inflama a aproximadamente 30 ° C. Después de calentar o almacenamiento prolongado, los oscurece color (ver imágenes listadas); el producto resultante es más estable y no se inflama espontáneamente en el aire.
Fósforo violeta
Fósforo Violet es una forma de fósforo que puede ser producido por un día de duración de recocido de fósforo rojo por encima de 550 ° C. En 1865, Hittorf descubrió que cuando el fósforo se recristalizó en fundido de plomo , se obtiene una forma de color rojo / púrpura. Por lo tanto esta forma se conoce a veces como "el fósforo de Hittorf" (o violeta o α-metálico fósforo).

Fósforo negro
Fósforo negro es el alótropo reactiva menos y la forma termodinámicamente estable por debajo de 550 ° C. También se sabe como fósforo β-metálico y tiene una estructura algo parecida a la de grafito. Las altas presiones se requieren generalmente para producir fósforo negro, pero también se pueden producir en condiciones ambientales utilizando sales de metales como catalizadores.
| Forma | blanco (α) | blanco (β) | violeta | negro |
|---|---|---|---|---|
| Simetría | Centrada en el cuerpo cúbico | Triclínico | Monoclínico | Ortorrómbico |
| Símbolo de Pearson | AP24 | mP84 | OS8 | |
| Grupo espacial | I 4 3m | P 1 No.2 | P2 / c No.13 | CMCA No.64 |
| Densidad (g / cm 3) | 1,828 | 1.88 | 2.36 | 2.69 |
| Bandgap (eV) | 2.1 | 1.5 | 0.34 | |
| Índice de refracción | 1.8244 | 2.6 | 2.4 |
Isótopos
Veintitrés isótopos de fósforo son conocidos, incluyendo todas las posibilidades desde el 24 hasta el 46 P P. Sólo 31 P es estable y es por lo tanto, presente en 100% abundancia. El medio entero spin nuclear y gran abundancia de 31 P maquillaje fósforo-31 espectroscopía de RMN una herramienta analítica muy útil en estudios de muestras que contienen fósforo.
Dos isótopos radioactivos de fósforo tener vidas medias que los hacen útiles para experimentos científicos. 32 P tiene una vida media de 14,262 días y 33 P tiene una vida media de 25,34 días. Las biomoléculas pueden ser "etiquetados" con un radioisótopo para permitir el estudio de muestras muy diluidas.
Radiactivos isótopos de fósforo incluyen
- 32 P, una beta-emisor (1,71 MeV), con una vida media de 14,3 días, que se utiliza de forma rutinaria en los laboratorios de ciencias de la vida, principalmente para producir radiomarcado ADN y ARN sondas, por ejemplo para uso en Transferencias Northern o Transferencias Southern. Debido a que las partículas beta de alta energía producidos piel penetrar y córneas , y porque cualquier 32P se ingiere, inhala o absorbe se incorpora fácilmente en los huesos y ácidos nucleicos, Administración de Seguridad y Salud de los Estados Unidos, y de instituciones similares en otros países desarrollados requieren que una bata de laboratorio, usar guantes desechables y gafas de seguridad cuando se trabaja con 32 P, y que trabajar directamente sobre un recipiente abierto evitarse con el fin para proteger los ojos. Monitoreo, ropa, y la contaminación superficial personal también es necesario. Además, debido a la alta energía de las partículas beta, blindaje esta radiación con los materiales densos normalmente utilizados (por ejemplo, plomo), da lugar a la emisión secundaria de Los rayos X a través de Bremsstrahlung (radiación de frenado). Por lo tanto blindaje deberá efectuarlo con materiales de baja densidad, por ejemplo plexiglás (Lucite), otros plásticos, agua, o (cuando no se requiere transparencia), incluso la madera.
- 33 P, un emisor beta (0,25 MeV), con una vida media de 25,4 días. Se usa en los laboratorios de ciencias de la vida en aplicaciones en las que las emisiones beta de energía más bajos son ventajosas tales como ADN secuenciación.
Aparición
En términos de la nucleosíntesis estelar, formas estables de fósforo se producen en grandes (de más de 3 masas solares) mediante la fusión de dos estrellas de oxígeno unidos a los átomos. Esto requiere temperaturas superiores a 1.000 megakelvins.
El fósforo no se encuentra libre en la naturaleza, sino que se distribuye ampliamente en muchos minerales , fosfatos principalmente. Fuentes comerciales históricamente importantes, pero limitados eran orgánicos, tales como ceniza de hueso y (en este último 19 de siglo) guano. Roca de fosfato inorgánico, que está parcialmente hecha de apatita (un fosfato mineral tricálcico impuro), es hoy la principal fuente comercial de este elemento. Alrededor del 50 por ciento de las reservas mundiales de fósforo se encuentran en las naciones árabes. Grandes depósitos de apatita se encuentran en china , Rusia , Marruecos , Florida , Idaho, Tennessee, Utah, y en otros lugares. Albright y Wilson en el Reino Unido y su Cataratas del Niágara de la planta, por ejemplo, estaban utilizando la roca de fosfato en los años 1890 y 1900 de Tennessee, Florida, y el Isla del Gran Condestable ( fuentes de guano de la isla de fosfato); en 1950 estaban usando fosfato de roca principalmente de Tennessee y el Norte de África. A principios de 1990 el negocio de ácido fosfórico húmedo purificado Albright y Wilson estaba siendo afectado negativamente por las ventas de roca de fosfato por parte de China y la entrada de su larga proveedores de fosfatos marroquíes en el negocio de ácido fosfórico húmedo purificado.
En 2012, el USGS estima 71 mil millones de toneladas de las reservas mundiales, en las cifras de las reservas se refieren a la cantidad asumió recuperable a precios corrientes de mercado; 0190000000 toneladas fueron minados en 2011.
Informes recientes sugieren que la producción de fósforo puede haber tocado techo, lo que lleva a la posibilidad de una escasez mundial para el año 2040. En el año 2007, a un ritmo de consumo, se estimó el suministro de fósforo para funcionar en 345 años. Sin embargo, algunos científicos creen ahora que una " fósforo pico "se producirán en 30 años y que" Al ritmo actual, las reservas se agotarán en los próximos 50 a 100 años. "El fósforo comprende aproximadamente 0,1% en masa de la roca promedio, y en consecuencia la oferta de la Tierra es enorme, aunque diluida .
Producción
La mayoría de los compuestos que contienen fósforo se producen para su uso como fertilizantes. Para este propósito, los minerales que contienen fosfato se convierten en ácido fosfórico. Dos rutas diferentes se emplean, siendo el principal tratamiento de minerales de fosfato con ácido sulfúrico. El otro proceso utiliza fósforo blanco, que se pueden producir por reacción y destilación a partir de fuentes de fosfato muy bajo grado. El fósforo blanco es luego oxidado a ácido fosfórico y posteriormente se neutraliza con una base para dar sales de fosfato. El ácido fosfórico obtenido a través de fósforo blanco es relativamente puro y es la principal fuente de fosfatos utilizados en detergentes y otras aplicaciones que no sean de fertilizantes.
Fósforo elemental
Actualmente, alrededor de 1.000.000 toneladas cortas (910.000 t) de fósforo elemental se dan anualmente. El fosfato de calcio (piedra de fosfato), en su mayoría extraído en la Florida y el norte de África, se puede calentar a 1.200-1.500 ° C con la arena, que es principalmente SiO2, y coque (carbono impuro) para producir P vaporizado 4. El producto se condensa posteriormente en un polvo blanco bajo el agua para evitar la oxidación por el aire. Incluso bajo el agua, fósforo blanco se convierte poco a poco a la más estable fósforo rojo alótropo . La ecuación química para este proceso cuando se parte de fluoroapatita, un mineral de fosfato común, es:
- 4 Ca 5 (PO 4) 3 F + 18 SiO 2 + 30 C → 3 P 4 + 30 + 18 CO CaSiO 3 + 2 CaF 2
Productos secundarios de esta producción incluyen ferrofósforo, una forma cruda de Fe 2 P, producto de impurezas de hierro en los precursores de minerales. El silicato escoria es un material de construcción útil. El fluoruro se recuperó a veces para su uso en la fluoración del agua. Más problemática es un "lodo" que contiene cantidades significativas de fósforo blanco. Producción de fósforo blanco se lleva a cabo en grandes instalaciones en parte porque es energía intensiva. El fósforo blanco es transportada en forma fundida. Algunos accidentes graves se han producido durante el transporte, entrenar descarrilamientos en Brownston, Nebraska y Miamisburg, Ohio llevó a los grandes incendios. El peor incidente en los últimos tiempos era una ambiental en 1968, cuando el mar se contaminó debido a derrames y / o inadecuadamente tratadas las aguas residuales de una planta de fósforo blanco en Placentia Bay, Terranova.
Otro proceso por el cual se extrae el fósforo elemental incluye la aplicación a altas temperaturas (1500 ° C):
- 2 Ca 3 (PO 4) 2 + 6 SiO 2 + 10 C → 6CaSiO 3 + 10 CO + P 4
Thermphos Internacional es el único productor de fósforo elemental con la capacidad anual de 80.000 t proporcionados por una planta en Vlissingen, Países Bajos de Europa.
Compuestos
Oxoácidos de fósforo
Oxoácidos de fósforo son extensos, a menudo de importancia comercial, ya veces estructuralmente complicado. Todos ellos tienen protones ácidos unidos a átomos de oxígeno y algunas tienen protones no ácidos que se unen directamente al fósforo. Aunque se forman muchos oxoácidos de fósforo, sólo nueve son importantes, y tres de ellos, ácido hipofosforoso, ácido fosforoso, y ácido fosfórico, son los particularmente importantes.
| Estado de oxidación | Fórmula | Nombre | Protones ácidos | Compuestos |
|---|---|---|---|---|
| 1 | HH 2 PO 2 | Ácido hipofosforoso | 1 | ácidos, sales |
| 3 | H 2 HPO 3 | Ácido fosforoso | 2 | ácidos, sales |
| 3 | HPO 2 | ácido metaphosphorous | 1 | sales |
| 3 | H 3 PO 3 | (Orto) ácido fosforoso | 3 | ácidos, sales |
| 5 | (HPO 3) n | ácidos metafosfórico | n | sales (n = 3,4,6) |
| 5 | H (HPO 3) n OH | ácidos polifosfóricos | n + 2 | ácidos, sales (n = 1-6) |
| 5 | H 5 P 3 O 10 | ácido tripolifosfórico | 3 | sales |
| 5 | H 4 P 2 O 7 | ácido pirofosfórico | 4 | ácidos, sales |
| 5 | H 3 PO 4 | (Orto) ácido fosfórico | 3 | ácidos, sales |
Fósforo (V) compuestos
Óxidos
Los compuestos de fósforo más prevalentes son derivados de fosfato (PO 4 3-), un anión tetraédrico. El fosfato es la base conjugada del ácido fosfórico, que se produce de forma masiva para su uso en fertilizantes. Ser triprótico, ácido fosfórico convierte paso a paso para tres bases conjugadas:
- H 3 PO 4 + H 2 O
 H 3 O + + H 2 PO 4 - K a1 = 7,25 × 10 -3
H 3 O + + H 2 PO 4 - K a1 = 7,25 × 10 -3
- H 2 PO 4 - + H 2 O
 H 3 O + + HPO 4 2- K a2 = 6,31 × 10 -8
H 3 O + + HPO 4 2- K a2 = 6,31 × 10 -8
- HPO 4 2- + H 2 O
 H 3 O + + PO 4 3- K a3 = 3,98 × 10 -13
H 3 O + + PO 4 3- K a3 = 3,98 × 10 -13
Fosfato exhibe la tendencia a formar cadenas y anillos con bonos POP. Muchos polifosfatos son conocidos, incluyendo ATP . Los polifosfatos surgen por la deshidratación de los fosfatos de hidrógeno tales como HPO 4 2- y H 2 PO 4 -. Por ejemplo, el trifosfato trisódico industrialmente importante (también conocido como tripolifosfato de sodio, STPP) se produce industrialmente en una escala megatonelada a través de este reacción de condensación:
- 2 Na 2 [(HO) PO 3] + Na [(HO) 2 PO 2] → Na 5 [O 3 POP (O) 2 -O-PO 3] + 2 H 2 O
Pentóxido de fósforo (P 4 O 10) es el anhídrido de ácido de ácido fosfórico, pero varios productos intermedios son conocidos entre los dos. Esta cera reacciona sólidos blancos vigorosamente con agua.

Con el metal cationes , fosfato forma una variedad de sales. Estos sólidos son poliméricos, con vínculos POM. Cuando el catión de metal tiene una carga de 2+ o 3+, las sales son generalmente insolubles, por lo tanto, existen como minerales comunes. Muchas sales de fosfato se derivan de hidrógeno fosfato (HPO 4 2-).
PCl 5 y PF 5 son compuestos comunes. Ambos son volátiles y pálido o incoloro. Los otros dos haluros, PBr 5 y PI 5 PI 5 son inestables. El pentacloruro y pentafluoruro adoptan trigonal bipiramidal geometría molecular y están Ácidos de Lewis. Con fluoruro, PF 5 formas PF 6 -, un anión que es isoelectrónico con SF 6. El oxihaluro más importante es oxicloruro de fósforo (POCl3), que es tetraédrica.
Antes de los cálculos informáticos extensos eran viables, se propuso que la unión de fósforo (V) Los compuestos orbitales d involucrados. Actualmente se acepta que la unión puede ser mejor explicado por teoría de orbitales moleculares e implica sólo s- y orbitales p en fósforo.
Nitruros
Existen compuestos de la fórmula (2) PNCL n principalmente como anillos, tales como la trimer hexachlorophosphazene. Los fosfacenos surgen por el tratamiento de pentacloruro de fósforo con cloruro de amonio: PCl 5 + NH 4 Cl → 1 / n (NPCL 2) n + 4 HCl Los grupos cloruro se puede sustituir por alcóxido (RO -) para dar lugar a una familia de polímeros con propiedades potencialmente útiles.
Sulfuros
El fósforo forma una amplia gama de sulfuros de fósforo, en donde puede ser P (V), P (III) u otros estados de oxidación. El más famoso es el tres veces simétrica P 4 S 3 usado en huelga de cualquier parte de los partidos. P 4 S 10 y P 4 O 10 tienen estructuras análogas.
De fósforo (III) compuestos
La fosfina (PH 3) y sus derivados orgánicos (PR 3) son análogos estructurales con amoníaco (NH 3), pero los ángulos de enlace en el fósforo están más cerca de 90 ° para fosfina y sus derivados orgánicos. Es un mal olor, compuesto tóxico. La fosfina se produce por hidrólisis de fosfuro de calcio, Ca 3 P 2. A diferencia de amoníaco, fosfina se oxida por el aire. La fosfina es también mucho menos básico que el amoníaco.
Los cuatro trihaluros simétricos son bien conocidos: gaseosa PF 3, los líquidos amarillentos PCl 3 y PBr 3 , y el sólido PI 3. Estos materiales son sensibles a la humedad, la hidrólisis para dar ácido fósforo. El tricloruro, un reactivo común, es producido por cloración de fósforo blanco:
- P 4 + 6 Cl 2 → 4 PCl3
El trifluoruro es producido por el tricloruro de por intercambio de haluro. PF 3 es tóxico porque se une a hemoglobina.
El fósforo óxido (III), P 4 O 6 (también llamado hexóxido tetrafósforo) es el anhídrido del P (OH) 3, el menor tautómero de ácido fosforoso. La estructura de P 4 O 6 es como la de P 4 O 10 menos los grupos de óxido de terminales.
Oxihaluros mixtos y oxyhydrides de fósforo (III) son casi desconocidas.
Los compuestos organofosforados
Los compuestos con bonos de PC y POC se clasifican a menudo como compuestos organofosforados. Son ampliamente utilizados comercialmente. El PCl 3 sirve como una fuente de P 3+ en rutas a organofosforados (III) compuestos. Por ejemplo, es el precursor de trifenilfosfina:
- PCl 3 + 6 Na + 3 C 6 H 5 Cl → P (C 6 H 5) 3 + 6 NaCl
Tratamiento de trihaluros de fósforo con alcoholes y fenoles da fosfitos, por ejemplo, trifenilfosfito:
- PCl 3 + 3 C 6 H 5 OH → P (OC 6 H 5) 3 + 3 HCl
Reacciones similares se producen por oxicloruro de fósforo , proporcionando trifenilfosfato:
- OPCl 3 + 3 C 6 H 5 OH → OP (OC 6 H 5) 3 + 3 HCl
Fósforo (I) y fósforo (II) compuestos
Estos compuestos generalmente cuentan con bonos PP. Los ejemplos incluyen derivados de fosfina y organofosfinas concatenadas. El gas altamente inflamable difosfina (P 2 H 4) es el primero de una serie de derivados de este tipo. Difosfina es un análogo de hidrazina. Compuestos que contienen P = También se han observado dobles enlaces P, aunque son raros.

Fosfuros
El ion fosfuro es P 3-. Fosfuros surgen por la reacción de los metales con fósforo rojo. Las sales de P 3- no existen en solución y estos derivados son refractarios, lo que refleja su alto energía reticular. Ilustrado por el comportamiento fosfuro de calcio, muchos fosfuros metálicos se hidrolizan en agua con liberación de fosfina:
- Ca 3 P 2 + 6 H2O + → 2 PH 3 3 Ca (OH) 2
Schreibersita es un fosfuro natural que se encuentra en los meteoritos. Muchos polyphosphides son conocidos como los derivados de OSP 2. Estos pueden ser estructuralmente compleja que van desde 3 Na P 7 y derivados de P 26 4-. A menudo estas especies adoptan estructuras de jaula que se asemejan a fragmentos de fósforo violeta.
Ortografía y etimología
El nombre de fósforo en la antigua Grecia era el nombre por el planeta Venus y se deriva de los griegos palabras (φως = luz, φέρω = carry), que se traduce aproximadamente como portador de luz o portador de luz. (En la mitología griega y la tradición, Augerinus (Αυγερινός = estrella de la mañana, en uso hasta la actualidad), Hesperus o Hesperinus (Εσπερος o Εσπερινός o Αποσπερίτης = estrella de la tarde, en uso hasta hoy) y Eosphorus (Εωσφόρος = dawnbearer, no esté en uso para el planeta después del cristianismo) son homólogos cercanos, y también se asocia con Fósforo-el-planeta).
Según el Diccionario Inglés de Oxford, la ortografía correcta del elemento es fósforo. La palabra de fósforo es la forma adjetival de la P 3+ valencia: así, al igual que de azufre formas de azufre compuestos ic sas y azufre, fósforo nos forma compuestos sas de fósforo (por ejemplo, ácido fosfórico) y los compuestos de fósforo ic valencia P 5+ (por ejemplo, ácidos fosfóricos y fosfatos).
Historia y descubrimiento
El fósforo es el elemento 13 al ser descubierto. Por este motivo, y también debido a su uso en explosivos, venenos y agentes nerviosos, se refiere a veces como "elemento del Diablo". Fue el primer elemento que se descubrió que no era conocido desde la antigüedad. El descubrimiento de fósforo se le atribuye a la alquimista alemán Hennig Brand en 1669, aunque otros químicos podrían haber descubierto el fósforo en la misma época. Marca experimentó con orina, que contiene cantidades considerables de fosfatos disueltos del metabolismo normal. Trabajar en Hamburgo , marca intentó crear la legendaria piedra filosofal a través de la destilación de algunos sales por evaporación de la orina, y en el proceso de producir un material blanco que brillaba en la oscuridad y se quema de manera brillante. Fue nombrado mirabilis fósforo ("portador milagrosa de la luz"). Su proceso originalmente involucrado dejando orina de pie durante días hasta que despedía un olor terrible. Luego se hierve abajo a una pasta, calienta esta pasta a una temperatura alta, y llevó a los vapores a través del agua, donde se esperaba que pudieran condensarse en oro. En cambio, se obtiene una sustancia blanca y cerosa que brillaba en la oscuridad. Brand descubrió el fósforo, el primer elemento descubierto desde la antigüedad. Ahora sabemos que la marca de fábrica produce hidrógeno fosfato de sodio de amonio, (NH4) NaHPO4. Mientras que las cantidades eran esencialmente correctos (que tomó cerca de 1.100 litros de orina para hacer aproximadamente 60 g de fósforo), no era necesario para permitir que la orina se pudra. Científicos más tarde se descubre que la orina fresca produjo la misma cantidad de fósforo.

Marca en un principio trató de mantener en secreto el método, pero más tarde vendió la receta de 200 táleros a D Krafft de Dresde, que ahora podrían hacerlo así, y recorrió gran parte de Europa con él, incluyendo Inglaterra, donde se reunió con Robert Boyle . El secreto que se hizo a partir de la orina se filtró y primera Johann Kunckel (1630-1703) en Suecia (1678) y más tarde Boyle en Londres (1680) también lograron hacer fósforo. Boyle afirma que Krafft le dio ninguna información en cuanto a la preparación de fósforo distintas de los que se deriva de "algo que pertenecían al cuerpo del hombre". Esto dio Boyle una pista valiosa, sin embargo, por lo que él, también, logró hacer el fósforo, y publicó el método de su fabricación. Más tarde se mejoró el proceso de Brand, utilizando arena en la reacción (aún utilizando orina como material de base),
- 4 NaPO3 + 2 SiO2 + 10 C → 2 Na 2 SiO 3 + 10 + CO P 4
Robert Boyle fue el primero en utilizar el fósforo para encender las tablillas de madera con punta de azufre, precursores de nuestros partidos modernos, en 1680.
En 1769 Johan Gottlieb Gahn y Carl Wilhelm Scheele mostró que el fosfato de calcio (Ca 3 (PO 4) 2) se encuentra en los huesos, y se obtiene fósforo elemental a partir de cenizas de hueso. Antoine Lavoisier reconocido como un elemento de fósforo en 1777. ceniza de hueso fue la principal fuente de fósforo hasta que la década de 1840. El método iniciado por tostación huesos, entonces emplea el uso de la arcilla retortas encerrado en un horno de ladrillo muy caliente para destilar el producto fósforo elemental altamente tóxico. Alternativamente, los fosfatos precipitados podrían hacerse a partir de huesos molidos que había sido engrasados-DE y tratados con ácidos fuertes. fósforo blanco podría entonces ser realizada por calentamiento de los fosfatos precipitados, mezclado con carbón molido o carbón vegetal en una olla de hierro, y eliminación por destilación del vapor de fósforo en un retorta. El monóxido de carbono y otros gases inflamables producidos durante el proceso de reducción se queman en una chimenea de la antorcha.
En la década de 1840, la producción de fosfato mundo volvió a la explotación de los yacimientos de la isla tropical formada de pájaros y murciélagos guano (véase también Ley de islas guaneras). Estos se convirtieron en una importante fuente de fosfatos para fertilizantes en la segunda mitad del siglo 19.
Roca de fosfato, un mineral que contiene fosfato de calcio, se utilizó por primera vez en 1850 para hacer fósforo, y después de la introducción del horno de arco eléctrico en 1890, la producción de fósforo elemental conmutado desde la calefacción hueso de ceniza, a la producción de arco eléctrico de la roca de fosfato. Después de que el agotamiento de las fuentes de guano mundo casi al mismo tiempo, los fosfatos minerales se convirtieron en la principal fuente de producción de fertilizantes de fosfato. Producción de roca fosfórica aumentó considerablemente después de la Segunda Guerra Mundial, y sigue siendo la fuente global principal de fósforo y productos químicos de fósforo en la actualidad. Ver el artículo sobre fósforo pico para obtener más información sobre la historia y el estado actual de la minería de fosfatos. Roca de fosfato sigue siendo una materia prima en la industria de los fertilizantes, donde se trata con ácido sulfúrico para producir diversos " superfosfato "productos fertilizantes.
El fósforo blanco se hizo comercialmente por primera vez en el siglo 19 para la industria de partido. Este utiliza ceniza de hueso para una fuente de fosfato, como se describe anteriormente. El proceso hueso ceniza quedó obsoleto cuando el horno de arco sumergido para la producción de fósforo se introdujo para reducir la roca de fosfato. El método permitió la producción de horno eléctrico para aumentar hasta el punto donde el fósforo se podrían utilizar en armas de guerra. En la Primera Guerra Mundial fue utilizado en bombas incendiarias, cortinas de humo y balas trazadoras. Una bala incendiaria especial fue desarrollado para disparar a hidrógeno , repleto Zepelines más de Bretaña (siendo hidrógeno altamente inflamable si puede ser encendido). Durante la Segunda Guerra Mundial , Cócteles molotov de benceno y el fósforo se distribuyeron en Gran Bretaña a los civiles seleccionado especialmente dentro de la operación resistencia británica, para la defensa; y fósforo bombas incendiarias fueron utilizados en la guerra a gran escala. Is Burning fósforo difíciles de extinguir y si salpica la piel humana tiene efectos terribles.
Partidos tempranas utilizaron fósforo blanco en su composición, que era peligroso debido a su toxicidad. Los asesinatos, suicidios y accidentes intoxicaciones resultado de su uso. (Un cuento apócrifo habla de una mujer de intentar asesinar a su marido con fósforo blanco en su comida, que fue detectado por el guiso de desprendiendo vapor luminoso). Además, la exposición a los vapores dio a los trabajadores de los partidos una severa necrosis de los huesos de la mandíbula, la infame " fosfonecrosis ". Cuando se descubrió un proceso seguro para la fabricación de fósforo rojo, con su inflamabilidad y toxicidad mucho menor, se promulgaron leyes, bajo la Convenio de Berna (1906), lo que requiere su adopción como una alternativa más segura para la fabricación partido. La toxicidad del fósforo blanco llevó a la interrupción de él uso en los partidos. En una coincidencia histórica, los aliados utilizaron fósforo bombas incendiarias en la Segunda Guerra Mundial para destruir Hamburgo, el lugar donde el "portador de la luz milagrosa" fue descubierto por primera vez.
El brillo, la explicación, y el término derivado de él
. Se sabía desde los primeros tiempos que el resplandor verde que emana de fósforo blanco persistiría durante un tiempo en un frasco con tapón, pero luego cesar Robert Boyle en la década de 1680 atribuye al "debilitamiento" del aire; de hecho, es el oxígeno se consume. En el siglo 18, se sabe que en oxígeno puro, el fósforo no brillan en absoluto; sólo hay una gama de presión parcial a la que lo hace. El calor puede ser aplicado para conducir la reacción a presiones más altas.
En 1974, el resplandor se explica por RJ van Zee y AU Khan. Una reacción con el oxígeno tiene lugar en la superficie del sólido (o líquido) de fósforo, formando las moléculas de vida corta y HPO P 2 O 2 que tanto emitir luz visible. La reacción es lenta y sólo muy poco de los compuestos intermedios son necesarios para producir la luminiscencia, por lo tanto, el tiempo extendido el resplandor continúa en un frasco con tapón.
Desde ese tiempo, fósforos y fosforescencia se utiliza libremente para describir las sustancias que brillan en la oscuridad sin quemarse. Sin embargo, como se mencionó anteriormente, aunque el término fosforescencia fue acuñado originalmente como un término por analogía con el resplandor de la oxidación de fósforo elemental, es ahora reservado para otro proceso de re-emisión fundamentalmente diferente de la luz después de la iluminación.
Aplicaciones
Fertilizantes
La aplicación dominante de fósforo está en fertilizantes, que proporciona fosfato como se requiere para toda la vida y es a menudo un nutriente limitante para los cultivos. El fósforo, siendo un nutriente esencial para las plantas, encuentra su uso principal como componente de fertilizantes para la agricultura y la producción agrícola en forma de ácidos fosfóricos concentrados, que pueden consistir de 70% a 75% P 2 O 5 . La demanda mundial de fertilizantes llevó al gran aumento de fosfato (PO 4 3- ) de producción en la segunda mitad del siglo 20. Debido a la naturaleza esencial de fósforo para los organismos vivos, la baja solubilidad de compuestos que contienen fósforo naturales, y el ciclo natural lenta del fósforo, la industria agrícola es muy dependiente de los fertilizantes que contienen fosfato, sobre todo en forma de superfosfato de cal. El superfosfato de cal es una mezcla de dos sales de fosfato, dihidrógeno fosfato de calcio Ca (H 2 PO 4 ) 2 y sulfato de calcio dihidratado CaSO 4 · 2H 2 O producido por la reacción de ácido sulfúrico y agua con fosfato de calcio.
| Compuestos ampliamente usados | Uso |
|---|---|
| Ca (H2PO4)2· H2O | Polvo de hornear y fertilizantes |
| CaHPO4· 2H2O | Aditivo alimentario animal, polvo dental |
| H 3 PO 4 | Fabricación de fertilizantes fosfatados |
| PCl3 | Fabricación de POCl3y pesticidas |
| POCl3 | Plastificante Manufactura |
| P4S10 | Fabricación de aditivos y pesticidas |
| Na5P3O10 | Detergentes |
Los compuestos organofosforados
El fósforo blanco se utiliza ampliamente para hacer compuestos organofosforados, a través de los intermedios cloruros de fósforo y dos sulfuros de fósforo, pentasulfuro de fósforo, y sesquisulfuro de fósforo. Compuestos organofosforados tienen muchas aplicaciones, incluyendo en plastificantes, retardantes de llama, pesticidas, agentes de extracción, y tratamiento de aguas. en particular el herbicida glifosato venden bajo la marca Roundup.
Aspectos metalúrgicos
El fósforo es también un componente importante en el acero de producción, en la fabricación de bronce de fósforo, y en muchos otros productos relacionados. El fósforo se añade a cobre metálico durante su proceso de fundición para reaccionar con el oxígeno presente como una impureza en el cobre y para producir cobre que contiene fósforo ( CuOFP) las aleaciones con un alto resistencia a la fragilización por hidrógeno que el cobre normal.
Cerillas

Partidos contenidos en fósforo se produjeron por primera vez en la década de 1830 y contenía una mezcla de fósforo blanco, un compuesto que libera oxígeno ( cloruro de potasio, dióxido de plomo o algún nitrato ) y un aglutinante en sus cabezas. Eran bastante sensible a las condiciones de almacenamiento, tóxico y peligroso, ya que pueden ser iluminadas por golpear en cualquier superficie áspera. Por lo tanto, su producción fue prohibida gradualmente entre 1872 y 1925 en diferentes países. El internacional Convenio de Berna, adoptado en 1906, prohibió el uso de fósforo blanco en los partidos. Como consecuencia de ello, los partidos de la "huelga-en cualquier lugar 'fueron reemplazados gradualmente por' fósforos de seguridad", donde el fósforo blanco fue sustituido por sesquisulfuro de fósforo (P 4 S 3 ), azufre o sulfuro de antimonio. Estos partidos son difíciles de encender en una superficie arbitraria y requieren una tira especial. La tira contiene fósforo rojo que se calienta al golpear, reacciona con el compuesto liberador de oxígeno en la cabeza y se inflama el material inflamable de la cabeza.
El ablandamiento del agua
El tripolifosfato de sodio a partir de ácido fosfórico se utiliza en detergentes de lavandería en algunos países, pero prohibido para este uso en otros. Es útil para ablandar el agua para mejorar el rendimiento de los detergentes y para evitar que la tubería / caldera de tubo de la corrosión .
Aplicaciones de nicho
- Los fosfatos se utilizan en la fabricación de especialesgafasque se utilizan paralas lámparas de sodio.
- Bone-ash,fosfato de calcio, se usa en la producción de porcelana fina.
- El ácido fosfórico hecha de fósforo elemental se utiliza en aplicaciones alimentarias tales como algunas bebidas de soda. El ácido es también un punto de partida para que los fosfatos de grado alimenticio. Estos incluyen fosfato monocálcico que se emplea en polvo de hornear y tripolifosfato de sodio y otros fosfatos de sodio. Entre otros usos éstos se utilizan para mejorar las características de la carne procesada y queso. Otros se utilizan en pasta de dientes.
- El fósforo blanco, llamado "WP" (término del argot "Willie Peter") se utiliza en aplicaciones militares como bombas incendiarias, por humo cribado como botes de humo y bombas de humo, y en la munición trazadora. También es una parte de una obsoleta granada de mano M34 fósforo blanco estadounidense. Esta granada de usos múltiples se utiliza sobre todo para la señalización, pantallas de humo y la inflamación; sino que también podría causar quemaduras graves y tuvo un impacto psicológico sobre el enemigo. Usos militares de fósforo blanco se ven limitados por el derecho internacional
- En cantidades traza, fósforo se utiliza como undopante paralos semiconductores de tipo n.
- 32P y33P se utilizan como trazadores radiactivos en laboratorios bioquímicos.
- El fosfato es un fuerteagente complejante para el hexavalente(UO uranilo2 2+) especies y esta es la razón por laapatita y otros fosfatos naturales a menudo pueden ser muy rica enuranio.
- Tributilfosfato es unorganofosforado soluble enqueroseno y utilizado para extraer uranio en elproceso Purex se aplica en el reprocesamiento decombustible nuclear gastado.
Papel biológico
Fósforo inorgánico en forma de fosfato PO 3-
4 se requiere para todas las formas conocidas de vida , jugando un papel importante en moléculas biológicas tales como ADN y ARN, donde forma parte del marco estructural de estas moléculas. Las células vivas también utilizan fosfato para el transporte de energía celular en forma de trifosfato de adenosina (ATP). Casi cada proceso celular que utiliza la energía obtiene en la forma de ATP. ATP también es importante para la fosforilación, un evento reguladora clave en las células. Los fosfolípidos son los principales componentes estructurales de todas las membranas celulares. sales de fosfato de calcio ayudan en rigidización huesos.
Las células vivas se definen por una membrana que la separa de su entorno. Las membranas biológicas están hechos de una matriz de fosfolípido y proteínas, típicamente en la forma de una bicapa. Los fosfolípidos se derivan de glicerol, de tal manera que dos de los grupos hidroxilo de glicerol (OH) protones han sido sustituidos con ácidos grasos como un éster, y la tercera protón hidroxilo ha sido sustituido con fosfato enlazada a otro alcohol.
Un adulto humano promedio contiene alrededor de 0,7 kg de fósforo, alrededor del 85-90% del que está presente en huesos y dientes en forma de apatita, y el resto en los tejidos blandos y fluidos extracelulares (~ 1%). El contenido de fósforo aumenta desde aproximadamente 0,5% en peso en la infancia a 0,65 a 1,1% en peso en los adultos. Concentración media de fósforo en la sangre es de aproximadamente 0,4 g / L, alrededor del 70% de que es orgánico y 30% fosfatos inorgánicos. Un adulto bien alimentado en el mundo industrializado consume y excreta aproximadamente 1-3 gramos de fósforo por día, con un consumo en forma de fosfato inorgánico y biomoléculas que contienen fósforo tales como los ácidos nucleicos y fosfolípidos; y la excreción casi exclusivamente en forma de iones de fosfato tales como H 2 PO -
4 y HPO 2-
4 . Sólo alrededor del 0,1% de fosfato de cuerpo circula en la sangre, y esta cantidad refleja la cantidad de fosfato disponible a las células de tejidos blandos.
Huesos y dientes esmalte
El componente principal del hueso es la hidroxiapatita, así como formas amorfas de fosfato de calcio, posiblemente incluyendo carbonato. La hidroxiapatita es el componente principal del esmalte dental. La fluoración del agua aumenta la resistencia de los dientes a la caries por la conversión parcial de este mineral para el material todavía más difícil llamado fluoroapatite:
- Ca5(PO4)3OH+F-→Ca5(PO4)3F+OH-
La deficiencia de fósforo
En medicina, los síndromes de baja de fosfato son causadas por la desnutrición, por el fracaso de absorber fosfato, y síndromes metabólicos que dibujan el fosfato de la sangre (como la realimentación después de la desnutrición) o pasan demasiado de él en la orina. Todas se caracterizan por hipofosfatemia, que es una condición de niveles bajos de los niveles de fosfato solubles en el suero de la sangre, y por lo tanto dentro de las células. Los síntomas de la hipofosfatemia incluyen muscular y disfunción neurológica, y la alteración de las células del músculo y la sangre debido a la falta de ATP. El exceso de fosfato puede causar diarrea y calcificación (endurecimiento) de los órganos y los tejidos blandos, y puede interferir con la capacidad del cuerpo para utilizar el hierro, calcio, magnesio y zinc.
El fósforo es un elemento esencial para las plantas macromineral, que se estudia ampliamente en edafología para entender absorción de la planta desde el suelo sistemas. En ecológicos términos, el fósforo es a menudo un factor limitante en muchos ambientes; es decir, la disponibilidad de fósforo regula la tasa de crecimiento de muchos organismos. En ecosistemas de un exceso de fósforo puede ser problemático, especialmente en los sistemas acuáticos, resultando en la eutrofización que a veces conduce a la proliferación de algas.
Precauciones
Los compuestos orgánicos de fósforo forman una amplia clase de materiales, muchos son necesarios para la vida, pero algunos son extremadamente tóxicos. fluorurofosfatado ésteres se encuentran entre los más potentes neurotoxinas conocidas. Una amplia gama de compuestos organofosforados se utilizan para su toxicidad para ciertos organismos como pesticidas ( herbicidas, insecticidas, fungicidas, etc.) y de arma de como agentes nerviosos. La mayoría de los fosfatos inorgánicos son nutrientes relativamente no tóxicos y esenciales.
El alótropo fósforo blanco presenta un peligro significativo porque se inflama en el aire y produce residuo de ácido fosfórico. Intoxicación por fósforo blanco crónica lleva a la necrosis de la mandíbula llamado " fosfonecrosis ". La ingestión de fósforo blanco puede causar una condición médica conocida como "Síndrome de heces de fumadores".

Tras la exposición a fósforo elemental, en el pasado se sugirió que lavar la zona afectada con un 2% solución de sulfato de cobre para formar compuestos inofensivos que se pueden lavar lejos. De acuerdo con el reciente tratamiento de la Marina de Estados Unidos de siniestros agente químico y Lesiones convencional Militar químicos: FM8-285: Parte 2 Lesiones convencional Militar Químicas , "cúprico (cobre (II)) sulfato ha sido utilizado por personal estadounidense en el pasado y sigue siendo utilizado por algunas naciones. Sin embargo, el sulfato de cobre es tóxico y su uso será descontinuado. El sulfato de cobre puede producir toxicidad renal y cerebral, así como la hemólisis intravascular. "
El manual sugiere en cambio " una solución de bicarbonato para neutralizar el ácido fosfórico, que a su vez permitirá la eliminación de fósforo blanco visible. Las partículas a menudo puede ser localizado por su emisión de humo al aire incide sobre ellos, o por su fosforescencia en la oscuridad. En entornos oscuros, fragmentos son vistos como puntos luminiscentes. Inmediatamente desbridar la quemadura si la condición del paciente permitirá la eliminación de bits de WP (fósforo blanco) que podrían ser absorbida más tarde y posiblemente producir envenenamiento sistémico. NO aplique a base de grasas ungüentos hasta que esté seguro de que todo WP se ha eliminado. Tras la eliminación completa de las partículas, el tratamiento de las lesiones como quemaduras térmicas. " Como el fósforo blanco se mezcla fácilmente con los aceites, no se recomiendan las sustancias oleosas o ungüentos hasta que el área se limpia a fondo y todo el fósforo blanco removidos.
Estado en la Lista de Estados Unidos DEA I
El fósforo puede reducir elemental yodo a ácido yodhídrico, que es un reactivo eficaz para reducir la efedrina o seudoefedrina a la metanfetamina. Por esta razón, el fósforo rojo y blanco fueron designados por los Estados Unidos DEA como la lista I Precursores Químicos bajo 21 CFR 1310.02 efectiva el 17 de noviembre de 2001. Como resultado, en los Estados Unidos, los manipuladores de fósforo rojo o blanco están sujetos a estrictas controles reglamentarios.

