Tolueno
Acerca de este escuelas selección Wikipedia
Organizar una selección Wikipedia para las escuelas en el mundo en desarrollo sin acceso a Internet era una iniciativa de SOS Children. Para comparar obras de caridad de patrocinio este es el mejor vínculo de patrocinio .
| Tolueno | |
|---|---|
 |  |
Metilbenceno | |
Otros nombres tolueno | |
| Identificadores | |
| CAS | 108-88-3 |
| PubChem | 1140 |
| Propiedades físicas | 1108 |
| UNII | 3FPU23BG52 |
| DrugBank | DB01900 |
| KEGG | C01455 |
| ChEBI | CHEBI: 17578 |
| ChEMBL | CHEMBL9113 |
| Número RTECS | XS5250000 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | C 7 H 8 |
| Masa molar | 92,14 g mol -1 |
| Apariencia | Líquido incoloro |
| Densidad | 0,87 g / ml (20 ° C) |
| Punto de fusion | -95 ° C, 178 K, -139 ° F () |
| Punto de ebullicion | 111 ° C, 384 K, 232 ° F () |
| Solubilidad en agua | 0,47 g / L |
| Índice de refracción (n D) | 1,497 (20 ° C) |
| Viscosidad | 0,590 cP (20 ° C) |
| Estructura | |
| Momento bipolar | 0.36 D |
| Peligros | |
| MSDS | MSDS externa |
| Frases R | R11, R38, R48 / 20, R63, R65, R67 |
| Frases S | (S2), S36 / 37, S29, S46, S62 |
| Principal peligros | altamente inflamable |
| NFPA 704 |  3 2
0 |
| Punto de inflamabilidad | 6 ° C (43 ° F) |
| Valor Límite Umbral | 50 ml de m -3, 190 mg m -3 |
| Compuestos relacionados | |
| Conexo hidrocarburos aromáticos | benceno xileno naftalina |
| Compuestos relacionados | metilciclohexano |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Tolueno, antes conocido como tolueno, es un claro agua líquida -insoluble con el característico olor diluyentes de pintura. Es un mono-sustituido benceno derivado, es decir, uno en el que un solo átomo de hidrógeno de un grupo de seis átomos de la molécula de benceno ha sido sustituido por un grupo univalente, en este caso CH 3.
Es un hidrocarburo aromático que se usa ampliamente como un industrial materia prima y como un disolvente . Como otros disolventes, tolueno veces también se utiliza como una drogas inhalantes por sus propiedades embriagantes; Sin embargo, la inhalación de tolueno tiene potencial de causar daño neurológico severo. El tolueno es un disolvente orgánico importante, pero también es capaz de disolver un número de productos químicos inorgánicos notables tales como azufre, yodo, bromo, fósforo. y otras sustancias covalentes no polares.
Historia
El compuesto se aisló por primera vez en 1837 por un Químico polaco Filip Walter través de una destilación de pino de aceite que lo nombró retinaptha. Este nombre fue sustituido poco después por una palabra tolueno derivado del antiguo nombre tolueno, que se refiere a bálsamo de Tolú, un extracto aromático del árbol tropical de Colombia Balsamum Myroxylon, de la que también se aisló después. Originalmente fue nombrado por Jöns Jakob Berzelius.
Propiedades químicas
El tolueno reacciona como una normal de hidrocarburo aromático hacia sustitución electrofílica aromática. La grupo metilo da una alrededor de 25 veces más reactivo que el benceno en tales reacciones. Sufre suave sulfonación para dar ácido p-toluenosulfónico, y cloración por Cl 2 en presencia de FeCl 3 para dar orto y para isómeros de clorotolueno. Sufre nitración para dar orto y para isómeros nitrotolueno, pero en caso de calentamiento se pueden dar dinitrotolueno y en última instancia el explosivo trinitrotolueno (TNT).
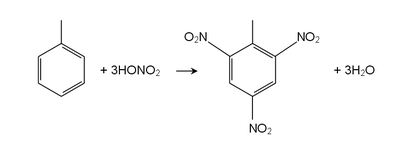
Con otro reactivos de metilo cadena lateral en tolueno puede reaccionar, sometidos a la oxidación. La reacción con permanganato de potasio y ácido diluido (por ejemplo, ácido sulfúrico ) o permanganato de potasio concentrado con ácido sulfúrico , conduce a ácido benzoico, la reacción mientras que con cloruro de cromilo conduce a benzaldehído ( Reacción Etard). La halogenación se puede realizar bajo condiciones de radicales libres. Por ejemplo, N bromosuccinimida (NBS) calentó con tolueno en presencia de AIBN conduce a bromuro de bencilo. El tolueno también se puede tratar con elemental de bromo en presencia de luz UV (luz solar directa) para producir bromuro de bencilo. El tolueno también se puede bromar por tratamiento con HBr y H 2 O 2 en presencia de la luz.
Catalizador de hidrogenación de tolueno para metilciclohexano requiere una alta presión del hidrógeno para ir a la terminación, debido a la estabilidad del sistema aromático. pKa es de aproximadamente 45.
Producción
El tolueno se produce naturalmente en niveles bajos en el petróleo crudo y por lo general se produce en los procesos de fabricación la gasolina a través de una reformador catalítico, en una de etileno galleta o hacer coque de carbón . La separación final, ya sea a través de la destilación o extracción del disolvente, se lleva a cabo en uno de los muchos procesos disponibles para la extracción de la Compuestos aromáticos BTX (benceno, tolueno y xileno isómeros).
Preparación
El tolueno se puede preparar industrialmente o en el laboratorio mediante una variedad de métodos.
- De benceno ( Friedel-Crafts)
El benceno reacciona con cloruro de metilo en presencia de cloruro de aluminio anhidro para formar tolueno. La formación sigue un mecanismo de reacción de sustitución electrofílica:
- CH 3 Cl + AlCl3 → CH 3 + + AlCl 4 -
- C 6 H 5 H + CH 3 + + AlCl 4 - → C 6 H 5 CH 3 + HCl + AlCl3
Los siguientes catalizadores se pueden utilizar en lugar de AlCl 3:
- AlCl3> SBCL 3> SnCl4> BF3> ZnCl2> HgCl2
Tenga en cuenta que la reacción no es muy útil como el derivado de alquil-mono forman fácilmente sufre más de alquilación a una velocidad aún mayor-para producir productos polisustituidos.
- Desde bromobenceno ( Wurtz-Fittig reacción)
La reacción de Wurtz-Fittig es la reacción de un haluro de arilo y haluro de alquilo en presencia de sodio metálico para dar los compuestos aromáticos sustituidos.
Cuando bromobenceno y bromuro de metilo reaccionan con el metal de sodio en solución de éter seco, se obtiene tolueno.
- C 6 H 5 Br + CH 3 Br + 2Na → C 6 H 5 CH 3 + 2NaBr
- De toluico ( descarboxilación)
Cuando la sal de sodio del ácido toluico ( o-, m-, p) se calienta con cal sódica, se obtiene tolueno.
- C 6 H 4 CH3COONa (toluato sodio) + NaOH → C 6 H 5 CH 3 (tolueno) + Na 2 CO 3
- Desde cresol
Cuando cresol (o-, m-, p-) se destila con polvo de zinc, se obtiene tolueno.
- C 6 H 4 CH 3 OH (cresol) + Zn → C 6 H 5 CH 3 (tolueno) + ZnO
- Desde ácido toluenosulfónico
Cuando el ácido toluenosulfónico se trata con vapor de agua sobrecalentado o hervida con HCl, se obtiene tolueno.
- CH 3 C 6 H 4 SO 3 H (ácido toluenosulfónico) + HOH (vapor) → C 6 H 5 CH 3 (tolueno) + H 2 SO 4 ( ácido sulfúrico )
- Desde toluidina
Toluidina se diazota primero con nitrito sódico (NaNO2) y HCl a baja temperatura. La compuesto de diazonio así obtenida se calienta con alcalina cloruro de estaño (SnCl 2). Esta reacción da tolueno.
- Desde Reactivo de Grignard
Cuando bromuro de fenil magnesio (C 6 H 5) MgBr se hace reaccionar con bromuro de metilo, se obtiene tolueno.
Usos
El tolueno es un común disolvente , capaz de disolver pinturas, diluyentes de pintura, selladores de silicona, muchos reactivos químicos , caucho , tinta de impresión, adhesivos (pegamentos), lacas, curtidores de cuero, y desinfectantes. También se puede utilizar como una indicador de fullereno, y es una materia prima para diisocianato de tolueno (utilizado en la fabricación de espuma de poliuretano) y TNT. Además, se utiliza como disolvente para crear una solución de nanotubos de carbono. También se utiliza como un cemento para bien de poliestireno kits (disolviéndolo y luego la fusión de las superficies), ya que se puede aplicar de forma muy precisa por el cepillo y no contiene ninguna de la mayor parte de un adhesivo.
Los usos industriales de tolueno incluyen desalquilación al benceno, y la desproporción a una mezcla de benceno y xileno. Cuando se oxida cede benzaldehído y ácido benzoico, dos intermedios importantes en la química. También se utiliza como fuente de carbono para la fabricación de paredes múltiples Los nanotubos de carbono. El tolueno se puede utilizar para romper las células rojas de la sangre con el fin de extraer hemoglobina en experimentos de bioquímica.
El tolueno se puede utilizar como una refuerzo de octano en combustibles de gasolina utilizados en motores de combustión interna. Tolueno a 86% en volumen alimentado todos los Fórmula 1 de turbo equipos en la década de 1980, primero por primera vez por el equipo Honda. El 14% restante era un "relleno" de n-heptano, para reducir el índice de octano para satisfacer Fórmula 1 restricciones de combustible. Tolueno a 100% puede ser utilizado como combustible para los motores de dos tiempos y de cuatro tiempos; Sin embargo, debido a la densidad del combustible y otros factores, el combustible no se vaporiza fácilmente a menos precalentado a 70 grados Celsius (Honda logra esto en su coches de Fórmula 1 mediante el enrutamiento de las líneas de combustible a través del sistema silenciador para calentar el combustible). El tolueno también plantea problemas similares a los de los combustibles de alcohol, ya que se come a través de líneas estándar de goma de combustible y no tiene propiedades lubricantes, como gasolina estándar hace, que puede romper las bombas de combustible y causar cilindro superior desgaste del agujero.
En Australia, el tolueno se ha encontrado que se han combinado de manera ilegal con gasolina en puntos de venta de combustible a la venta como combustible vehicular estándar. Tolueno atrae sin especial de combustible, mientras que otros combustibles son gravados a más del 40%, por lo que los proveedores de combustible son capaces de beneficiarse de la sustitución del tolueno más barato de la gasolina. Esta sustitución es probable que afecte el rendimiento del motor y causar desgaste adicional. El grado de sustitución de tolueno no se ha determinado.
El tolueno es otra en un grupo de combustibles que recientemente se han utilizado como componentes para mezclas sustitutas de combustible para aviones. El tolueno se utiliza como una sustituto turbosina por su contenido de compuestos aromáticos.
El tolueno también se ha utilizado como un refrigerante por sus buenas capacidades de transferencia de calor en trampas de sodio frío utilizados en bucles sistema de reactor nuclear.
El tolueno también se había utilizado en el proceso de la eliminación de la cocaína de la hoja de coca en la producción de jarabe de Coca-Cola.
Biología
Similar a muchos otros disolventes tales como 1,1,1-tricloroetano y algunos alquilo bencenos , tolueno se ha demostrado que actúa como una no competitivo Antagonista del receptor de NMDA y Receptor GABA A modulador alostérico positivo. Se abusó como inhalante probable a causa de la eufórico y efectos disociativos estas acciones producen. Adicionalmente, el tolueno se ha demostrado para mostrar efectos de tipo antidepresivo en roedores en la prueba de natación forzada (FST) y el prueba de suspensión de cola (TST).
Toxicología y metabolismo
El tolueno no debe ser inhalado, debido a sus efectos sobre la salud. Niveles bajos o moderados pueden producir cansancio, confusión, debilidad, sensación de embriaguez, pérdida de memoria, náusea, pérdida de apetito, y el oído y pérdida de la visión del color. Estos síntomas generalmente desaparecen cuando la exposición cesa. La inhalación de altos niveles de tolueno en un corto período de tiempo puede causar mareo, náuseas o somnolencia. También puede causar pérdida del conocimiento e incluso la muerte.
El tolueno es, sin embargo, mucho menos tóxico que el benceno , y tiene, como consecuencia, sustituido en gran medida como un disolvente aromático en la preparación química. Por ejemplo, el benceno es un carcinógeno conocido, mientras que el tolueno tiene muy poco potencial carcinogénico.