
John Dalton
Renseignements généraux
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. Pour comparer les organismes de bienfaisance de parrainage ce est le meilleur lien de parrainage .
| John Dalton | |
|---|---|
 | |
| Né | Septembre 6, 1766 Eaglesfield, près de Cockermouth, Cumbria, Angleterre |
| Mort | 27 juillet 1844 (77 ans) Manchester , Angleterre |
| Conseiller de doctorat | John Gough |
| Doctorants | James Prescott Joule |
| Connu pour | Théorie atomique, Loi des proportions multiples, La loi de Dalton des pressions partielles, daltonisme |
John Dalton (FRS 6 septembre 1766 - 27 juillet 1844 ) était un Anglais chimiste, météorologue et physicien, né dans une famille Quaker à Eaglesfield, près de Cockermouth dans Cumbria. Il est surtout connu pour son travail de pionnier dans le développement de moderne théorie atomique, et ses recherches sur le daltonisme (parfois dénommé daltonisme, en son honneur).
Jeunesse
Le fils d'un tisserand, à l'âge de quinze John Dalton a rejoint son frère aîné Jonathan dans la gestion d'une école Quaker dans les environs de Kendal. Autour de 1790 Dalton semble avoir envisagé de prendre jusqu'à la loi ou la médecine , mais ses projets ne ont pas été rencontré avec les encouragements de ses parents - Dissidents ont été empêchés d'assister ou de l'enseignement dans les universités anglaises - et il est resté au Kendal jusqu'à ce que, au printemps de 1793, il se installe à Manchester . Principalement grâce à John Gough, un philosophe aveugle et grand penseur du informelle dont l'instruction qu'il devait une grande partie de ses connaissances scientifiques, Dalton a été nommé professeur de mathématiques et philosophie naturelle à la "New College" à Manchester, une académie dissidente. Il est resté à ce poste jusqu'en 1800, quand aggravation de la situation financière de l'Ordre l'a amené à démissionner de son poste et de commencer une nouvelle carrière à Manchester comme un tuteur privé pour les mathématiques et la philosophie naturelle.
Début de la vie de Dalton a été fortement influencée par un éminent Eaglesfield Quaker nommée Elihu Robinson, un météorologue et luthier compétent, qui l'a intéressé dans les problèmes de mathématiques et de la météorologie. Pendant ses années à Kendal, Dalton contribué solutions de problèmes et de questions sur divers sujets pour les hommes et pour dames Diaries, et en 1787 il a commencé à garder un météorologiques journal dans lequel, pendant les 57 années suivantes, il est entré plus de 200 000 observations. La première publication de Dalton était observations météorologiques et Essais (1793), qui contient les graines de plusieurs de ses découvertes ultérieures. Cependant, en dépit de l'originalité de son traitement, peu d'attention a été accordée à leur par d'autres chercheurs. Un deuxième travail en Dalton, éléments de grammaire anglaise, a été publié en 1801.
En 1794, peu après son arrivée à Manchester, Dalton a été élu membre de la Manchester Société littéraire et philosophique, le "Lit & Phil", et quelques semaines plus tard, il a communiqué son premier article sur "faits extraordinaires relatives à la vision des couleurs ", dans lequel il a postulé que la pénurie dans la perception de la couleur a été causé par une décoloration de la milieu liquide du globe oculaire. En fait, une pénurie de perception des couleurs chez certaines personnes ne avait même pas été formellement décrite ou officiellement remarqué jusqu'à Dalton a écrit sur son propre. Bien que la théorie de Dalton perdu foi dans sa propre vie, la nature approfondie et méthodique de ses recherches dans son propre problème visuel a été si largement reconnu que le daltonisme est devenu un terme commun pour le daltonisme . Examen de son globe oculaire préservé en 1995 avait démontré que Dalton en fait une sorte moins fréquente de daltonisme, deuteroanopia , dans lequel la longueur d'onde moyenne cônes sensibles sont manquantes (plutôt que de fonctionner avec une forme mutée de leur pigment, comme dans le type le plus commun de la couleur la cécité, deuteroanomaly ). Outre le bleu et pourpre du spectre, il était capable de reconnaître une seule couleur, jaune, ou, comme il le dit dans son article, «la partie de l'image que d'autres appellent rouge me semble un peu plus d'une nuance ou de défaut de la lumière . Après que le orange, jaune et vert semble une couleur qui descend assez uniforme d'une intense au jaune rare, faisant ce que je devrais appeler différentes nuances de jaune ».
Ce document a été suivi par de nombreux autres sur divers sujets sur la pluie et rosée et l'origine de ressorts, sur la chaleur , la couleur de la ciel, vapeur, le verbes auxiliaires et participes de la langue anglaise et de la la réflexion et réfraction de la lumière.
La théorie atomique
En 1800, il est devenu secrétaire de la Manchester Société littéraire et philosophique, et l'année suivante, il présentés oralement une importante série de documents, intitulé "expérimentales" Essais sur la constitution du mixtes gaz ; sur pression de la vapeur et d'autres vapeurs à différentes températures , à la fois dans un vide et dans l'air ; sur évaporation; et le la dilatation thermique des gaz. Ces quatre essais ont été publiés dans les Mémoires de l'Lit & Phil en 1802.
Le second de ces essais se ouvre avec la remarque frappante,
- "Il ne peut guère y avoir de doute divertir en respectant la réductibilité de tous les fluides élastiques de toute nature, dans des liquides, et nous ne devons pas désespérer de l'affecter dans basses températures et par de fortes pressions exercées sur les gaz non mélangés plus loin ".
Après avoir décrit des expériences pour déterminer la pression de vapeur en différents points entre 0 ° et 100 ° C (32 ° et 212 ° F), il a conclu à partir d'observations sur le pression de vapeur de six liquides différents, que la variation de la pression de vapeur pour tous les liquides est équivalent, pour une même variation de température, en comptant à partir de la vapeur de toute pression donnée.
Au quatrième essai, il remarque,
- «Je ne vois aucune raison suffisante pourquoi nous ne pouvons pas conclure que tous les fluides élastiques sous la même pression étendre à parts égales par la chaleur et que pour toute expansion donnée de mercure , l'expansion correspondante de l'air est quelque chose de moins proportionnellement, plus la température. Il semble, par conséquent, que les lois générales relatives à la quantité absolue et de la nature de la chaleur sont plus susceptibles d'être dérivé de fluides compressibles que d'autres substances ".
Il a ainsi énoncé La loi de Gay-Lussac ou JAC Loi de Charles, publié en 1802 par Louis Joseph Gay-Lussac. Dans les deux ou trois ans après la lecture de ces essais, Dalton a publié plusieurs articles sur des sujets similaires, que sur l'absorption du gaz par l'eau et d'autres liquides (1803), contenant sa loi des pressions partielles maintenant connu comme La loi de Dalton.
Le plus important des enquêtes de tous les Dalton sont ceux concernés par la théorie atomique en chimie, avec laquelle son nom est indissociable. Il a été proposé que cette théorie a été proposé de lui, soit par des recherches sur l'éthylène (gaz oléfiant) et méthane (en hydrogène carboné) ou par analyse de l'oxyde nitreux (protoxyde d'azote de) et le dioxyde d'azote (deutoxide d'azote), les deux points de vue reposant sur l'autorité de Thomas Thomson. Cependant, une étude de ses propres cahiers de laboratoire de Dalton, découvert dans les chambres de l'Lit & Phil, a conclu que, loin de Dalton dirigé par sa recherche d'une explication de la loi des proportions multiples à l'idée que la combinaison chimique consiste dans l'interaction des atomes de poids défini et caractéristique, l'idée d'atomes surgi dans son esprit comme un concept purement physique, forcé sur lui par l'étude des propriétés physiques de l' atmosphère et d'autres gaz . Les indications publiées pour la première de cette idée doivent être trouvées à la fin de son article sur l'absorption des gaz déjà mentionné, qui a été lu sur 21 octobre 1803 , mais ne sera publié qu'en 1805. Ici, il dit:
- «Pourquoi ne pas l'eau admettre son volume de chaque type de gaz semblables? Cette question que je ai dûment pris en considération, et bien que je ne suis pas capable de me satisfaire complètement Je presque persuadé que la circonstance dépend du poids et le nombre de particules ultimes de les plusieurs gaz ".
Il procède à imprimer son premier tableau publié de rapport poids atomiques. Six éléments apparaissent dans ce tableau, à savoir l'hydrogène, l'oxygène, l'azote, le carbone, le soufre et le phosphore, avec l'atome d'hydrogène classiquement supposé peser 1. Dalton fourni aucune indication dans ce premier document comment il était arrivé à ces chiffres. Cependant, dans son cahier de laboratoire dans le cadre du 6 Date Septembre 1803 apparaît une liste dans laquelle il expose les poids relatifs des atomes d'un certain nombre d'éléments, dérivée de l'analyse de l'eau , de l'ammoniac , dioxyde de carbone , etc. par les chimistes de la temps.
Il semble donc que confronté au problème du calcul du diamètre relatif des atomes dont, il était convaincu, tous les gaz ont été faites, il a utilisé les résultats de l'analyse chimique . Assisté par l'hypothèse que la combinaison a toujours lieu dans la manière la plus simple possible, il est arrivé ainsi à l'idée que la combinaison chimique a lieu entre les particules de poids différents, et ce est ce qui différencie sa théorie des spéculations historiques des Grecs .
L'extension de cette idée de substances en général nécessairement l'a conduit à la loi des proportions multiples, et la comparaison avec l'expérience a confirmé brillamment sa déduction. On peut noter que, dans un document sur la proportion des gaz ou fluides compressibles constituant l'atmosphère, lu par lui en Novembre 1802, la loi des proportions multiples semble être prévu dans les mots: "Les éléments de l'oxygène peuvent se combiner avec un certaine partie du gaz nitreux ou deux fois la partie, mais sans quantité intermédiaire ", mais il ya des raisons de soupçonner que cette phrase peut avoir été ajouté un certain temps après la lecture du document, qui n'a pas été publié jusqu'à 1805.
Les composés ont été répertoriés comme binaire, ternaire, quaternaire, etc. (molécules composées de deux, trois, quatre, etc.) atomes dans le nouveau système de philosophie chimique en fonction du nombre d'atomes d'un composé avait en sa plus simple, forme empirique.
Il a émis l'hypothèse la structure des composés peut être représentée dans des rapports de nombres entiers. Ainsi, un atome de l'élément X se combiner avec un atome de l'élément Y est un composé binaire. En outre, un atome de l'élément X se combinant avec deux éléments de Y ou inversement, est un composé ternaire. Beaucoup des premiers composés énumérés dans le nouveau système de philosophie chimique correspondent aux vues modernes, bien que beaucoup d'autres ne le font pas.
Dalton a utilisé ses propres symboles pour représenter visuellement la structure atomique des composés. Celles-ci ont fait dans un nouveau système de philosophie chimique où Dalton énuméré un certain nombre d'éléments et de composés communs.
Cinq points principaux de la théorie atomique de Dalton
- Les éléments sont constitués de minuscules particules appelées atomes.
- Tous les atomes d'un élément donné sont identiques.
- Les atomes d'un élément donné sont différents de ceux de tout autre élément; les atomes de différents éléments peuvent être distingués les uns des autres par leurs poids relatifs respectifs.
- Atomes d'un élément peuvent se combiner avec des atomes d'autres éléments pour former des composés; un composé donné a toujours le même nombre relatif de types d'atomes.
- Les atomes peuvent pas être créés, divisé en plus petites particules, ni détruits dans le procédé chimique; une réaction chimique modifie simplement la façon atomes sont regroupés.
Dalton a proposé une «règle de la plus grande simplicité» supplémentaire qui a créé la controverse, car il ne pouvait pas être confirmée de source indépendante.
- Lorsque les atomes se combinent dans un seul rapport, «.it doit être présumé être binaire, à moins que quelque cause semble au contraire"
Ce était simplement une hypothèse, dérivée de la foi dans la simplicité de la nature. Aucune preuve ne était alors disponible pour les scientifiques de déduire le nombre des atomes de chaque élément se combinent pour former des molécules composées. Mais ceci ou quelque autre telle règle était absolument nécessaire à une théorie naissante puisqu'il faut une formule moléculaire supposée pour calculer le poids atomiques relatives. Dans tous les cas, "la règle de la plus grande simplicité» de Dalton fit supposer que la formule de l'eau et de l'ammoniac était OH était NH, très différent de notre compréhension moderne.
Malgré l'incertitude au cœur de la théorie atomique de Dalton, les principes de la théorie survécu. Pour être sûr, la conviction que les atomes ne peuvent pas être divisées, créés ou détruits en particules plus petites quand ils sont combinés, séparés ou réarrangées dans des réactions chimiques est incompatible avec l'existence de la fusion nucléaire et la fission, mais ces processus sont des réactions nucléaires et non réactions chimiques. En outre, l'idée que tous les atomes d'un élément donné sont identiques dans leurs propriétés physiques et chimiques ne est pas précisément vrai, comme nous savons maintenant que les différents isotopes d'un élément ont peu de poids variable. Toutefois, Dalton avait créé une théorie de l'immense pouvoir et de l'importance. En effet, l'innovation de Dalton était tout aussi importante pour l'avenir de la science comme Antoine Laurent Lavoisier la chimie à base d'oxygène l 'avait été.
Ans plus tard
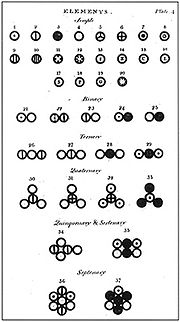
Dalton communiqué sa théorie atomique pour Thomson qui, par consentement, inclus un aperçu de celui-ci dans la troisième édition de son système de chimie (1807), et Dalton a donné un autre compte dans la première partie du premier volume de son nouveau système de philosophie chimique (1808). La deuxième partie de ce volume est apparu en 1810, mais la première partie du second volume n'a pas été émis à 1827. Ce retard ne se explique pas par un excès de soins dans la préparation, pour une grande partie de la question était hors de date et l'annexe donnant dernière vue de l'auteur est la seule partie d'un intérêt particulier. La deuxième partie du vol. je je. jamais paru.
Dalton a été président de la Lit & Phil de 1817 jusqu'à sa mort, en contribuant 116 mémoires. Parmi ceux-ci le plus tôt sont les plus importants. Dans l'un d'eux, lu en 1814, il explique les principes de analyse volumétrique, dans lequel il a été l'un des premiers travailleurs. En 1840, un document sur la phosphates et arséniates , souvent considéré comme un travail plus faible, a été refusé par le Royal Society, et il était si furieux qu'il a publié lui-même. Il a pris le même cours peu après avec quatre autres documents, dont deux (Sur la quantité de acides , des bases et sels dans différentes variétés de sels et sur une nouvelle et facile méthode d'analyse du sucre ) contiennent sa découverte, considérée par lui comme le deuxième en importance seulement à la théorie atomique, que certains anhydrates, lorsqu'il est dissous dans l'eau, entraîner aucune augmentation de son volume, sa conclusion étant que le sel entre dans la pores de l'eau.
Méthode expérimentale de Dalton
Comme un enquêteur, Dalton était contente souvent rude et instruments inexactes, si de meilleurs étaient obtenus. Sir Humphry Davy l'a décrit comme «un expérimentateur très grossier", qui a presque toujours trouvé les résultats dont il avait besoin, se fiant à sa tête plutôt que ses mains. D'autre part, les historiens qui ont répliqués certains de ses expériences cruciales ont confirmé la compétence et la précision de Dalton.
Dans la préface de la deuxième partie du vol. i. de son nouveau système, il dit qu'il avait si souvent été induit en erreur en prenant pour acquis les résultats des autres qu'il déterminé à écrire "aussi peu que possible, mais ce que je peux en témoigner par ma propre expérience», mais cette indépendance qu'il portait si loin qu'il parfois ressemblé manque de réceptivité. Ainsi il se méfiait, et probablement jamais complètement accepté, Gay Lussac-Les conclusions de que les volumes de gaz combinant. Il avait des opinions non conventionnelles sur le chlore . Même après son caractère élémentaire avait été réglée par Davy, il a persisté dans l'utilisation des poids atomiques avait lui-même adoptées, même quand ils avaient été remplacés par les déterminations plus précises des autres chimistes. Il a toujours opposé à la notation chimique conçu par Jöns Jakob Berzelius, bien que la plupart pensait que ce était beaucoup plus simple et plus pratique que son propre système lourd de symboles circulaires.
La vie publique

Avant qu'il avait défendue la théorie atomique, il avait déjà atteint une réputation scientifique considérable. En 1804, il a été choisi pour donner une série de conférences sur la philosophie naturelle à la Royal Institution de Londres , où il a prononcé un autre cours de 1809-1810. Toutefois, certains témoins ont rapporté qu'il était déficient dans les qualités qui font un conférencier attrayant, être dur et indistinct dans la voix, inefficace dans le traitement de son sujet, et de vouloir singulièrement dans la langue et la puissance d'illustration.
En 1810, Davy lui a demandé de se offrir comme un candidat pour la bourse de la Société royale, mais Dalton diminué, peut-être pour des raisons financières. Cependant, en 1822, il a été proposé à son insu, et sur l'élection payé le tarif habituel. Six ans auparavant, il avait été fait membre correspondant de l' Françaises Académie des sciences, et en 1830 il a été élu comme l'un de ses huit associés étrangers à la place de Davy.
En 1833, Le gouvernement de lord Grey lui a conféré une pension de £ 150, soulevé en 1836 à £ 300.
Dalton jamais marié et a eu seulement quelques amis proches. Il a vécu pendant plus d'un quart de siècle avec son ami le révérend W. Johns (1771-1845), dans George Street, Manchester, où sa ronde quotidienne de travail de laboratoire et les frais de scolarité ne était interrompu que par des excursions annuelles au Lake District et des visites occasionnelles à Londres. En 1822, il a effectué une courte visite à Paris , où il a rencontré de nombreux scientifiques éminents résidents. Il a assisté à plusieurs réunions antérieures du Association britannique à York , Oxford , Dublin et Bristol .
Mort et legs

Dalton a subi un AVC mineur en 1837, et un second en 1838 l'a laissé avec un trouble de la parole, mais il est resté en mesure de faire des expériences. En mai 1844, il avait encore un autre accident vasculaire cérébral; le 26 Juillet, il a enregistré une main tremblante sa dernière observation météorologique. Le 27 Juillet, à Manchester, Dalton est tombé de son lit et a été retrouvé sans vie par son accompagnateur. Dalton a été enterré à Manchester en Ardwick cimetière. Le cimetière est maintenant un terrain de jeu, mais des photos de la tombe d'origine sont dans le livre de Patterson et l'article de Elliott.
Un buste de Dalton, par Chantrey, a été publiquement souscrit et placé dans le hall d'entrée de la Institution royale de Manchester. Chantrey également conçu une grande statue de Dalton, maintenant dans la Manchester mairie.
En l'honneur du travail de Dalton, de nombreux chimistes et biochimistes utilisent (pour l'instant non officielle) unité dalton (Da abrégé) pour désigner une unité de masse atomique ou 1/12 du poids d'un atome neutre du carbone-12.
L'Université de Manchester a créé deux bourses Dalton Chemical, deux Dalton mathématiques Bourses et un prix Dalton d'histoire naturelle.
Dans son livre Le 100, Michael H. Hart classe Dalton comme la 32e personne la plus influente dans l'histoire.
Un cratère lunaire a été nommé d'après Dalton.

