
Arsenic
Contexte des écoles Wikipédia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| Arsenic | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
33 Comme | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||
gris métallique  | |||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | arsenic, As, 33 | ||||||||||||||||||||||||||||||||||||
| Prononciation | / ɑr s ɨ n ɪ k / AR -sə-nik, aussi / ɑr s ɛ n ɪ k / ar- SEN -ik quand attributive | ||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | métalloïde | ||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 15 (pnictogens), 4, p | ||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 74,92160 (2) | ||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 4s 2 4p 3d 10 3 2, 8, 18, 5 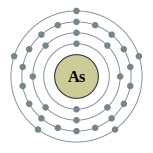 | ||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||
| Découverte | Early âge du bronze ( 2500 BC) | ||||||||||||||||||||||||||||||||||||
| Premier isolement | Albertus Magnus (1250) | ||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 5,727 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 5,22 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Point de sublimation | 887 K, 615 ° C, 1137 ° F | ||||||||||||||||||||||||||||||||||||
| Point triple | 1090 K (817 ° C), 3 628 kPa | ||||||||||||||||||||||||||||||||||||
| Point critique | 1673 K,? MPa | ||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | (Gris) 24,44 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | ? 34,76 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,64 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||
| États d'oxydation | 5, 3, 2, 1, -3 (Légèrement acide oxyde) | ||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,18 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1e: 947,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| 2ème: 1798 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| 3ème: 2735 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Rayon atomique | 119 h | ||||||||||||||||||||||||||||||||||||
| Rayon covalente | 119 ± 16 heures | ||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 185 h | ||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||
| Crystal structure | simples trigonal  | ||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 333 nΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 50,2 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Le module d'Young | 8 GPa | ||||||||||||||||||||||||||||||||||||
| Module Bulk | 22 GPa | ||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 3,5 | ||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 1440 MPa | ||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-38-2 | ||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de l'arsenic | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
L'arsenic est un élément chimique avec le symbole As et de numéro atomique 33. L'arsenic se produit dans de nombreux minéraux, le plus souvent en association avec du soufre et des métaux, et aussi comme un cristal élémentaire pur. Il a été documenté par Albertus Magnus en 1250. L'arsenic est un métalloïde. Il peut exister dans divers allotropes , bien que la forme grise a utilisation importante dans l'industrie.
La principale utilisation de l'arsenic métallique est de renforcer alliages de cuivre et en particulier du plomb (par exemple, dans les batteries de voiture). L'arsenic est un type n commune dopant dans semiconducteurs appareils, et composé optoélectronique arséniure de gallium est le semi-conducteur la plus couramment utilisée après silicium dopé. L'arsenic et ses composés, en particulier le trioxyde, sont utilisés dans la production de les pesticides, les produits de bois traité, herbicides, et insecticides. Ces applications sont en baisse, cependant.
L'arsenic est notoirement toxique pour la vie multicellulaire, bien que quelques espèces de bactéries sont capables d'utiliser des composés de l'arsenic sous forme de métabolites respiratoires. Contamination par l'arsenic des eaux souterraines est un problème qui affecte des millions de personnes à travers le monde.
Caractéristiques
Caractéristiques physiques

Les trois plus courantes arsenic allotropes sont l'arsenic gris, jaune et noir métallisé, gris étant la. Gris arsenic la plus courante (α-As, groupe d'espace R 3 m n ° 166) adopte une structure à double couche composée de nombreux volants cycles à six chaînons entrelacés. En raison de la faible liaison entre les couches, l'arsenic gris est fragile et a une relativement faible dureté Mohs de 3,5. Le plus proche et les prochaines plus proches voisins forment un complexe octaédrique déformée, avec les trois atomes dans le même double-couche étant un peu plus près que les trois atomes dans le prochain. Ce garnissage relativement proche conduit à une forte densité de 5,73 g / cm 3. Gray est un arsenic métalloïde, mais devient un semi-conducteur avec un bande interdite de 1.2 à 1.4 eV si amorphisée. arsenic jaune est doux et cireux, et quelque peu similaire à tétraphosphore (P 4). Les deux ont quatre atomes disposés dans un tétraédrique structure dans laquelle chaque atome est lié à chacune des trois autres atomes par une liaison simple. Ce allotrope instable, étant moléculaire, est le plus volatil, moins dense et la plus toxique. Arsenic solide jaune est produit par refroidissement rapide des vapeurs d'arsenic, As 4. Il est rapidement transformé en arsenic gris par la lumière. Le formulaire jaune a une densité de 1,97 g / cm 3. Arsenic noir est une structure semblable à phosphore rouge.
Isotopes
Naturellement arsenic d'origine est composé d'un stable isotope , 75 sous. En 2003, au moins 33 des radio-isotopes ont également été synthétisés, allant dans masse atomique de 60 à 92. Le plus stable de ceux-ci est 73 Comme avec une demi-vie de 80,3 jours. Isotopes plus légers que les 75 stables Comme tendent à disparaître par β + décroissance, et ceux qui sont plus lourds ont tendance à pourrir par β - décroissance, à quelques exceptions près.
Au moins 10 isomères nucléaires ont été décrits, allant de la masse atomique de 66 à 84. Le plus stable des isomères de l'arsenic est 68m Comme avec une demi-vie de 111 secondes.
Chimie
Lorsqu'il est chauffé dans l'air, de l'arsenic oxyde de le trioxyde d'arsenic; les fumées de cette réaction ont une odeur ressemblant à l'ail . Cette odeur peut être détectée sur les minéraux d'arséniure frappants tels que arsénopyrite avec un marteau. Arsenic (et certains composés de l'arsenic) sublime lors du chauffage à la pression atmosphérique, la conversion directement à une forme gazeuse sans état liquide intervenant à 887 K (614 ° C). Le point triple est 3,63 MPa et 1090 K (820 ° C). Marques arsenic l'acide de l'arsenic et concentré acide nitrique , acide arsénieux avec de l'acide nitrique dilué, et trioxyde d'arsenic avec concentré d'acide sulfurique .

Composés
Composés d'arsenic ressemblent à certains égards de ceux phosphore , qui occupe le même groupe (colonne) du tableau périodique . L'arsenic est moins fréquemment observée dans l'état pentavalent, cependant. Les plus courantes états d'oxydation pour l'arsenic sont: -3 dans le arséniures, tels que les composés intermétalliques alliage ressemblant; 3 et dans la arséniates, arsénites (III) et des composés organo plus. Arsenic lie également facilement lui-même comme vu sur la place Comme 3-
Quatre ions dans le minéral skutterudite. Dans l'état d'oxydation +3, de l'arsenic est généralement pyramidale, en raison de l'influence de la seule paire de électrons .
Inorganique
Formes d'arsenic incolore, inodore, oxydes cristallins As 2 O 3 (" arsenic blanc ") et As 2 O 5, qui sont hygroscopique et facilement soluble dans l'eau pour former des solutions acides. L'arsenic (V) l'acide est un acide faible. Ses sels sont appelés arséniates, qui est la base de contamination par l'arsenic des eaux souterraines, un problème qui touche de nombreuses personnes. Arséniates synthétiques comprennent Paris Green (cuivre (II) acétoarsénite), l'arséniate de calcium, et arséniate de plomb d'hydrogène. Les trois derniers ont été utilisés comme agricole les insecticides et les poisons .
Les étapes de protonation entre l'arséniate et l'acide arsénique sont semblables à celles entre phosphate et l'acide phosphorique . Contrairement à l'acide de phosphore, l'acide arsénieux est véritablement tribasique, avec la formule As (OH) 3.
Une large variété de composés de soufre de l'arsenic sont connus. Orpiment ( As 2 S 3) et le réalgar ( Comme 4 S 4) sont peu abondantes et étaient autrefois utilisés comme pigments de peinture. En tant que 4 S 10, l'arsenic a un état d'oxydation formel de +2 à As 4 S 4, qui dispose d'AS-AS obligations ainsi que le total de covalence comme ce est encore trois.
Le trifluorure, le trichlorure, le tribromure et triiodure d'arsenic (III) sont bien connus, alors que seulement Pentafluorure Arsenic (ASF 5) est la seule pentahalogénure importante. Reflète encore une fois la stabilité inférieure de l'état d'oxydation 5+, le pentachlorure est stable seulement inférieure à -50 ° C.
Composés organo
Une grande variété de composés organo sont connus. Plusieurs ont été développés comme agents chimiques de guerre pendant la Première Guerre mondiale, y compris vésicants tels que lewisite et vomissements agents tels que adamsite. Cacodylique l'acide, ce qui est d'intérêt historique et pratique, découle de la méthylation de trioxyde d'arsenic, une réaction qui ne est pas en analogie chimie du phosphore.
Alliages
L'arsenic est utilisé comme élément du groupe 5 dans le Semi-conducteurs III-V l'arséniure de gallium, l'arséniure d'indium, et l'arséniure d'aluminium. Le nombre d'électrons de valence de GaAs est identique à une paire d'atomes de Si, mais le structure de bande est complètement différente, ce qui entraîne des propriétés en vrac distinctes. D'autres alliages d'arsenic comprennent le semi-conducteur II-IV l'arséniure de cadmium.
Présence et la production

Minerals avec la masse de la formule et Mas 2 (M = Fe, Ni, Co) sont les sources commerciales dominantes d'arsenic, avec realgar (un minéral de sulfure d'arsenic) et l'arsenic natif. Un minéral est illustrative arsénopyrite ( Fe Comme S ), qui est structurellement liée à la pyrite de fer . De nombreux minéraux mineur comme contenant sont connus. Arsenic se produit également dans diverses formes organiques dans l'environnement. L'arsenic inorganique et ses composés, à l'entrée du chaîne alimentaire, sont progressivement métabolisé en une forme moins toxique d'arsenic par un processus de méthylation.
Autres voies naturelles de l'exposition comprennent les cendres volcaniques, l'altération des minéraux et minerais contenant de l'arsenic, et dissous dans les eaux souterraines. On le trouve également dans les aliments, l'eau, le sol et l'air. L'arsenic est absorbée par les plantes, mais est plus concentré dans les légumes à feuilles vertes, le riz, la pomme et le jus de raisin et de fruits de mer. Une voie supplémentaire de l'exposition est par inhalation.
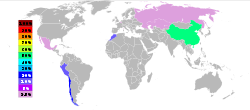
En 2005, la Chine était le premier producteur de l'arsenic blanc avec près de 50% de part de monde, suivie par le Chili, le Pérou, et le Maroc, selon le British Geological Survey et le United States Geological Survey. La plupart des opérations aux États-Unis et l'Europe ont fermé pour des raisons environnementales. L'arsenic est récupérée principalement en tant que produit secondaire à partir de la purification de cuivre. L'arsenic est une partie de la poussière de la fonderie de fonderies de cuivre, d'or et de plomb.
Sur torréfaction dans l'air d'arsénopyrite, sublime d'arsenic que l'arsenic (III) oxyde laissant oxydes de fer, tandis que la torréfaction sans résultat d'air dans la production de l'arsenic métallique. Une purification supplémentaire de soufre et d'autres chalcogènes est réalisée par sublimation sous vide ou dans une atmosphère d'hydrogène ou par distillation du mélange de plomb et d'arsenic en fusion.
Histoire


Le mot de l'arsenic a été emprunté à la Mot syriaque ܠܐ ܙܐܦܢܝܐ (al) et de la zarniqa Mot persan زرنيخ Zarnikh, ce qui signifie «jaune orpiment ", en grec comme arsenikon (Αρσενικόν). Elle est également liée aux arsenikos mot grec similaires (Αρσενικός), ce qui signifie «masculin» ou «puissant». Le mot a été adopté en arsenicum latine et Old Français arsenic, à partir de laquelle les Anglais mot est dérivé de l'arsenic. Sulfures d'arsenic (orpiment, realgar) et les oxydes ont été connu et utilisé depuis les temps anciens. Zosime (vers 300 après JC) décrit torréfaction sandaraque (realgar) pour obtenir nuage de l'arsenic ( oxyde arsénieux), qu'il a ensuite se réduit à l'arsenic métallique. Comme les symptômes de intoxication par l'arsenic étaient assez mal défini, il a été fréquemment utilisé pour assassiner jusqu'à l'avènement de la Marsh essai, un test chimique sensible pour sa présence. (Un autre test moins sensible mais plus générale est la Test Reinsch.) En raison de son utilisation par la classe dirigeante d'assassiner un de l'autre et de sa puissance et de discrétion, l'arsenic a été appelé le poison des rois et le roi des Poisons.
Au cours de l' âge du bronze , de l'arsenic a été souvent inclus dans bronze, ce qui rendait plus difficile l'alliage (ce qu'on appelle " bronze arsenical "). Albertus Magnus (Albert le Grand, 1193-1280) est soupçonné d'avoir été le premier à isoler l'élément d'un composé en 1250, par chauffage avec du savon trisulfure d'arsenic. En 1649, Johann Schröder a publié deux façons de préparer l'arsenic. Cristaux de l'arsenic élémentaire (maternelle) sont trouvés dans la nature, bien que rare.
Fumant liquide (l'impur Cadet cacodyle), souvent prétendu que le premier synthétique composé organométallique, a été synthétisé en 1760 par Louis Claude Cadet de Gassicourt par la réaction de l'acétate de potassium avec le trioxyde d'arsenic.
Dans le Ère victorienne, "l'arsenic" ("arsenic blanc" ou le trioxyde d'arsenic) ont été mélangés avec vinaigre et craie et mangé par les femmes pour améliorer la teint de leurs visages, rendant leur plus pâle de la peau pour montrer qu'ils ne travaillent dans les champs. Arsenic a également été frotté sur les visages et les bras des femmes à «améliorer leur teint". L'utilisation accidentelle de l'arsenic dans le frelatage des denrées alimentaires a conduit à la douce intoxication Bradford en 1858, qui a abouti à environ 20 décès.
Applications
Agricole
La toxicité de l'arsenic à des insectes , des bactéries et des champignons a conduit à son utilisation comme agent de conservation du bois. Dans les années 1950 un processus de traitement du bois avec arséniate de cuivre et de chrome (également connu sous le CCA ou Tanalith) a été inventé, et pendant des décennies ce traitement était l'utilisation industrielle la plus étendue de l'arsenic. Une appréciation accrue de la toxicité de l'arsenic a entraîné une interdiction de l'utilisation de CCA dans les produits de consommation; l' Union européenne et les États-Unis ont lancé ce processus en 2004. CCA reste en usage intensif dans d'autres pays mais, par exemple, les plantations de caoutchouc malaisiens.
L'arsenic a été également utilisé dans divers insecticides agricoles, résiliation et poisons. Par exemple, arséniate de plomb d'hydrogène était un insecticide commune sur arbres fruitiers, mais le contact avec le composé sont parfois soldées par lésions cérébrales parmi ceux qui travaillent les pulvérisateurs. Dans la seconde moitié du 20e siècle, arséniate de méthyle monosodique (MSMA) et arséniate disodique de méthyle (DSMA) - formes organiques moins toxiques d'arsenic - ont remplacé l'arséniate de plomb dans l'agriculture.
L'arsenic est encore ajouté à la nourriture des animaux, en particulier dans les États-Unis comme une méthode de prévention de la maladie et la stimulation de la croissance. Un exemple est roxarsone, qui est utilisé en tant que grilleur démarrage d'environ 70% des producteurs de poulets de chair depuis 1995. La Loi sur la volaille Poison-libre de 2009 propose d'interdire l'utilisation de roxarsone chez le porc industriel et la production de volailles. Alpharma, une filiale de Pfizer Inc., qui produit Roxarsone, a volontairement ventes du médicament suspendu en réponse à des études montrant des niveaux élevés d'arsenic chez les poulets traités.
L'usage médical
Au cours de la 18e, 19e, et 20e siècles, un certain nombre de composés de l'arsenic ont été utilisés comme médicaments, y compris arsphénamine (par Paul Ehrlich) et trioxyde d'arsenic (par Thomas Fowler). Arsphénamine ainsi que neosalvarsan été indiqué pour syphilis et trypanosomiase, mais a été remplacée par modernes antibiotiques . Le trioxyde d'arsenic a été utilisé dans une variété de façons plus de 500 ans, mais le plus couramment dans le traitement du cancer . Les É.U Food and Drug Administration a approuvé en 2000 ce composé pour le traitement de patients avec la leucémie promyélocytaire aiguë résistante à ATRA. Il a également été utilisé comme La solution de Fowler dans le psoriasis. Récemment, de nouvelles recherches ont été effectuées dans la localisation des tumeurs en utilisant l'arsenic-74 (un émetteur de positons). Les avantages d'utiliser cet isotope au lieu du déjà utilisé iode -124, ce est que le signal dans le TEP est plus clair que le corps a tendance à transporter l'iode pour la glande thyroïde produire beaucoup de bruit.
À des doses sub-toxiques, des composés d'arsenic solubles agissent comme stimulants, et étaient autrefois populaire dans de petites doses que la médecine par des personnes dans le milieu du 18e siècle.
Alliages
La principale utilisation de l'arsenic métallique est pour alliage de plomb. Plomb dans les composants les batteries de voiture sont renforcées par la présence de quelques pour cent d'arsenic. Dézincification peut être fortement réduite en ajoutant de l'arsenic laiton, un alliage cuivre-zinc. L'arséniure de gallium est un important semiconducteur matériau, utilisé dans des circuits intégrés . Circuits à base de GaAs sont beaucoup plus rapides (mais aussi beaucoup plus cher) que ceux réalisés en silicium . Contrairement silicium a un bande interdite directe, et peut donc être utilisé dans les diodes laser et LED de convertir directement l'électricité en lumière .
Militaire
Après la Première Guerre mondiale , les États-Unis ont construit un stock de 20 000 tonnes de lewisite (ClCH = CHAsCl 2), arme chimique qui est un vesicant (agent de blister) et irritation pulmonaire. Le stock a été neutralisé avec eau de Javel et déversés dans le golfe du Mexique après les années 1950. Pendant la guerre du Vietnam l' États-Unis utilisé Bleu agent, un mélange de cacodylate de sodium et sa forme acide, comme l'un des herbicides arc en ciel pour envahir privent soldats nord-vietnamiens de couverture du feuillage et le riz.
D'autres utilisations
- acétoarsénite de cuivre a été utilisé comme un vert pigment connu sous plusieurs noms, y compris ' Paris Green »et« vert émeraude ». Il a causé de nombreux empoisonnements à l'arsenic. De Scheele Green, l'arséniate de cuivre, a été utilisé dans le 19ème siècle comme une agent de coloration dans bonbons.
- Également utilisé dans bronzage et pyrotechnie.
- Jusqu'à 2% de l'arsenic est utilisé dans les alliages de plomb pour coups de plomb et balles.
- L'arsenic est ajouté en petites quantités à l'alpha-laiton pour faire résistant à la dézincification. Cette qualité de laiton est utilisé pour faire les raccords de plomberie ou d'autres éléments qui sont en contact permanent avec l'eau.
- L'arsenic est également utilisé pour la conservation des échantillons taxonomique.
- Jusqu'à récemment l'arsenic a été utilisé en verre optique. Fabricants de verre modernes, sous la pression des écologistes, ont enlevé, avec plomb .
Rôle biologique
Bactéries

Certaines espèces de bactéries obtiennent leur énergie par divers combustibles oxydants tout réduire l'arséniate de l'arsénite. Dans des conditions d'environnement oxydatif certaines bactéries utilisent arsénite, qui est oxydé en arséniate de combustible pour leur métabolisme. Le enzymes impliquées sont connus comme réductases arséniate (arr).
En 2008, on a découvert que les bactéries utilisent une version de la photosynthèse en l'absence d'oxygène avec les arsénites Les donneurs d'électrons, les arséniates de production (comme ordinaire juste photosynthèse utilise l'eau comme donneur d'électrons, produisant de l'oxygène moléculaire). Les chercheurs conjecturent que, au cours de l'histoire, ces organismes photosynthétiques produits les arséniates qui ont permis aux bactéries d'arséniate de réduction de prospérer. Une souche PHS-1 a été isolé et est liée à la gammaproteobacterium Ectothiorhodospira shaposhnikovii. Le mécanisme est inconnu, mais une enzyme codée Arr peut fonctionner en sens inverse pour sa connue homologues.
Bien que le arséniate et des anions phosphate sont structurellement similaires, aucune preuve ne existe pour le remplacement du phosphate en ATP ou acides nucléiques par l'arsenic.
Hérédité
L'arsenic a été liée à les changements épigénétiques, changements héréditaires dans l'expression des gènes qui se produisent sans modification séquence d'ADN. Ceux-ci comprennent la méthylation de l'ADN, la modification des histones, et l'interférence ARN. Des niveaux toxiques d'arsenic causent de sérieux hyperméthylation d'ADN de gènes suppresseurs de tumeurs p16 et p53, augmentant ainsi le risque de cancérogenèse. Ces événements épigénétiques ont été étudiés in vitro en utilisant des cellules de rein humaines et in vivo en utilisant des cellules de foie de rat et les leucocytes du sang périphérique chez l'homme. Inductif spectrométrie de masse à plasma (ICP-MS) est utilisé pour détecter des niveaux précis d'arsenic intracellulaire et ses autres bases impliquées dans la modification épigénétique de l'ADN. Les études portant sur l'arsenic comme un facteur épigénétique aideront dans le développement de biomarqueurs précis de l'exposition et de la sensibilité.
La fougère de frein Chinois ( Pteris vittata) hyperaccumulates arsenic présent dans le sol dans ses feuilles et a une utilisation proposée dans phytoremédiation.
Biométhylation
L'arsenic inorganique et ses composés, à l'entrée du chaîne alimentaire, sont progressivement métabolisé par un processus de méthylation. Par exemple, le moule Scopulariopsis brevicaulis produit des quantités importantes de triméthylarsine si l'arsenic inorganique est présent. Le composé organique arsénobétaïne se trouve dans certains aliments marins tels que les poissons et les algues, et aussi dans des champignons dans des concentrations plus élevées. L'apport de la personne moyenne est d'environ 10 à 50 mg / jour. Valeurs environ 1000 ug ne sont pas inhabituelle à la suite de la consommation de poisson ou des champignons, mais il ya peu de danger en mangeant du poisson parce que ce composé de l'arsenic est presque non toxique.
Problèmes environnementaux
Présence dans l'eau potable
Contamination par l'arsenic des eaux souterraines généralisée a conduit à une épidémie massive de empoisonnement à l'arsenic dans Bangladesh et les pays voisins. On estime qu'environ 57 millions de personnes dans le Bassin du Bengale boivent eaux souterraines avec des concentrations d'arsenic élevé au-dessus de la Organisation mondiale de la Santé standard de 10 l ' parties par milliard (ppb). Cependant, une étude des taux de cancer à Taiwan a suggéré que des augmentations significatives de la mortalité par cancer apparaissent uniquement à des niveaux supérieurs à 150 ppb. L'arsenic dans l'eau souterraine est d'origine naturelle, et est libérée du sédiment dans l'eau souterraine, en raison de la conditions anoxiques du sous-sol. Cette eau souterraine a commencé à être utilisé après locaux et occidentaux ONG et le gouvernement du Bangladesh a entrepris un tube massif peu profonde et programme d'eau potable à la fin du XXe siècle. Ce programme a été conçu pour empêcher de boire de bactéries contaminées les eaux de surface, mais n'a pas réussi à tester pour l'arsenic dans les eaux souterraines. Beaucoup d'autres pays et régions dans Asie du Sud, tels que le Vietnam et le Cambodge ont environnements géologiques propices à la génération des eaux souterraines élevés d'arsenic. Arsenicisme a été signalé dans Nakhon Si Thammarat, Thaïlande en 1987, et de la Chao Phraya est suspecté de contenir des niveaux élevés d'arsenic dissous d'origine naturelle, mais n'a pas été un problème de santé publique en raison de l'utilisation de l'eau en bouteille.
Aux États-Unis, l'arsenic est le plus souvent trouvé dans les eaux souterraines de sud-ouest. Pièces de Nouvelle-Angleterre, Michigan, Wisconsin, le Minnesota et les Dakotas sont également connus pour avoir des concentrations importantes d'arsenic dans les eaux souterraines. Des niveaux accrus de cancer de la peau ont été associés à exposition à l'arsenic dans le Wisconsin, même à des niveaux inférieurs à la norme de l'eau 10 partie par milliard potable, bien que ce lien n'a pas été prouvé. Selon un récent film financé par les Etats-Unis Superfund, des millions de puits privés ont des niveaux d'arsenic inconnus, et dans certaines régions des États-Unis, plus de 20% des puits peut contenir des niveaux qui dépassent les limites établies.
L'exposition de bas niveau à l'arsenic à des concentrations couramment trouvé dans l'eau potable des États-Unis compromet la réponse immunitaire initiale H1N1 ou d'une infection de la grippe porcine selon les scientifiques NIEHS soutenus. L'étude, menée sur des souris de laboratoire, suggère que les personnes exposées à l'arsenic dans l'eau potable peuvent être à risque accru de maladie plus grave ou la mort en réponse à l'infection par le virus.
Certains Canadiens sont l'eau qui contient de l'arsenic inorganique potable. Les eaux de puits creusés privées sont plus à risque de contenant de l'arsenic inorganique. Analyse typiquement de l'eau de puits préliminaire ne teste pas pour l'arsenic. Des chercheurs de la Commission géologique du Canada ont modélisé variation relative de l'arsenic naturel potentiel de risque pour la province du Nouveau-Brunswick. Cette étude a des implications importantes pour les préoccupations d'eau potable et de santé relatives à l'arsenic inorganique.
Les données épidémiologiques du Chili montre une connexion dose-dépendante entre l'exposition chronique à l'arsenic et diverses formes de cancer, en particulier lorsque d'autres facteurs de risque, comme le tabagisme, sont présents. Ces effets ont été démontrés à persister au-dessous de 50 ppb.
Analyse de multiples études épidémiologiques sur l'exposition arsenic inorganique suggère une faible mais mesurable augmentation de risque de cancer de la vessie à 10 ppb. Selon Peter Ravenscroft du Département de géographie de l'Université de Cambridge, environ 80 millions de personnes dans le monde consomment entre 10 et 50 ppb d'arsenic dans leur eau potable. Si ils ont tous consommé exactement 10 ppb d'arsenic dans leur eau potable, précédemment citées multiples épidémiologique analyse de l'étude serait de prévoir un 2000 cas supplémentaires de cancer de la vessie seul. Cela représente une sous-estimation claire de l'impact global, car il ne comprend pas pulmonaire ou cancer de la peau, et sous-estime explicitement l'exposition. Ceux qui sont exposés à des niveaux d'arsenic supérieurs à la norme actuelle de l'OMS devrait évaluer les coûts et les avantages de l'assainissement de l'arsenic.
(1973) les premières évaluations de l'élimination de l'arsenic dissous en buvant procédés de traitement de l'eau ont montré que l'arsenic est très efficace éliminé par co-précipitation avec fer ou oxydes d'aluminium. L'utilisation du fer comme coagulant, en particulier, a été trouvé pour éliminer l'arsenic avec des rendements supérieurs à 90%. Plusieurs systèmes de médias d'adsorption ont été approuvés pour une utilisation au point de service dans une étude financée par le Agence des Etats-Unis protection de l'environnement (US EPA) et le National Science Foundation (NSF). Une équipe de scientifiques et d'ingénieurs européens et indiens ont mis en place six usines de traitement de l'arsenic dans Bengale occidental basé sur la méthode d'assainissement in-situ (SAR Technology). Cette technologie ne utilise pas de produits chimiques et de l'arsenic est laissé comme une forme insoluble (5 état) dans la zone souterraine en rechargeant eau gazeuse dans l'aquifère et donc le développement d'une zone d'oxydation pour soutenir l'arsenic micro-organismes oxydant. Ce processus ne produit pas de flux ou de boues déchets et est relativement pas cher.
Une autre méthode efficace et peu coûteux à éliminer l'arsenic de l'eau de puits contaminés est de creuser des puits 500 pieds ou plus pour atteindre les eaux plus pures. Une étude récente 2011 financée par l'Institut national du programme de recherche Superfund de sciences de la santé de l'environnement des États-Unis montre que les sédiments profonds peuvent éliminer l'arsenic et de le sortir de la circulation. Grâce à ce processus appelé adsorption dans laquelle l'arsenic colle aux surfaces des particules de sédiments profonds, l'arsenic peuvent être naturellement retirés de l'eau de puits.
Séparations magnétiques d'arsenic à très faible champ magnétique gradients ont été démontrées dans la purification de l'eau au point d'utilisation avec une grande région de surface et monodisperse la magnétite (Fe 3 O 4) nanocristaux. Utilisation de la zone de surface spécifique élevée de Fe 3 O 4 nanocristaux la masse de déchets associés à l'enlèvement arsenic de l'eau a été considérablement réduit.
Des études épidémiologiques ont suggéré une corrélation entre la consommation chronique d'eau potable contaminée avec de l'arsenic et l'incidence de toutes les principales causes de mortalité. La littérature fournit des raisons de croire exposition à l'arsenic est causal dans la pathogenèse du diabète.
Ingénieur hongrois László Schremmer a récemment découvert que par l'utilisation de filtres à base de paillettes-il est possible de réduire la teneur en arsenic de l'eau à 3 mg / L. Ceci est particulièrement important dans les zones où l'eau potable est fournie par filtration de l'eau extraite du sous-sol aquifère.
préservation du bois aux États-Unis
En 2002, les industries américaines consommé 19 600 tonnes d'arsenic. Quatre-vingt dix pour cent de cette a été utilisé pour le traitement du bois avec arséniate de cuivre chromaté (ACC). En 2007, 50% des 5280 tonnes de la consommation était encore utilisé à cette fin. Aux États-Unis, l'élimination progressive volontaire de l'arsenic dans la production de produits de consommation et produits résidentiels et généraux consommation construction a commencé le 31 Décembre 2003, et d'autres produits chimiques sont maintenant utilisés, tels que Le cuivre alcalin quaternaire, borates, azole de cuivre, le cyproconazole, et propiconazole.
Bien interrompu, cette application est aussi l'un des plus préoccupants pour le grand public. La grande majorité des personnes âgées le bois traité sous pression a été traité à l'ACC. CCA bois est encore largement utilisé dans de nombreux pays, et a été largement utilisé pendant la deuxième moitié du 20e siècle comme une structure et d'extérieur matériau de construction. Bien que l'utilisation du bois CCA a été interdit dans de nombreux domaines après des études ont montré que l'arsenic pourrait se infiltrer sur le bois dans les environs sol (à partir des équipements de jeux, par exemple), un risque est également présenté par la combustion de bois plus CCA. L'ingestion directe ou indirecte de la cendre de bois de bois brûlé CCA a causé des décès chez les animaux et les empoisonnements graves chez l'homme; la dose mortelle pour l'homme est d'environ 20 grammes de cendres. Scrap CCA bois des chantiers de construction et de démolition peut être utilisé par inadvertance dans des incendies commerciaux et domestiques. Protocoles pour l'élimination sûre des CCA bois ne existent pas de façon uniforme à travers le monde; il ya aussi des inquiétudes dans certains milieux au sujet de la généralisation l'enfouissement de ce bois.
Cartographie des rejets industriels aux États-Unis
Un outil qui mappe les rejets d'arsenic à des endroits particuliers aux États-Unis et fournit également des informations supplémentaires sur ces rejets est TOXMAP. TOXMAP est un système d'information géographique (SIG) de la Division des Services spécialisés de l'information de la États-Unis National Library of Medicine (NLM) qui utilise des cartes des États-Unis pour aider les utilisateurs à explorer visuellement les données de la United States Environmental Protection Agency de (EPA) Toxics Release Inventory et Superfund programmes de recherche fondamentale. TOXMAP est une ressource financée par le gouvernement fédéral américain. Santé environnementale chimique et l'information de TOXMAP est tiré de toxicologie réseau de données NLM (de TOXNET) et PubMed, et d'autres sources faisant autorité.
Toxicité et précautions
L'arsenic et le nombre de ses composés sont particulièrement puissants poisons. Beaucoup de réserves d'eau à proximité de mines sont contaminés par ces poisons. Aux États-Unis, la concentration maximale autorisée dans l'eau potable est de 10 ppb et 5 ppb pour l'eau embouteillée. Il ne existe aucune norme pour la nourriture, bien que dans la couverture de presse 2012 appels pour développer une telle invite. La République populaire de Chine a une norme alimentaire.
Composés de l'arsenic élémentaire et d'arsenic sont classés comme " toxiques "et" dangereux pour l'environnement "dans le Union européenne en vertu directive 67/548 / CEE. Le Centre international de recherche sur le cancer (CIRC) reconnaît composés de l'arsenic et que groupe 1 des cancérogènes, et l'UE répertorie trioxyde d'arsenic, pentoxyde d'arsenic et sels de arséniate dans la catégorie 1 cancérogènes.
L'arsenic est connu pour causer arsenicose raison de sa manifestation dans l'eau potable, "les espèces les plus communes étant l'arséniate [HAsO 2-
4; As (V)] et l'arsénite [H 3 AsO 3; As (III)] ".
Traitement
Traitement de l'intoxication chronique à l'arsenic est facilement accompli. Anti-lewisite britannique ( dimercaprol) est prescrit à la dose de 5 mg / kg jusqu'à 300 mg toutes les 4 heures pour le premier jour, puis tous les 6 heures pour le deuxième jour, et enfin toutes les huit heures pour huit jours supplémentaires. Cependant la CUA Agence pour les substances toxiques et les maladies (ATSDR) indique que les effets à long terme de l'exposition de l'arsenic ne peuvent être prédits. Sang, urine, cheveux, et les ongles peuvent être testés pour l'arsenic; Toutefois, ces tests ne peuvent pas prévoir les résultats possibles pour la santé de l'exposition. L'excrétion se produit dans les urines et à long terme exposition à l'arsenic a été liée à la vessie et le cancer du rein en plus du cancer du foie, de la prostate, de la peau, les poumons et la cavité nasale.
Mécanisme biologique
L'affinité élevée d'arsenic oxydes (III) pour thiols est généralement assigné comme la cause de la toxicité élevée. Thiols, généralement sous la forme de résidus de cysteine, mais aussi dans des cofacteurs tels que l'acide lipoïque et coenzyme A, sont situés sur les sites actifs de plusieurs importantes enzymes.
Arsenic perturbe ATP production à travers plusieurs mécanismes. Au niveau de la cycle de l'acide citrique, l'arsenic inhibe l'acide lipoïque, qui est un cofacteur pour pyruvate déshydrogénase. En outre, en concurrence avec le phosphate, arséniate Découple phosphorylation oxydative, inhibant ainsi la réduction lié énergie NAD +, la respiration mitochondriale et de la synthèse d'ATP. production de peroxyde d'hydrogène est également augmenté, ce qui, il est supposé, a le potentiel pour former des espèces réactives de l'oxygène et du stress oxydatif. Ces interférences métaboliques mènent à la mort de multi-systèmes défaillance d'un organe. La défaillance d'un organe est présumé être de mort cellulaire nécrotique, pas apoptose, puisque les réserves d'énergie ont été trop appauvri pour l'apoptose de se produire.
Un post mortem dans un mort empoisonnement à l'arsenic révèle des briques de couleur rouge muqueuse, en raison de graves hémorragies .
Bien que l'arsenic provoque une toxicité, il peut aussi jouer un rôle protecteur.

