
Helicobacter pylori
Sabías ...
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . Para comparar obras de caridad de patrocinio este es el mejor vínculo de patrocinio .
| Infección por Helicobacter pylori | |
|---|---|
| Clasificación y recursos externos | |
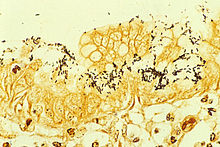
 La tinción inmunohistoquímica de H. pylori a partir de una biopsia gástrica | |
| CIE- 10 | B 98.0 |
| CIE- 9 | 041,86 |
| DiseasesDB | 5702 |
| MedlinePlus | 000229 |
| Medcenter | med / 962 |
| MeSH | D016481 |
Helicobacter pylori ( / ˌ h ɛ l ɪ k ɵ b æ k t del ər p aɪ l ɔər aɪ /; H. pylori), Campylobacter pyloridis anteriormente nombrados, es un Gramnegativos, microaerophilic bacteria que se encuentra en el estómago. Se identificó en 1982 por Barry Marshall y Robin Warren, quien encontró que estaba presente en los pacientes con enfermedades crónicas gastritis y las úlceras gástricas, condiciones que no se creían que tienen una causa microbiana. También está relacionada con el desarrollo de úlceras duodenales y cáncer de estómago. Sin embargo, más del 80 por ciento de las personas infectadas con la bacteria son asintomáticos y se ha postulado que puede desempeñar un papel importante en la ecología de estómago natural.
Más del 50% de H. puerto de la población mundial pylori en su parte superior tracto gastrointestinal. La infección es más frecuente en los países en desarrollo, y la incidencia está disminuyendo en los países occidentales. H. forma de hélice pylori 's (de la que el genérico se deriva su nombre) se cree que han evolucionado para penetrar en el revestimiento mucoso del estómago.
Signos y síntomas
Más del 80% de las personas infectadas con H. pylori no muestran síntomas. La infección aguda puede aparecer como una enfermedad aguda gastritis con dolor abdominal (dolor de estómago) o náuseas. Cuando esto se convierte en la gastritis crónica, los síntomas, si existen, son a menudo las de no ulcerosa dispepsia: dolor estomacal, náuseas, hinchazón, eructos, ya veces vómitos o negro heces.
Los individuos infectados con H. pylori tienen un riesgo de por vida de 10 a 20% de desarrollar úlceras pépticas y un riesgo de 1 a 2% de adquirir cáncer de estómago. La inflamación de la antro pilórico es más probable que conduzca a úlceras duodenales, mientras que la inflamación de la corpus (cuerpo del estómago) es más probable que conduzca a úlceras gástricas y gástrico carcinoma. Sin embargo, es posible que H. pylori desempeña un papel sólo en la primera etapa que conduce a la inflamación crónica común, pero no en otras etapas que conducen a la carcinogénesis. Un meta-análisis realizado en 2009 concluyó que la erradicación de H. pylori reduce el riesgo de cáncer gástrico en individuos previamente infectados, lo que sugiere que la presencia continua de H. pylori es un factor de riesgo para el cáncer gástrico.
Microbiología
| Helicobacter pylori | |
|---|---|
 | |
| Clasificación científica | |
| Dominio: | Bacterias |
| Filo: | Proteobacteria |
| Clase: | Epsilonproteobacteria |
| Orden: | Campylobacterales |
| Familia: | Helicobacteraceae |
| Género: | Helicobacter |
| Especie: | H. pylori |
| Nombre binomial | |
| Helicobacter pylori (Marshall et al., 1985) Goodwin et al., 1989 | |

H. pylori es una hélice en forma de (clasificado como un curvado varilla, no espiroqueta) Gram-negativos bacteria alrededor de 3 micrómetros de largo con un diámetro de aproximadamente 0,5 micrómetros. Es microaerófila; es decir, que requiere oxígeno , pero a una concentración más baja que se encuentra en la atmósfera . Contiene una hidrogenasa que puede ser utilizado para obtener energía mediante la oxidación molecular de hidrógeno (H 2) producido por las bacterias intestinales. Produce oxidasa, catalasa, y ureasa. Es capaz de formar biofilms y puede convertir de espiral a una posible viable pero no cultivable forma cocoides, tanto probable que favorezcan su supervivencia y ser factores en el epidemiología de la bacteria.
H. pylori posee cinco grandes proteína de membrana externa (OMP) familias. La familia más grande incluye conocida y putativo adhesinas. Las otras cuatro familias porinas, transportistas de hierro, proteínas flagelo asociadas, y las proteínas de función desconocida. Al igual que otras bacterias Gram-negativas típicas, la membrana externa de H. pylori consiste en fosfolípidos y lipopolisacárido (LPS). La Antígeno O de LPS puede ser fucosilado y mímicos Lewis antígenos de grupos sanguíneos encuentran en el epitelio gástrico. La membrana externa también contiene glucósidos de colesterol, que se encuentran en algunas otras bacterias. H. pylori tiene cinco y cincuenta y seis lophotrichous flagelos; todas las especies de Helicobacter gástricas y enterohepático son muy móviles debido a flagelos. Las características filamentos flagelares enfundados de Helicobacter se componen de dos flagelinas copolimerizados, FlaA y FlaB.
Genoma
H. pylori consta de una gran diversidad de cepas, y la genomas de tres han sido completamente secuenciado. El genoma de la cepa "26695" se compone de alrededor de 1,7 millones pares de bases, con unos 1.550 genes. Las dos cepas secuenciadas muestran grandes diferencias genéticas, con un máximo de 6% de la nucleótidos diferentes.
Estudio de la H. genoma pylori se centra en los intentos por comprender patogénesis, la capacidad de este organismo para causar la enfermedad. Aproximadamente el 29% de los loci están en la categoría "patogénesis" de la base de datos del genoma. Dos de las cepas secuenciadas tienen un aproximado de 40 kb-largo Cag isla de patogenicidad (una común secuencia del gen cree responsable de la patogénesis) que contiene más de 40 genes. Esta isla de patogenicidad está generalmente ausente de H. pylori cepas aisladas de humanos que son portadores de H. pylori, pero siguen siendo asintomática.
La cagA gen codifica para una de las principales H. pylori proteínas de virulencia. Las cepas bacterianas que tienen el gen cagA se asocian con una capacidad de causar úlceras. El gen cagA de una (1186 relativamente larga de aminoácidos de proteínas). La isla de patogenicidad cag (PAI) tiene alrededor de 30 genes, parte de los cuales código para un complejo sistema de secreción tipo IV. El bajo GC-contenido de la cag PAI relación con el resto del genoma Helicobacter sugiere la isla fue adquirida por la transferencia horizontal de otra especie bacteriana.
Fisiopatología

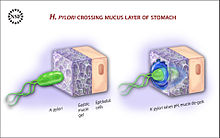
Para colonizar el estómago, H. pylori debe sobrevivir el pH ácido de la lumen y utilizar sus flagelos para excavar en la moco alcance su nicho, cerca de la capa de células epiteliales del estómago. Muchas bacterias se pueden encontrar profundamente en el moco, que es secretada continuamente por las células secretoras de moco y eliminadas en el lado luminal. Para evitar ser llevado en el lumen, H. pylori detecta el gradiente de pH dentro de la capa de moco por quimiotaxis y nada lejos de los contenidos ácidos del lumen hacia el medio ambiente más neutro pH de la superficie de la célula epitelial. H. pylori también se encuentra en la superficie interna del estómago células epiteliales y de vez en cuando dentro de las células epiteliales. Produce adhesinas que se unen a la membrana asociada a lípidos y carbohidratos y ayudar a que se adhiera a las células epiteliales. Por ejemplo, el BabA adhesina se une al antígeno Lewis b aparece en la superficie de las células epiteliales del estómago. H. pylori produce grandes cantidades de la enzima ureasa, moléculas de los cuales se localizan dentro y fuera de la bacteria. La ureasa se descompone urea (que normalmente se secreta en el estómago) a dióxido de carbono y amoniaco . El amoníaco se convierte en amonio mediante la aceptación de un protón (H +), que neutraliza ácido gástrico. La supervivencia de H. pylori en el estómago ácido depende de la ureasa. El amoníaco producido es tóxico para las células epiteliales, y, junto con los otros productos de H. -incluyendo pylori proteasas, vacuolizantes citotoxina A (VacA), y cierta fosfolipasas, - daños esas células.
Los procesos inflamatorios de H. infecciones pylori también están mediados por proteínas altamente puentes disulfuro. Proteínas de Helicobacter ricas en cisteína (PCH), particularmente HCPA (hp0211), desencadena una respuesta inmune a través de la diferenciación de humano THP1 mieloide monocitos en macrófagos. En analogía a los eucariotas citoquinas, interfieren con las funciones de la célula huésped y cambian la morfología de los monocitos, la inducción de la expresión de la proteína de marcador de superficie CD11b, la actividad fagocítica, así como la adhesión celular, que son indicativos de diferenciación de los monocitos en macrófagos.
La colonización del estómago por H. pylori produce gastritis crónica, una inflamación del revestimiento del estómago. La gravedad de la inflamación es probable que la base de H. pylori -relacionados enfermedades. Las úlceras duodenales y estomacales producen cuando las consecuencias de la inflamación permiten el ácido y pepsina en el lumen del estómago a abrumar los mecanismos que protegen el estómago y en la mucosa duodenal de estas sustancias cáusticas. El tipo de úlcera que se desarrolla depende de la localización de la gastritis crónica, que se produce en el sitio de H. colonización pylori. La acidez dentro del lumen del estómago afecta el patrón de colonización de H. pylori, y por lo tanto en última instancia, determina si se forma una úlcera duodenal o gástrica. En las personas que producen grandes cantidades de ácido, H. pylori coloniza la antro del estómago para evitar el ácido secretan células parietales situadas en el corpus (cuerpo principal) del estómago. La respuesta inflamatoria a las bacterias induce Las células G en el antro para secretar la hormona gastrina, que viaja a través del torrente sanguíneo hasta el corpus. La gastrina estimula las células parietales del corpus para secretar más ácido en el lumen del estómago. El aumento de los niveles de gastrina crónicamente causan finalmente el número de células parietales para aumentar también, escalada adicionalmente la cantidad de ácido secretado. El aumento de los daños y perjuicios de carga de ácido del duodeno, y ulceración eventualmente pueden resultar. En contraste, las úlceras gástricas se asocian a menudo con la producción de ácido gástrico normal o reducida, lo que sugiere los mecanismos que protegen la mucosa gástrica son defectuosos. En estos pacientes, H. pylori también puede colonizar el corpus del estómago, donde el ácido secretor células parietales se encuentran. Sin embargo inflamación crónica inducida por la bacteria causa una mayor reducción de la producción de ácido y, eventualmente, atrofia de la mucosa del estómago, lo que puede conducir a la úlcera gástrica y aumenta el riesgo de cáncer de estómago.
Acerca de 50-70% de H. pylori cepas en los países occidentales llevan la isla de patogenicidad cag (cag PAI). Pacientes occidentales infectados con cepas portadoras del cag PAI tienen una respuesta inflamatoria más fuerte en el estómago y se encuentran en un mayor riesgo de desarrollar úlceras pépticas o cáncer de estómago que aquellos infectados con cepas que carecen de la isla. Después de la unión de H. pylori a las células epiteliales del estómago, los sistema de secreción tipo IV expresada por el cag PAI "inyecta" la inflamación agente inductor, peptidoglicano, desde su propia de la pared celular en las células epiteliales. El peptidoglicano inyectado es reconocido por el citoplasmática receptor de reconocimiento de patrones (sensor inmune) Nod1, que luego estimula la expresión de citoquinas que promueven inflamación.
El tipo IV aparato de secreción también inyecta la cag PAI-codificada proteína CagA en las células epiteliales del estómago, donde se interrumpe el citoesqueleto, la adhesión a las células adyacentes, la señalización intracelular, la polaridad celular y otras actividades celulares. Una vez dentro de la célula, la proteína CagA es fosforilados en residuos de tirosina por una asociada a la membrana de la célula huésped tirosina quinasa (TK). CagA entonces activa alostéricamente proteína tirosina fosfatasa / protooncogén SHP2. Las cepas patógenas de H. pylori se ha demostrado para activar el receptor del factor de crecimiento epidérmico (EGFR), una proteína de membrana con una tirosina quinasa dominio. La activación del EGFR por H. pylori se asocia con la alteración transducción de señales y la expresión génica en las células epiteliales de acogida que pueden contribuir a la patogénesis. También se ha sugerido que una Región C-terminal de la proteína CagA (aminoácidos 873 a 1.002) se puede regular la célula huésped la transcripción de genes, independiente de la fosforilación de tirosina de proteínas. Hay una gran diversidad entre las cepas de H. pylori, y la cepa con la que uno está infectado es predictivo del resultado.
Dos mecanismos relacionados por los cuales H. pylori podría promover el cáncer se encuentran bajo investigación. Un mecanismo implica el aumento de la producción de los radicales libres cerca H. pylori y una mayor tasa de célula huésped mutación. El otro mecanismo propuesto ha sido llamado un "camino perigenetic", y consiste en la mejora del fenotipo de la célula huésped transformada por medio de alteraciones en las células proteínas , tales como proteínas de adhesión. H. pylori se ha propuesto para inducir inflamación y localmente altos niveles de TNF-α y / o interleucina 6 (IL-6). Según el mecanismo propuesto perigenetic, las moléculas de señalización asociados con la inflamación, tales como TNF-α, pueden alterar la adhesión celular epitelial gástrica y conducir a la dispersión y la migración de las células epiteliales mutados sin la necesidad de mutaciones adicionales en genes supresores de tumores, tales como genes que codifican para proteínas de adhesión celular.
Diagnóstico
La colonización con H. pylori no es una enfermedad en sí misma, sino una condición asociada con un número de trastornos del tracto gastrointestinal superior. Las pruebas para H. pylori se recomienda si hay enfermedad de úlcera péptica, gástrica bajo grado Linfoma MALT, después de la resección endoscópica de principios cáncer gástrico, si hay parientes de primer grado con cáncer gástrico, y en ciertos casos de dispepsia, no rutinaria. Existen varias maneras de pruebas. Uno puede probar de forma no invasiva para H. pylori con la sangre de anticuerpos de prueba, las heces antígeno prueba, o con el prueba del aliento de carbono (en la que el paciente bebe 14 C-o 13 C marcado con urea , que metaboliza la bacteria, la producción de la etiqueta de dióxido de carbono que puede detectarse en el aliento). Sin embargo, el método más fiable para la detección de H. infección pylori es una cheque biopsia durante endoscopia con una prueba rápida de ureasa, el examen histológico y cultivo microbiano. También hay una orina Prueba de ELISA con una sensibilidad del 96% y 79% de especificidad. Ninguno de los métodos de prueba es completamente a prueba de fallos. Incluso biopsia depende de la localización de la biopsia. Las pruebas de anticuerpos de la sangre, por ejemplo, van desde 76% a 84% sensibilidad. Algunos medicamentos pueden afectar H. pylori actividad ureasa y dar falsos negativos con las pruebas a base de urea.
Prevención
H. pylori es una causa importante de ciertas enfermedades del tracto gastrointestinal superior. Creciente resistencia a los antibióticos aumenta la necesidad de buscar nuevas estrategias terapéuticas; esto podría incluir la prevención en forma de vacunación. Extensos estudios de vacunas en modelos de ratón han mostrado resultados prometedores. Los investigadores están estudiando diferentes adyuvantes, antígenos y vías de inmunización para determinar el sistema más adecuado de protección inmune; Sin embargo, la mayor parte de la investigación se mudaron recientemente de animales para los ensayos en humanos.
Vacunas
Las vacunas contra H. pylori podría ser utilizado como vacunas profilácticas para prevenir la infección o como vacunas terapéuticas para curar la infección, para mejorar el éxito erradicación de regímenes estándar o para reducir la densidad bacteriana en la mucosa gástrica y el riesgo de aparición de cepas resistentes a los antibióticos. En los últimos años, muchos intentos, usando varias H. Se han hecho antígenos pylori como ureasa, CagA, HP-PAN, HSPA o combinaciones, muchos adyuvantes y diferentes vías de inmunización para crear vacunas contra H. infección pylori. Aunque algunos intentos son prometedores, no existe una vacuna efectiva y segura contra H. pylori está actualmente disponible para los seres humanos. Nuevas orientaciones para la inmunización con el uso de ADN, que viven vectores, etc. microesferas están actualmente en evaluación. El plan de vacunación y los grupos que deben recibir la vacuna todavía por determinar, pero la vacunación serán útiles, especialmente en los países en desarrollo. Una vacuna intramuscular contra H. pylori está experimentando Fase I de ensayos clínicos, y ha mostrado una respuesta de anticuerpos contra la bacteria. Su utilidad clínica requiere más estudio.
Tratamiento
Una vez H. pylori se detecta en una persona con una úlcera péptica, el procedimiento normal es para erradicarla y permitir que cicatrice la úlcera. El estandar tratamiento de primera línea es una semana de "terapia triple" que consiste en inhibidores de la bomba de protones tales como omeprazol y los antibióticos claritromicina y amoxicilina. Variaciones de la terapia triple se han desarrollado a lo largo de los años, tales como el uso de un inhibidor de la bomba de protones diferente, como con pantoprazol o rabeprazol, o la sustitución de amoxicilina con metronidazol para las personas que son alérgicas a penicilina. Tal terapia ha revolucionado el tratamiento de úlceras pépticas y ha hecho una cura para la enfermedad posible; Anteriormente, la única opción era el control de síntomas usando antiácidos, Antagonistas de H2 o inhibidores de la bomba de protones por sí solos.
Un número creciente de personas infectadas se encuentran a puerto las bacterias resistentes a los antibióticos. Esto da como resultado el fracaso del tratamiento inicial y requiere rondas adicionales de estrategias de terapia o alternativas a los antibióticos, tales como una terapia cuádruple, que añade un bismuto coloides, tales como salicilato de bismuto. Para el tratamiento de claritromicina cepas resistentes de H. pylori, el uso de levofloxacina como parte de la terapia se ha sugerido.
Un artículo en el American Journal of Clinical Nutrition encontró evidencia de que "la ingestión bacterias lácticas ejerce un efecto supresor sobre la infección por Helicobacter pylori en los animales y los seres humanos ", señalando que" la suplementación con Lactobacillus-y- Se demostró que contiene Bifidobacterium-yogur (AB-yogur) para mejorar las tasas de erradicación de H. pylori en humanos ".
Pronóstico
H. pylori coloniza el estómago e induce crónica gastritis, una inflamación de larga duración del estómago. La bacteria persiste en el estómago durante décadas en la mayoría de las personas. La mayoría de los individuos infectados por H. pylori nunca experimentará síntomas clínicos a pesar de tener gastritis crónica. Aproximadamente el 10-20% de los colonizada por H. pylori en última instancia, desarrollar úlceras gástricas y duodenales. H. infección pylori también se asocia con un riesgo de por vida 1-2% de cáncer de estómago y un riesgo menor que 1% de gástrica Linfoma MALT.
En ausencia de tratamiento, H. infección una vez pylori establecido en su nicho gástrico-Se cree ampliamente que persista por vida. En los ancianos, sin embargo, es probable que la infección puede desaparecer como la mucosa del estómago se vuelve cada vez atrófica e inhóspito a la colonización. La proporción de las infecciones agudas que persisten no se conoce, pero varios estudios que siguió a la historia natural de las poblaciones han informado aparente eliminación espontánea.
La evidencia creciente sugiere que H. pylori tiene un papel importante en la protección de algunas enfermedades. La incidencia de enfermedad de reflujo ácido, El esófago de Barrett, y cáncer de esófago han ido aumentando de manera espectacular al mismo tiempo como H. presencia pylori 's disminuye. En 1996, Martin J. Blaser avanzó la hipótesis de que H. pylori tiene un efecto beneficioso: mediante la regulación de la acidez del contenido del estómago. La hipótesis no es universalmente aceptada como varios los ensayos controlados aleatorios no demostró empeoramiento de los síntomas de la enfermedad de reflujo ácido tras la erradicación de H. pylori. Sin embargo, Blaser ha refinado su opinión afirmando que H. pylori es un miembro de la flora normal del estómago. Se postula que los cambios en la fisiología gástrica causada por la pérdida de H. cuenta pylori por el reciente aumento de la incidencia de varias enfermedades, incluyendo diabetes tipo 2, obesidad y asma . Su grupo ha demostrado recientemente que H. colonización pylori se asocia con una menor incidencia de asma infantil.
La supervivencia de H. pylori depende de la transformación y la reparación del ADN recombinational
La patogénesis de H. pylori depende de su capacidad para sobrevivir en el entorno gástrico dura caracterizado por la acidez, el peristaltismo, y el ataque de los fagocitos acompañados por la liberación de especies reactivas del oxígeno. En particular, H. pylori provoca una respuesta de estrés oxidativo durante la colonización de acogida. Esta respuesta al estrés oxidativo induce aductos de ADN oxidativo potencialmente letales y mutagénicos en el H. genoma pylori.
Como revisado por Michod et al., Vulnerabilidad al estrés oxidativo y el daño oxidativo del ADN se produce comúnmente en muchos patógenos bacterianos estudiados incluyendo Neisseria gonorrhoeae, Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus mutans y Helicobacter pylori. Para cada uno de estos patógenos, sobrevivir al daño del ADN inducido por el estrés oxidativo parece ser apoyado por la reparación de recombinación transformación mediada. Por lo tanto, la transformación y la reparación de recombinación parecen contribuir a la infección exitosa.
Como se resume en Transformación (genética), la transformación (la transferencia de ADN de una célula bacteriana a otra a través del medio que interviene) parece ser parte de una adaptación para la reparación del ADN. H. pylori es naturalmente competente para la transformación. Mientras que muchos organismos son competentes sólo bajo ciertas condiciones ambientales, tales como el hambre, la H. pylori es competente largo de crecimiento logarítmico. Como ha señalado Dorer et al., Todos los organismos codifican programas genéticos para la respuesta a situaciones de estrés, incluyendo los que causan daño en el ADN. En H. pylori, se requiere la recombinación homóloga para la reparación de ADN doble filamento se rompe (DSBs). Los AddAB reseca complejos helicasa-nucleasa DSBs y cargas RecA Onto sola cadena de ADN (ssDNA), que luego media en el intercambio de cadenas, lo que conduce a la recombinación homóloga y la reparación. El requisito de RecA más AddAB para la colonización gástrica eficiente sugiere que en el estómago H. pylori está bien expuesto a daños en el ADN de doble cadena que debe ser reparada o requiere algún otro evento de recombinación mediada. En particular, transformación natural se incrementa por daño del ADN en H. pylori, y Dorer et al. encontrado una conexión entre la respuesta al daño del ADN y la captación de ADN en H. pylori, lo que sugiere que la competencia natural contribuye a la persistencia de la H. pylori en su huésped humano y explica el mantenimiento de la competencia en la mayoría de los aislados clínicos.
RuvC proteína es esencial para el proceso de reparación de recombinación ya que resuelve intermedios en este proceso denominan uniones Holliday. H. pylori mutantes que son defectuosos en ruvC han aumentado la sensibilidad a agentes que dañan el ADN y al estrés oxidativo, exposición redujo la supervivencia dentro de los macrófagos, y son incapaces de establecer la infección con éxito en un modelo de ratón. Del mismo modo, la proteína RecN juega un papel importante en la reparación de DSB en H. pylori. Un H. pylori recN mutante muestra una capacidad atenuada de colonizar los estómagos de ratón, destacando la importancia de la reparación del ADN de recombinación en la supervivencia de H. pylori dentro de su huésped.
Epidemiología
Al menos la mitad de la población mundial está infectada por la bacteria, por lo que es la infección más extendida en el mundo. Las tasas de infección reales varían de país a país; la el mundo en desarrollo tiene mucho más altas tasas de infección que Occidente ( Europa Occidental, América del Norte , Australasia), donde se estima que las tasas de en torno al 25%. La edad en que se adquiere esta bacteria parece influir en el posible resultado patológico de la infección: las personas infectadas con él a una edad temprana son propensos a desarrollar la inflamación más intensa que puede ir seguida de gastritis atrófica con un mayor riesgo posterior de la úlcera gástrica, cáncer gástrico o ambos. Adquisición a una edad avanzada trae cambia más probable que conduzca a la úlcera duodenal diferente gástrico. Las infecciones se adquieren normalmente en la primera infancia en todos los países. Sin embargo, la tasa de infección de los niños en los países en desarrollo es mayor que en las naciones industrializadas, probablemente debido a las malas condiciones sanitarias. En los países desarrollados en la actualidad es raro encontrar niños infectados, pero el porcentaje de personas infectadas aumenta con la edad, con alrededor del 50% infectados para los mayores de 60 años de edad en comparación con alrededor del 10% entre 18 y 30 años. La mayor prevalencia entre los ancianos se debe al alza las tasas de infección cuando eran niños en vez de la infección en edades posteriores. En los Estados Unidos, la prevalencia parece ser mayor en Afroamericano y Poblaciones hispanas, muy probablemente debido a factores socioeconómicos. La menor tasa de infección en Occidente se atribuye en gran medida a las normas de higiene y su uso generalizado de antibióticos. A pesar de las altas tasas de infección en ciertas áreas del mundo, la frecuencia global de H. pylori está disminuyendo. Sin embargo, resistencia a los antibióticos está apareciendo en H. pylori; ya hay muchos metronidazole- y claritromicina resistente cepas en la mayor parte del mundo.
H. pylori es contagiosa, aunque la ruta exacta de la transmisión no se conoce. La transmisión de persona a persona, ya sea la oral-oral o es más probable vía fecal-oral. En consonancia con estas rutas de transmisión, las bacterias se han aislado de heces, saliva y la placa dental de algunas personas infectadas. Los resultados sugieren que H. pylori se transmite más fácilmente a través de moco gástrico que a través de la saliva La transmisión se produce principalmente dentro de las familias en los países desarrollados pero también puede ser adquirida de la comunidad en los países en desarrollo. H. pylori también puede transmitirse por vía oral a través de la materia fecal a través de la ingestión de agua contaminada con residuos, por lo que un ambiente higiénico podría ayudar a disminuir el riesgo de H. infección pylori.
Evolución
Helicobacter pylori emigraron de África, junto con su huésped humano alrededor de hace unos 60.000 años. Su posterior evolución creó siete prototipos-Europa (aislado de Europa, Oriente Medio, India e Irán), NE África (desde el noreste de África), África1 (de países de África occidental y África del Sur), África2 (de Sudáfrica), Asia2 (desde el norte de la India y entre los aislados procedentes de Bangladesh, Tailandia y Malasia), Sahul (de los aborígenes de Australia y Papua Nueva Guinea) y Asia Oriental con las subpoblaciones E Asia (de los asiáticos del este), los maoríes (de los aborígenes taiwaneses, melanesios y polinesios) y Amerind (nativos americanos). Los precursores de estos prototipos se han llamado ancestral Europa1, ancestral Europe2, Asia oriental ancestral, ancestral África1, ancestral África2 y ancestral Sahul. Estos prototipos ancestrales parecen tener su origen en África, Asia Central y Oriental. Cepas europeas y africanas se introdujeron en las Américas junto con sus colonización -tanto hace miles de años y más recientemente- la trata de esclavos.
Estados recientes de investigación que la diversidad genética en H. pylori aumenta con la distancia geográfica de África del Este , el lugar de nacimiento de los humanos modernos. Utilizando los datos de diversidad genética, los investigadores han creado simulaciones que indican que las bacterias parecen haberse extendido desde África oriental hace unos 58.000 años. Sus resultados indican humanos modernos ya estaban infectados por H. pylori antes de su migración fuera de África, y se ha mantenido asociado a huéspedes humanos desde entonces.
Historia
Helicobacter pylori fue descubierto por primera vez en los estómagos de los pacientes con gastritis y úlceras estomacales en 1982 por el Dr. Barry Marshall y el Dr. Robin Warren, de Perth, Australia Occidental . En ese momento, el pensamiento convencional era que ningún bacteria puede vivir en el estómago humano, como el estómago produce grandes cantidades de ácido de una fuerza similar al ácido que se encuentran en una batería de coche. Marshall y Warren reescribieron los libros de texto con referencia a lo que causa gastritis y úlceras gástricas. En reconocimiento de su descubrimiento, fueron galardonados con el 2005 Premio Nobel de Fisiología o Medicina.
Previo a la investigación de Marshall y Warren, científicos alemanes encontraron en forma de espiral bacterias en el revestimiento del estómago humano en 1875, pero no fueron capaces de que la cultura, y los resultados se olvidan con el tiempo. El investigador italiano Giulio Bizzozero describió bacterias que viven de forma similar en el ambiente ácido del estómago de perros en 1893. Profesor Walery Jaworski de la Universidad Jagellónica de Cracovia investigó sedimentos de lavados gástricos obtenidos de seres humanos en 1899. Entre algunas bacterias en forma de varilla, también encontraron la bacteria con forma de espiral característica, que él llamó Vibrio rugula. Él fue el primero en sugerir una posible papel de este organismo en la patogénesis de las enfermedades gástricas. Este trabajo fue incluido en el Manual de enfermedades gástricas, pero tuvo poco impacto, como estaba escrito en polaco. Varios pequeños estudios realizados en el siglo 20 demostraron la presencia de barras curvadas en el estómago de muchos pacientes con úlceras pépticas y cáncer de estómago. El interés por las bacterias disminuyó, sin embargo, cuando un estudio estadounidense publicado en 1954 no observó la bacteria en 1.180 biopsias de estómago.
El interés en la comprensión del papel de las bacterias en las enfermedades del estómago se reavivó en la década de 1970, con la visualización de las bacterias en el estómago de los pacientes con úlcera gástrica. La bacteria también se había observado en 1979, por el patólogo australiano Robin Warren, que hizo más investigación sobre el mismo con el médico australiano Barry Marshall a partir de 1981. Después de numerosos intentos fallidos de cultivo de la bacteria del estómago, que finalmente tuvo éxito en colonias visualizando en 1982, cuando involuntariamente dejaron su Placas de Petri de incubar durante 5 días sobre la Pascua fin de semana. En su artículo original, Warren y Marshall afirmaron que la mayoría de las úlceras de estómago y gastritis fueron causadas por la infección por esta bacteria y no por estrés o la comida picante, como se había supuesto antes.
Aunque había cierto escepticismo al principio, dentro de varios años numerosos grupos de investigación comprobó la asociación de H. pylori con gastritis y, en menor medida, las úlceras. Para demostrar H. pylori causa gastritis y fue no sólo un espectador, Marshall bebió un vaso de precipitados de H. cultura pylori. Se puso enfermo con náuseas y vómitos varios días después. Una endoscopia de diez días después de la inoculación revelaron signos de gastritis y la presencia de H. pylori. Estos resultados sugieren H. pylori era el agente causal de la gastritis. Marshall y Warren continuaron para demostrar que los antibióticos son eficaces en el tratamiento de muchos casos de gastritis. En 1987, el Sydney gastroenterólogo Thomas Borody inventó la primera terapia triple para el tratamiento de las úlceras duodenales. En 1994, el Institutos Nacionales de Salud (EE.UU.) publicó un dictamen en el duodenal más recurrentes y las úlceras gástricas fueron causadas por H. pylori, y recomendadas antibióticos se incluirán en el régimen de tratamiento.
La bacteria fue nombrado inicialmente pyloridis Campylobacter, luego rebautizado C. pylori (pylori siendo el genitivo de píloro) para corregir una Error gramática latina. Cuando 16S ARN ribosomal la secuenciación de genes y otras investigaciones demostraron en 1989 que la bacteria no pertenecía en el género Campylobacter, se coloca en su propio género , Helicobacter. El género deriva del griego antiguo Helix / έλιξ "espiral" o "bobina". Mediante el epíteto específico pylori "del píloro" o válvula pilórica (la abertura circular que va desde el estómago hacia el duodeno), de la palabra griega πυλωρός Antiguo, lo que significa gatekeeper.

