
Insulina
Sabías ...
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| Insulina | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Imagen generada por computadora de seis moléculas de insulina se reunieron en un hexámero, destacando el triple simetría , las de zinc iones mantenga unida, y la residuos de histidina implicados en la unión de cinc. La insulina se almacena en el cuerpo como un hexámero, mientras que la forma activa es el monómero. | |||||||||||||
| |||||||||||||
| Identificadores | |||||||||||||
| Símbolos | INS; IDDM2; ILPR; IRDN; MODY10 | ||||||||||||
| ID externos | OMIM: 176730 MGI: 96573 HomoloGene: 173 ChEMBL: 5881 GeneCards: INS Gen | ||||||||||||
| |||||||||||||
| Patrón de expresión de ARN | |||||||||||||
 | |||||||||||||
| Más datos de expresión de la referencia | |||||||||||||
| Orthologs | |||||||||||||
| Especies | Humano | Ratón | |||||||||||
| Entrez | 3630 | 16334 | |||||||||||
| Ensembl | ENSG00000254647 | ENSMUSG00000000215 | |||||||||||
| UniProt | P01308 | P01326 | |||||||||||
| RefSeq (ARNm) | NM_000207 | NM_001185083 | |||||||||||
| RefSeq (proteína) | NP_000198 | NP_001172012 | |||||||||||
| Ubicación (UCSC) | Chr 11: 2.18 a 2.18 Mb | Chr 7: 142,68 a 142,7 Mb | |||||||||||
| PubMed búsqueda | |||||||||||||
La insulina es una hormona peptídica, producido por células beta del páncreas, y es fundamental para la regulación de los hidratos de carbono y metabolismo de la grasa en el cuerpo. La insulina hace que las células en el hígado, músculos esqueléticos, y tejido graso para absorber la glucosa de la sangre . En el hígado y los músculos esqueléticos, la glucosa se almacena como glucógeno, y en las células grasas ( adipocitos) se almacena como triglicéridos.
La insulina se detiene el uso de la grasa como fuente de energía mediante la inhibición de la liberación de glucagón. Con la excepción de la metabólica trastorno de la diabetes mellitus y síndrome metabólico, la insulina se proporciona dentro del cuerpo en una proporción constante para eliminar el exceso de glucosa de la sangre, que de otro modo sería tóxico. Cuando los niveles de glucosa en sangre caen por debajo de un cierto nivel, el cuerpo comienza a utilizar el azúcar almacenada como fuente de energía a través glucogenolisis, que descompone el glucógeno almacenado en el hígado y los músculos en glucosa, que puede entonces utilizarse como fuente de energía. Como un mecanismo central de control metabólico, su estado también se utiliza como una señal de control a otros sistemas corporales (tales como ácido amino captación por las células del cuerpo). Además, cuenta con varios otros efectos anabólicos en todo el cuerpo.
Cuando falla el control de los niveles de insulina, diabetes mellitus puede resultar. Como consecuencia, la insulina se utiliza médicamente para tratar algunas formas de diabetes mellitus. Los pacientes con diabetes tipo 1 dependen de la insulina externa (más comúnmente inyecta por vía subcutánea) para su supervivencia porque la hormona ya no se produce internamente. Los pacientes con diabetes tipo 2 son a menudo resistente y, a causa de tal resistencia a la insulina, puede sufrir de una deficiencia "relativo" insulina. Algunos pacientes con diabetes tipo 2 pueden eventualmente necesitar insulina si otros medicamentos no logran controlar adecuadamente los niveles de glucosa en la sangre. Más del 40% de las personas con diabetes tipo 2 necesitan insulina como parte de su plan de manejo de la diabetes.
La proteína de la insulina humana está compuesta de 51 aminoácidos , y tiene un peso molecular de 5808 Da. Es un dímero de una cadena A y una cadena B, que están unidos entre sí por enlaces disulfuro.
El nombre de la insulina se deriva del latín insula de "isla". Estructura de la insulina varía ligeramente entre especies de animales. La insulina de origen animal difiere un poco de la "fuerza" (en efectos de control del metabolismo de hidratos de carbono) en los seres humanos a causa de esas variaciones. Porcino insulina es especialmente cerca de la humana versión.
Gene
La preproinsulina precursor de la insulina es codificada por el INS gen.
Los alelos
Una variedad de mutante Se han identificado los alelos con cambios en la región de codificación. La gen lectura a través, INS-IGF2, se solapa con este gen a 'región y con el gen IGF2 en el 3' de la región 5.
Regulación
Varios secuencias reguladoras en el región promotora del gen de la insulina humana se unen a factores de transcripción. En general, la A-cajas se unen a Factores Pdx1, E-cajas se unen a NeuroD, C-cajas se unen a AFP, y elementos de respuesta a cAMP CREB. También hay silenciadores que inhiben la transcripción.
| Secuencia reguladora | encuadernación factores de transcripción |
|---|---|
| ILPR | Par1 |
| A5 | Pdx1 |
| elemento regulador negativo (NRE) | receptor de glucocorticoides, OCT1 |
| Z (superposición NRE y C2) | ISF |
| C2 | Pax4, MafA (?) |
| E2 | USF1 / USF2 |
| A3 | Pdx1 |
| CREB RE | - |
| CREB RE | CREB, CREM |
| A2 | - |
| Potenciador CAAT vinculante (CEB) (parcialmente solapada A2 y C1) | - |
| C1 | - |
| E1 | E2A, NeuroD1, HEB |
| A1 | Pdx1 |
| G1 | - |
Estructura de las proteínas
Dentro de los vertebrados, la secuencia de aminoácidos de la insulina es fuertemente conservada. bovina difiere de la insulina humana solamente en tres aminoácidos residuos, y porcino insulina en uno. Incluso insulina a partir de algunas especies de peces es similar suficiente para humano sea clínicamente eficaz en los seres humanos. La insulina en algunos invertebrados es bastante similar en secuencia a la insulina humana, y tiene efectos fisiológicos similares. La homología fuerte visto en la secuencia de la insulina de diversas especies sugiere que se ha conservado en gran parte de la historia evolutiva animal. El péptido C de proinsulina (discutido más adelante), sin embargo, difiere mucho más entre las especies; también es una hormona, pero uno secundario.
La estructura primaria de la insulina bovina se determinó por primera vez por Frederick Sanger en 1951. Después de eso, este polipéptido se sintetizó de forma independiente por varios grupos.
La insulina se produce y se almacena en el cuerpo como un hexámero (una unidad de seis moléculas de insulina), mientras que la forma activa es el monómero. El hexámero es una forma inactiva con estabilidad a largo plazo, que sirve como una forma de mantener la insulina altamente reactivo protegido, todavía fácilmente disponible. La conversión hexámero-monómero es uno de los aspectos centrales de las formulaciones de insulina para inyección. El hexámero es mucho más estable que el monómero, que es deseable por razones prácticas; Sin embargo, el monómero es un fármaco mucho más rápido de reacción debido a la velocidad de difusión está inversamente relacionada con el tamaño de partícula. Un medicamento de reacción rápida significa inyecciones de insulina no tienen que preceder las comidas por hora, que a su vez da diabéticos más flexibilidad en sus horarios diarios. La insulina puede agregarse y formar fibrilar interdigitada hojas beta. Esto puede causar la inyección amiloidosis, y evita el almacenamiento de la insulina durante largos períodos.
Síntesis, efectos fisiológicos, y la degradación
Síntesis
La insulina es producida en el páncreas y se libera cuando se detecta cualquiera de varios estímulos. Estos estímulos incluyen la proteína ingerida y la glucosa en la sangre producido a partir de los alimentos digeridos. Los hidratos de carbono pueden ser polímeros de azúcares simples o los propios azúcares simples. Si los hidratos de carbono incluyen glucosa, a continuación, que la glucosa se absorbe en el torrente sanguíneo y el nivel de glucosa en la sangre comenzará a subir. En las células diana, la insulina inicia una transducción de la señal, que tiene el efecto de aumentar la glucosa captación y almacenamiento. Por último, la insulina se degrada, terminando la respuesta.
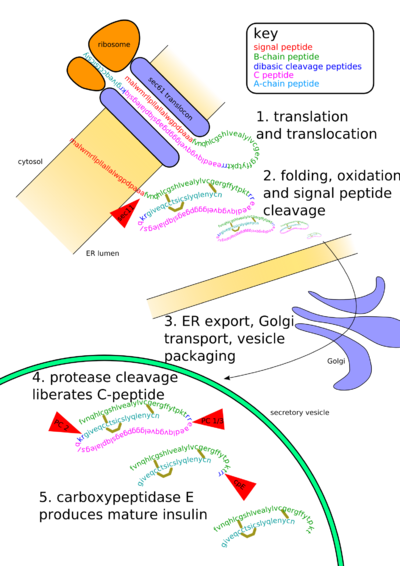
En los mamíferos, la insulina es sintetizada en el páncreas dentro de la β-células del islotes de Langerhans. Un millón a tres millones de islotes de Langerhans (islotes pancreáticos) forman el endocrino una parte del páncreas, que es ante todo un exocrina glándula. La porción endocrina representa sólo el 2% de la masa total del páncreas. Dentro de los islotes de Langerhans, las células beta constituyen 65-80% de todas las células.
La insulina consiste en dos cadenas polipeptídicas, la A- y B- cadenas, unidas entre sí por enlaces disulfuro. Sin embargo, está primero sintetiza como un único polipéptido llamado preproinsulina en páncreas β-células. Preproinsulina contiene un 24 residuos péptido señal que dirige la cadena de polipéptido naciente a la áspera retículo endoplásmico (RER). El péptido señal se escinde del polipéptido como se transloca en el lumen de la RER, formando proinsulina. En el RER la proinsulina se pliega en la conformación correcta y 3 enlaces disulfuro se forman. Acerca de 5-10 minutos después de su montaje en el retículo endoplásmico, la proinsulina es transportado a la red trans-Golgi (TGN), donde se forman gránulos inmaduros. Transporte al TGN puede tardar unos 30 minutos.
La proinsulina se somete a maduración en insulina activa a través de la acción de endopeptidasas celular conocido como convertasas prohormonas ( PC1 y PC2), así como la exoproteasa carboxipeptidasa E. El endopeptidasas escinden en 2 posiciones, liberando un fragmento llamado C-péptido, y dejando 2 cadenas peptídicas, las cadenas B y A-, unidas por 2 puentes disulfuro. Los sitios de escisión son cada uno situado después de un par de residuos básicos (lisina-arginina-64 y 65, y arginina-31 y -32), y después de la escisión estos 2 pares de residuos básicos se eliminan por la carboxipeptidasa. La C-péptido es la porción central de la proinsulina, y la secuencia primaria de la proinsulina va en el orden "BCA" (el cadenas B y A se identificaron sobre la base de la masa y el péptido C se descubrió más tarde).
La insulina madura resultante se envasa dentro de gránulos maduros en espera de señales metabólicas (tales como leucina, arginina, glucosa y manosa) y la estimulación del nervio vago para ser exocitado partir de la célula en la circulación.
La producción endógena de insulina está regulada en varias etapas a lo largo de la vía de síntesis:
- En la transcripción del gen de la insulina
- En la estabilidad del mRNA
- En el la traducción del ARNm
- En el modificaciones postraduccionales
La insulina y sus proteínas relacionadas han demostrado ser producido dentro del cerebro, y la reducción de los niveles de estas proteínas están ligados a la enfermedad de Alzheimer.
Liberación
Las células beta en el islotes de Langerhans liberación de insulina en dos fases. La primera fase de liberación se activa rápidamente en respuesta a un aumento de los niveles de glucosa en sangre. La segunda fase es una liberación sostenida y lenta de vesículas recién formadas desencadenados independientemente de azúcar. La descripción de la primera fase de liberación es el siguiente:
- La glucosa entra en las células β a través de la transportador de glucosa, GLUT2.
- La glucosa entra en la glucólisis y el ciclo respiratorio, donde múltiples, de alta energía ATP moléculas se producen por oxidación, lo que lleva a un aumento en la relación ATP: ADP dentro de la célula.
- Un aumento de la ATP intracelular: ADP cierra la SUR1 sensibles a ATP / Kir6.2 canal de potasio (ver receptor de sulfonilurea). Esto evita que los iones de potasio (K +) salir de la célula por difusión facilitada, lo que lleva a una acumulación de iones de potasio. Como resultado, el interior de la célula se hace más positiva con respecto al exterior, que conduce a la despolarización de la membrana de la superficie celular.
- En despolarización, cerrada por voltaje iones de calcio (Ca2 +) canales abiertos que permite a los iones de calcio se trasladen a las células por difusión facilitada.
- Un aumento de la concentración de ion de calcio intracelular provoca la activación de fosfolipasa C, que escinde el fosfolípido de membrana fosfatidil inositol 4,5-bifosfato en inositol 1,4,5-trifosfato y diacilglicerol.
- El inositol 1,4,5-trifosfato (IP3) se une a las proteínas del receptor en la membrana plasmática de la retículo endoplasmático (ER). Esto permite la liberación de iones Ca2 + desde el RE a través de los canales dependientes de IP3, y además aumenta la concentración intracelular de iones calcio.
- Significativamente mayores cantidades de iones de calcio en las células provoca la liberación de insulina previamente sintetizada, que ha sido almacenada en secretor vesículas.
Este es el mecanismo principal para la liberación de la insulina. Otras sustancias conocidas para estimular la liberación de insulina incluyen los aminoácidos arginina y leucina, la liberación de parasimpático acetilcolina (a través de la fosfolipasa C), sulfonilurea, colecistoquinina (CCK, a través de la fosfolipasa C), y el derivado gastrointestinalmente incretinas péptido similar al glucagón-1 (GLP-1) y insulinotrópico dependiente de glucosa péptido (GIP).
La liberación de la insulina está fuertemente inhibida por la hormona del estrés norepinefrina (noradrenalina), lo que conduce a un aumento de los niveles de glucosa en sangre durante el estrés. Parece que la liberación de catecolaminas por el sistema nervioso simpático tiene influencias contradictorias sobre la liberación de insulina por las células beta, ya que la liberación de insulina se inhibe por la α 2-adrenérgicos y estimulado por β 2-adrenérgicos. El efecto neto de norepinefrina de los nervios simpáticos y adrenalina de las glándulas suprarrenales en la liberación de insulina es la inhibición debido a la dominación de los receptores α-adrenérgicos.
Cuando el nivel de glucosa se reduce al valor fisiológico habitual, liberación de insulina por las células β disminuye o detiene. Si los niveles de glucosa en la sangre caen por debajo de este, especialmente a niveles peligrosamente bajos, liberación de hormonas de hiperglucemia (lo más prominente glucagón de las células alfa de los islotes de Langerhans) fuerza liberación de glucosa en la sangre de las tiendas de celulares, principalmente tiendas de células hepáticas de glucógeno. Al aumentar la glucosa en sangre, las hormonas hiperglucémicas prevenir o corregir la hipoglucemia potencialmente mortal.
La evidencia de alteración de la liberación de insulina de primera fase se puede ver en la prueba de tolerancia a la glucosa, lo demuestra un nivel de glucosa en sangre elevado sustancialmente a los 30 minutos, un marcado descenso en 60 minutos, y una subida constante de nuevo a los niveles de referencia en los siguientes puntos de tiempo por hora.
Oscilaciones

Incluso durante la digestión, en general, una o dos horas después de una comida, la liberación de insulina desde el páncreas no es continua, pero oscila con un período de 3-6 minutos, el cambio de la generación de una concentración de insulina en sangre más de aproximadamente 800 p mol / l a menos de 100 pmol / l. Esto se pensó para evitar regulación a la baja de los receptores de insulina en las células diana, y para ayudar al hígado en la extracción de la insulina de la sangre. Esta oscilación es importante tener en cuenta cuando se administre la medicación estimulante de la insulina, ya que es la concentración en sangre de oscilación de la liberación de insulina, lo que debería, idealmente, ser alcanzado, no una alta concentración constante. Esto puede lograrse mediante la entrega de insulina rítmicamente a la vena porta o por el trasplante de células de los islotes en el hígado. Bombas de insulina futuros esperan para abordar esta característica. (Ver también La insulina pulsátil.)
Contenido de sangre

El contenido de sangre de la insulina se puede medir en unidades internacionales, como uUI / ml o en concentración molar, tales como pmol / L, donde 1 uUI / ml es igual a 6.945 pmol / L. Un nivel en sangre entre las comidas es típica 8-11 uUI / mL (57-79 pmol / L).
Transducción de señales
Proteínas transportadoras especiales en las membranas celulares permiten la glucosa de la sangre para entrar en una célula. Estos transportadores son, indirectamente, bajo el control de la insulina en la sangre en ciertos tipos de células del cuerpo (por ejemplo, células musculares). Los bajos niveles de insulina circulante, o su ausencia, evitarán que la glucosa entre en las células (por ejemplo, en la diabetes tipo 1). Más comúnmente, sin embargo, hay una disminución en la sensibilidad de las células a la insulina (por ejemplo, la reducción de la sensibilidad a la insulina característica de la diabetes tipo 2), resultando en la absorción de glucosa disminuido. En cualquier caso, hay 'inanición celular' y pérdida de peso, a veces extremo. En unos pocos casos, hay un defecto en la liberación de insulina del páncreas. De cualquier manera, el efecto es el mismo: niveles elevados de glucosa en sangre.
La activación de receptores de insulina conduce a mecanismos celulares internas que afectan directamente a la captación de glucosa por la regulación del número y la operación de moléculas de proteína en la membrana celular de transporte que la glucosa en la célula. Los genes que especifican las proteínas que componen el receptor de la insulina en las membranas celulares han sido identificados, y las estructuras del interior, la sección de transmembrana, y la sección adicional de membrana de receptor se han resuelto.
Dos tipos de tejidos son más fuertemente influenciadas por la insulina, por lo que la estimulación de la captación de glucosa se refiere a: células musculares ( miocitos) y las células grasas ( adipocitos). Los primeros son importantes debido a su papel central en el movimiento, la respiración, la circulación, etc., y el segundo porque se acumulan exceso de energía de los alimentos en contra de las necesidades futuras. En conjunto, representan alrededor de dos tercios de todas las células de un cuerpo humano típico.
La insulina se une a la porción extracelular de las subunidades alfa del receptor de insulina. Esto, a su vez, provoca un cambio conformacional en el receptor de la insulina que activa el dominio quinasa que reside en la porción intracelular de las subunidades beta. El dominio quinasa activada autophosphorylates residuos de tirosina en el C-terminal del receptor, así como residuos de tirosina en el IRS-1 proteína.
- fosforilada IRS-1, a su vez, se une y activa fosfoinositol 3 quinasa ( PI3K)
- PI3K cataliza la reacción PIP2 + ATP → PIP3 + ADP
- PIP3 activa la proteína quinasa B ( PKB)
- PKB fosforila la glucógeno sintasa quinasa ( GSK) y de ese modo inactiva la GSK
- GSK ya no puede fosforilar la glucógeno sintasa ( GS)
- unphosphorylated GS hace más glucógeno
- PKB también facilita la fusión de vesículas, lo que resulta en un aumento de transportadores GLUT4 en la membrana plasmática
Después de que se ha producido la señal, entonces se necesita terminación de señalización. Como se menciona más adelante en la sección sobre la degradación, la endocitosis y la degradación del receptor unido a la insulina es un mecanismo principal para poner fin a la señalización. Además, la señalización puede ser terminado por la desfosforilación de los restos de tirosina por tirosina fosfatasas. Serina / treonina quinasas también son conocidos para reducir la actividad de la insulina. Finalmente, con acción de la insulina está asociada con el número de receptores en la membrana plasmática, una disminución en la cantidad de receptores también conduce a la terminación de la señalización de la insulina.
La estructura de la insulina complejo receptor de la insulina se ha determinado utilizando las técnicas de Cristalografía de rayos X.
Efectos fisiológicos
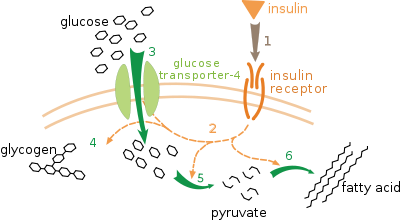
Las acciones de la insulina en el metabolismo humano nivel global incluyen:
- Control de la ingesta celular de ciertas sustancias, glucosa más prominente en el músculo y el tejido adiposo (aproximadamente dos tercios de las células del cuerpo)
- Aumento de Replicación del ADN y la síntesis de proteínas a través del control de la absorción de aminoácidos
- Modificación de la actividad de numerosas enzimas.
Las acciones de la insulina (directos e indirectos) en las células incluyen:
- El aumento de la síntesis de glucógeno - fuerzas de insulina de almacenamiento de la glucosa en las células en forma de glucógeno en el hígado (y músculo); niveles bajos de insulina causa células hepáticas para convertir el glucógeno en glucosa y excretar en la sangre. Esta es la acción clínica de la insulina, que es directamente útil en la reducción de los niveles de glucosa en la sangre como en la diabetes.
- El aumento de la síntesis de lípidos - Las fuerzas de insulina las células de grasa para tomar en los lípidos sanguíneos, que se convierten en triglicéridos; falta de insulina hace a la inversa.
- Aumentado esterificación de ácidos grasos - Las fuerzas de tejido adiposo para hacer grasas (es decir, triglicéridos) a partir de ésteres de ácidos grasos; falta de insulina hace a la inversa.
- Disminución proteólisis - la disminución de la descomposición de las proteínas
- Disminución reducción de fuerzas en la conversión de reservas de lípidos de células grasas en ácidos grasos en la sangre - lipólisis; falta de insulina hace a la inversa.
- Disminución gluconeogénesis - disminuye la producción de glucosa a partir de sustratos no azucareros, principalmente en el hígado (la gran mayoría de la insulina endógena llegar al hígado nunca abandona el hígado); falta de insulina hace que la producción de glucosa a partir de sustratos variados en el hígado y en otros lugares.
- Disminución autofagia - nivel de degradación de los orgánulos dañados disminuido. Niveles postprandiales inhiben la autofagia completamente.
- El aumento de la absorción de aminoácidos - fuerza a las células a absorber aminoácidos circulantes; falta de insulina inhibe la absorción.
- Aumento de la captación de potasio - fuerza a las células a absorber el potasio sérico; falta de insulina inhibe la absorción. Aumento de la insulina en la captación de potasio celular disminuye los niveles de potasio en sangre. Esto posiblemente produce a través de la translocación inducida por insulina de la Na + / K + -ATPasa a la superficie de las células del músculo esquelético.
- Tono muscular Arterial - fuerzas músculo de la pared arterial se relajen, lo que aumenta el flujo sanguíneo, especialmente en microarteries; la falta de insulina reduce el flujo al permitir que estos músculos se contraigan.
- Aumento de la secreción de ácido clorhídrico por las células parietales en el estómago
- Disminución de la excreción renal de sodio.
La insulina también influye en otras funciones corporales, tales como distensibilidad vascular y cognición. Una vez que la insulina entra en el cerebro humano, se mejora el aprendizaje y la memoria y beneficia la memoria verbal en particular. Mejora de cerebro de señalización de insulina por medio de la administración de insulina intranasal también mejora la termorregulación y la respuesta aguda glucorregulador a la ingesta de alimentos, lo que sugiere que la insulina nervioso central contribuye al control de la energía de todo el cuerpo homeostasis en los seres humanos.
Degradación
Una vez que una molécula de insulina se ha acoplado sobre el receptor y efectuado su acción, puede ser liberado de nuevo en el medio extracelular, o puede ser degradado por la célula. Los dos sitios primarios para el despacho de la insulina son el hígado y el riñón. El hígado elimina la mayor parte de la insulina durante el tránsito de primer paso, mientras que el riñón despeja la mayor parte de la insulina en la circulación sistémica. La degradación implica normalmente endocitosis del complejo insulina-receptor, seguido por la acción de degradadora de insulina enzima. Una molécula de insulina producida endógenamente por las células beta del páncreas se estima que se degrade en aproximadamente una hora después de su lanzamiento inicial en circulación (insulina vida media de ~ 4-6 minutos).
Hipoglucemia
Aunque otras células pueden utilizar otros combustibles (ácidos grasos más prominente), neuronas dependen de la glucosa como fuente de energía en el ser humano nonstarving. Ellos no necesitan insulina para absorber la glucosa, a diferencia de músculo y tejido adiposo, y tienen muy pequeños almacenes internos de glucógeno. El glucógeno almacenado en las células hepáticas (a diferencia de glucógeno almacenado en las células musculares) se puede convertir en glucosa, y se libera en la sangre, cuando la glucosa de la digestión es baja o ausente, y el esqueleto de glicerol de los triglicéridos también se puede utilizar para producir glucosa en sangre.
Suficiente falta de glucosa y la escasez de estas fuentes de glucosa puede hacer de manera espectacular en sí manifiesta en el deterioro del funcionamiento de la sistema central nervioso: mareos, problemas del habla, e incluso la pérdida de la conciencia. Bajo nivel de glucosa en sangre se conoce como hipoglucemia o, en los casos que producen pérdida del conocimiento, "coma hipoglucémico" (a veces llamado "choque de insulina" en el agente causal más común). Causas endógenas de exceso de insulina (tales como una insulinoma) son muy raros, y la inmensa mayoría de los casos de hipoglucemia inducida por el exceso de insulina son iatrogénica y por lo general accidental. Unos pocos casos de asesinato, intento de asesinato o suicidio mediante sobredosis de insulina han sido reportados, pero la mayoría de los choques de insulina parece ser debido a errores en la dosis de insulina (por ejemplo, 20 unidades en lugar de 2) u otros factores imprevistos (no comen como tanto como prevén, o ejercitarse más de lo esperado, o cinética imprevistos de la vía subcutánea inyectan insulina en sí).
Las posibles causas de la hipoglucemia incluyen:
- Insulina externa (vía subcutánea usualmente inyectada)
- Agentes hipoglucémicos orales (por ejemplo, cualquiera de las sulfonilureas, o medicamentos similares, que aumentan la liberación de insulina a partir de β-células en respuesta a un nivel de glucosa en sangre en particular)
- La ingestión de sustitutos del azúcar baja en hidratos de carbono en las personas sin diabetes o con diabetes tipo 2. Los estudios en animales muestran estos pueden desencadenar la liberación de insulina, aunque en cantidades mucho más pequeñas que el azúcar, según un informe publicado en la revista Discover, agosto de 2004, p 18. (Esto nunca puede ser una causa de la hipoglucemia en pacientes con diabetes tipo 1, ya que no es no hay producción de insulina endógena para estimular).
Enfermedades y síndromes
Hay varias condiciones en las que la insulina es la perturbación patológica:
- Diabetes mellitus - término general que se refiere a todos los estados caracteriza por hiperglucemia
- Tipo 1 - destrucción autoinmune mediada por β-células productoras de insulina en el páncreas, lo que resulta en la deficiencia absoluta de insulina
- Tipo 2 - síndrome multifactorial con influencia combinada de la susceptibilidad genética y la influencia de los factores ambientales, el ser más conocido la obesidad, la edad y la inactividad física, lo que resulta en resistencia a la insulina en las células que requieren insulina para la absorción de la glucosa. Esta forma de diabetes está fuertemente heredada.
- Otros tipos de tolerancia a la glucosa (ver la Diabetes )
- Insulinoma - un tumor de β-células pancreáticas productoras de insulina en exceso o hipoglucemia reactiva.
- El síndrome metabólico - una enfermedad poco entendida primera llamada Síndrome X por Gerald Reaven, el síndrome de Reaven después de Reaven, CHAOS en Australia (de los signos que parecen viajar juntos). En la actualidad no está claro si estos signos tienen una única causa tratable, o son el resultado de cambios en el cuerpo que conducen a la diabetes tipo 2. Se caracteriza por la elevada presión arterial, dislipemia (alteración en las formas de colesterol en sangre y otros lípidos en la sangre), y el aumento de la circunferencia de la cintura (al menos en las poblaciones en gran parte del mundo desarrollado). La causa subyacente de base puede ser la resistencia a la insulina que precede a la diabetes tipo 2, que es una disminución de la capacidad de respuesta de la insulina en algunos tejidos (por ejemplo, músculo, grasa). Es común que las morbilidades, tales como esencial la hipertensión , obesidad, diabetes tipo 2, y las enfermedades cardiovasculares (ECV) desarrollar.
- El síndrome de ovario poliquístico - un síndrome complejo en las mujeres en edad reproductiva en su anovulación y exceso de andrógenos se muestran comúnmente como hirsutismo. En muchos casos de síndrome de ovario poliquístico, resistencia a la insulina está presente.
Como un medicamento

Biosintética insulina "humana" está fabricado para su uso clínico generalizado el uso de la tecnología del ADN recombinante. Más recientemente, los investigadores han tenido éxito en la introducción del gen de la insulina humana en las plantas y en la producción de insulina en ellos, para ser específicos de cártamo . Se prevé que esta técnica para reducir los costes de producción.
Varias de estas versiones modificadas de la insulina humana, si bien tienen un efecto clínico sobre los niveles de glucosa en la sangre, como si fueran copias exactas, han sido diseñados para tener algo diferente absorción o la duración de las características de acción. Ellos se refieren generalmente como "análogos de la insulina". Por ejemplo, la disponible primero, Humalog (insulina lispro), no presenta un efecto de absorción retardada que se encuentra en la insulina regular, y comienza a tener un efecto en tan sólo 15 minutos. Otros análogos de acción rápida son NovoRapid y Apidra, con perfiles similares. Todos son absorbidos rápidamente debido a una mutación en la secuencia que evita que el análogo de la insulina a partir de la formación de dímeros y hexámeros. En lugar de ello, la molécula de insulina es un monómero, que se absorbe más rápidamente. Gracias a él, por lo tanto, no requiere la planificación necesaria para otras insulinas que comienzan a surtir efecto mucho más tarde (hasta muchas horas) después de la administración. Otro tipo es la insulina de liberación prolongada; el primero de ellos fue Lantus (insulina glargina). Estos tienen un efecto constante durante todo el tiempo que están activos, sin el pico y regreso a su efecto en otras insulinas; Típicamente, continúan teniendo un efecto de insulina durante un período prolongado de 18 a 24 horas. Asimismo, otro análogo de insulina prolongada ( Levemir) se basa en un enfoque de acilación de ácido graso. Una molécula de ácido myristyric se adjunta a este análogo, que a su vez se asocia la molécula de insulina a la albúmina de suero abundante, que a su vez se extiende el efecto y reduce el riesgo de hipoglucemia. Ambos análogos prolongados deben tomarse sólo una vez al día, y se utilizan mucho en el mercado de la diabetes tipo 1 como la insulina basal. Una combinación de una acción rápida y una insulina prolongada también está disponible para los pacientes, haciendo más probable para ellos para lograr un perfil de insulina que imita a la de los bodys propia liberación de insulina.
La insulina se toma generalmente como subcutáneo inyecciones de un solo uso jeringas con agujas, a través de una bomba de insulina, o por el uso repetido plumas de insulina con agujas.
A diferencia de muchos medicamentos, insulina Actualmente no se puede tomar por vía oral porque, como casi todas las otras proteínas introducidas en el tracto gastrointestinal, que se reduce a fragmentos (incluso los componentes de aminoácidos individuales), después de lo cual se pierde toda la actividad. Ha habido algunas investigaciones en formas de proteger la insulina en el tracto digestivo, por lo que se puede administrar por vía oral o sublingual. Si bien experimental, varias compañías ahora tienen diversas formulaciones en los ensayos clínicos en humanos.
Historia
Descubrimiento
En 1869 Paul Langerhans, un estudiante de medicina en Berlín , estaba estudiando la estructura de los páncreas bajo un microscopio cuando identificó algunos grumos de tejido previamente inadvertidas esparcidos por la mayor parte del páncreas. La función de los "pequeños montones de células", más tarde conocidos como los islotes de Langerhans , era desconocido, pero Edouard Laguesse más tarde sugirió que podrían producir secreciones que juegan un papel regulador en la digestión. Hijo Paul Langerhans, Archibald, también ayudó a entender este papel regulador. El término "insulina" se origina en la ínsula , la palabra latina para islote / isla.
En 1889, el polaco-alemana médico Oscar Minkowski, en colaboración con Joseph von Mering, retiró el páncreas de un perro sano para probar su papel asumido en la digestión. Varios días después se retiró el páncreas del perro, cuidador de animales de Minkowski se dio cuenta de un enjambre de moscas que se alimentan de la orina del perro. En análisis de la orina, encontraron que había azúcar en la orina del perro, que se establece por primera vez una relación entre el páncreas y la diabetes. En 1901, otro paso importante fue tomada por Eugene Opie, cuando claramente establecido el vínculo entre los islotes de Langerhans y la diabetes: "La diabetes mellitus es causada por la destrucción de los islotes de Langerhans y ocurre solamente cuando estos cuerpos son en parte... o totalmente destruido ". Antes de su trabajo, el vínculo entre el páncreas y la diabetes era claro, pero no el papel específico de los islotes.
Durante las próximas dos décadas, se hicieron varios intentos para aislar lo que fuera los islotes producidos como tratamiento potencial. En 1906, George Ludwig Zuelzer era perros tratan parcialmente exitosas con extracto de páncreas, pero no pudo continuar su obra. Entre 1911 y 1912, EL Scott en la Universidad de Chicago utiliza extractos pancreáticos acuosas, y señaló "una ligera disminución de la glucosuria", pero no fue capaz de convencer a su director del valor de su trabajo; que fue cerrado. Israel Kleiner demostró efectos similares en la Universidad Rockefeller en 1915, pero su trabajo fue interrumpido por la Primera Guerra Mundial , y él no volvió a ella.
En 1916 Nicolae Paulescu, un profesor rumano de fisiología en la Universidad de Medicina y Farmacia en Bucarest, desarrolló una acuosa de extracto de páncreas que, cuando se inyecta en un diabético perro, tenía un efecto normalizador en los niveles de azúcar en la sangre. Él tuvo que interrumpir sus experimentos a causa de la Primera Guerra Mundial , y en 1921 escribió cuatro artículos sobre su trabajo realizado en Bucarest y sus pruebas en un perro diabético. Más tarde ese mismo año, publicó "La investigación sobre el papel del páncreas en los alimentos de asimilación ".
Extracción y purificación
En octubre de 1920, canadiense Frederick Banting estaba leyendo uno de los papeles de Minkowski y concluyó que se trataba de las secreciones muy digestivas que Minkowski había estudiado originalmente que estaban derribando la secreción (s) de los islotes, lo que hace imposible para extraer con éxito. Él anotó una nota a sí mismo: ". Se ligan los conductos pancreáticos del perro Mantenga perros vivos hasta degenerada acinos dejando islotes Trate de aislar la secreción interna de éstos y aliviar glycosurea.".
La idea era la secreción interna del páncreas, que, se suponía, regula el azúcar en la sangre, podría ser la clave para el tratamiento de la diabetes. Un cirujano de profesión, Banting sabía ciertas arterias podrían atan que daría lugar a la atrofia de la mayor parte del páncreas, dejando los islotes de Langerhans intacta. Él teorizó un extracto relativamente puro podría hacerse a partir de los islotes vez la mayor parte del resto de páncreas se había ido.
En la primavera de 1921, Banting viajó a Toronto para explicar su idea de JJR Macleod, quien era profesor de Fisiología de la Universidad de Toronto, y pidió Macleod si podía usar su espacio de laboratorio para probar la idea. Macleod era escéptico, pero finalmente accedió a que Banting usar su espacio en el laboratorio mientras estaba de vacaciones durante el verano. También suministra Banting con diez perros en el que experimentar, y dos estudiantes de medicina, Charles Best y Clark Noble, para su uso como ayudantes de laboratorio, antes de partir hacia Escocia. Desde Banting requiere sólo un ayudante de laboratorio, Best y Noble volteado una moneda para ver que ayudaría Banting para la primera mitad del verano. Mejor ganó el lanzamiento de la moneda, y tomó el primer turno como ayudante de Banting. Pérdida del lanzamiento de la moneda puede haber demostrado desafortunado para Noble, ya que Banting decidió mantener mejor para todo el verano, y con el tiempo compartido la mitad de su dinero del Premio Nobel y una gran parte del crédito por el descubrimiento de la insulina con el ganador del sorteo . Tenía Noble ganó el sorteo, su carrera podría haber tomado un camino diferente. El método de Banting era atar una ligadura alrededor del conducto pancreático; cuando se examinan varias semanas después, las células pancreáticas digestivas habían muerto y sido absorbidos por el sistema inmune, dejando a miles de islotes. Luego aislaron un extracto de estos islotes, produciendo lo que llamaron "isletin" (lo que hoy conocemos como la insulina), y probado este extracto en los perros a partir 27 de julio Banting y Best fueron capaces de mantener a un perro llamado pancreatectomizados Marjorie vivo para el resto del verano por su inyección con el extracto crudo que habían preparado. La eliminación del páncreas en animales de prueba en esencia imita diabetes, que conduce a niveles elevados de glucosa en sangre. Marjorie fue capaz de seguir con vida, porque los extractos, que contiene isletin, fueron capaces de reducir sus niveles de glucosa en sangre.
Banting y Best presentaron sus resultados a Macleod en su regreso a Toronto en el otoño de 1921, pero Macleod señalaron fallas en el diseño experimental, y sugirieron los experimentos se repita con más perros y mejor equipamiento. Luego suministra Banting y Best con un mejor laboratorio y comenzó a pagar Banting un salario de sus becas de investigación. Varias semanas más tarde, la segunda ronda de experimentos fue también un éxito; y Macleod ayudó a publicar sus resultados de forma privada en Toronto que noviembre. Sin embargo, necesitaron seis semanas para extraer el isletin, lo que obligó a los retrasos considerables. Banting sugirió que tratan de usar el páncreas fetal de ternera, que aún no se había desarrollado glándulas digestivas; él se sintió aliviado al encontrar este método ha funcionado bien. Con el problema de suministro resuelto, el siguiente gran esfuerzo era para purificar el extracto. En diciembre de 1921, Macleod invitó al bioquímico James Collip para ayudar con esta tarea, y, dentro de un mes, el equipo se sentía listo para una prueba clínica.
El 11 de enero de 1922, Leonard Thompson, un diabético de 14 años de edad, quien yacía moribundo en el Hospital General de Toronto, se le dio la primera inyección de insulina. Sin embargo, el extracto fue tan impuro, Thompson sufrió una severa reacción alérgica, y más inyecciones fueron cancelados. Durante los próximos 12 días, Collip trabajó día y noche para mejorar el extracto de buey páncreas, y una segunda dosis se inyectó el 23 de enero Este fue un éxito completo, no sólo en que no tiene efectos secundarios obvios sino también en eliminar completamente los glucosuria signo de diabetes. El primer paciente americano era Elizabeth Hughes Gossett, la hija del gobernador de Nueva York. El primer paciente tratado en los EE.UU. fue grabado en madera futuro artista James D. Havens; Dr. John Ralston Williams importado insulina de Toronto a Rochester, Nueva York, para tratar Havens.
Los niños que mueren de cetoacidosis diabética se guardaban en grandes salas, a menudo con 50 o más pacientes en una sala, en su mayoría en estado de coma. Afligidos miembros de la familia fueron a menudo en la asistencia, a la espera de la (hasta entonces, inevitable) la muerte.
En uno de los momentos más dramáticos de la medicina, Banting, Best, y Collip iba de cama en cama, la inyección de un barrio entero con el nuevo extracto purificado. Antes de que hubieran llegado al último hijo moribundo, la primera pocos fueron despertando de su coma, a las exclamaciones de júbilo de sus familias.
Banting y Best nunca funcionaron bien con Collip, considerarlo como algo de un intruso, y Collip abandonaron el proyecto poco después.
Durante la primavera de 1922, Best logró mejorar sus técnicas hasta el punto donde grandes cantidades de insulina podrían ser extraídos de la demanda, pero la preparación quedó impuro. La firma de medicamentos Eli Lilly and Company había ofrecido asistencia no mucho después de las primeras publicaciones en 1921, y se llevaron a Lilly en la oferta en abril. En noviembre, Lilly hizo un gran avance, y fue capaz de producir grandes cantidades de insulina altamente refinado. La insulina se ofrece a la venta poco después.
Síntesis
La insulina de origen animal purificada fue el único tipo de insulina disponible para los diabéticos hasta que los avances genéticos se produjeron más tarde con la investigación médica. La estructura de aminoácidos de la insulina se caracterizó a principios del 1950 por Frederick Sanger , y la primera insulina sintética se produjo simultáneamente en los laboratorios de Panayotis Katsoyannis en la Universidad de Pittsburgh y Helmut Zahn en la Universidad RWTH de Aachen en la década de 1960.
El primero de ingeniería genética, la insulina sintética "humano" fue producida en un laboratorio en 1977 por Arthur Riggs, PhD, Keiichi Itakura, PhD, y Herbert Boyer usando E. Coli. Asociarse con Genentech, fundada por Swanson, Boyer y Eli Lilly and Company continuó en 1982 para vender la primera insulina humana biosintética disponible comercialmente bajo el nombre de marca Humulin. La gran mayoría de la insulina utilizada actualmente en todo el mundo es ahora insulina biosintética recombinante "humano" o sus análogos.
Se produce la insulina recombinante, ya sea en la levadura (normalmente Saccharomyces cerevisiae ) o E. coli . En la levadura, la insulina puede ser diseñada como una proteína de una sola cadena con una endoproteasa KexII (un homólogo de levadura de / PCII PCI) sitio que separa la insulina Una cadena de una cadena c-terminal truncado B de insulina. Una cola C-terminal sintetizado químicamente se injerta a continuación, en la insulina por proteolisis inversa usando la proteasa tripsina barato; Típicamente, la lisina en la cola C-terminal está protegido con un grupo protector químico para evitar la proteolisis. La facilidad de síntesis modular y la relativa seguridad de la modificación de que las cuentas de la región para los análogos de insulina comunes con modificaciones c-terminal (por ejemplo, lispro, aspart, glulisina). La síntesis y la síntesis de Genentech completamente químico tal como que por Bruce Merrifield no se prefieren debido a que la eficiencia de la recombinación de las dos cadenas de insulina es baja, principalmente debido a la competencia con la precipitación de la cadena B de insulina.
Premios Nobel

La Comité del Premio Nobel en 1923 acredita la extracción práctica de insulina para un equipo de la Universidad de Toronto y recibió el Premio Nobel a dos hombres: Frederick Banting y JJR Macleod. Ellos fueron galardonados con el Premio Nobel de Fisiología o Medicina en 1923 por el descubrimiento de la insulina. Banting, insultó a que Best no fue mencionado, compartió su premio con él, y Macleod compartió inmediatamente suyo con James Collip. La patente de la insulina fue vendida a la Universidad de Toronto por un medio de dólares.
La estructura primaria de la insulina se determinó por el biólogo molecular británico Frederick Sanger . Era la primera proteína de tener determinado su secuencia. Fue galardonado con el 1958 Premio Nobel de Química por este trabajo.
En 1969, después de décadas de trabajo, Dorothy Hodgkin determinó la conformación espacial de la molécula, la denominada estructura terciaria, por medio de estudios de difracción de rayos-X. Ella había sido galardonado con el Premio Nobel de Química en 1964 para el desarrollo de la cristalografía.
Rosalyn Yalow recibió el Premio Nobel 1977 de Medicina por el desarrollo delradioinmunoensayo de insulina.
George Minot, co-ganador del Premio Nobel de 1934 para el desarrollo del primer tratamiento eficaz parala anemia perniciosa, teníadiabetes mellitus. Dr. William Castillo observó que el 1921 descubrimiento de la insulina, llegando a tiempo para mantener viva Minot, por lo tanto, fue también responsable de el descubrimiento de una cura para laanemia perniciosa.
Premio Nobel de la controversia

El trabajo publicado por Banting, Best, Collip y Macleod representó a la preparación del extracto de la insulina purificada adecuada para su uso en pacientes humanos. Aunque Paulescu descubrió los principios del tratamiento de su extracto de solución salina no podía ser utilizado en seres humanos, y no se menciona en el Premio Nobel de 1923. El profesor Ian Murray fue particularmente activo en el trabajo de corregir "el error histórico" contra Nicolae Paulescu. Murray fue profesor de fisiología en la Facultad de Medicina de Anderson en Glasgow , Escocia , el jefe del departamento de Enfermedades Metabólicas a un líder del hospital de Glasgow, vice-presidente de la Asociación Británica de Diabetes, y miembro fundador de la Federación Internacional de Diabetes . Murray escribió:
"Insuficiente reconocimiento se ha dado a Paulesco, el distinguidorumanacientífico, que en el momento en que el equipo de Toronto fueron comenzando sus investigaciones ya habían tenido éxito en la extracción de la hormona antidiabética del páncreas y demostrando su eficacia en la reducción de la hiperglucemia en los perros diabéticos."
En una comunicación privada reciente ProfesorTiselius, director del Instituto Nobel, ha expresado su opinión personal de queNicolae Paulescu era igualmente digna del premio en 1923.

