Amine
Renseignements généraux
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille près de la charité. Lire la suite ...

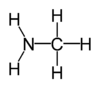
Les amines sont des composés organiques et des groupes fonctionnels qui contiennent un de base azote atome avec un seule paire. Les amines sont les dérivés de l'ammoniac , dans lequel un ou plusieurs hydrogènes sont remplacés par des atomes organique des substituants tels que alkyle et des groupes aryle. Composés avec l'atome d'azote un côté de carbonyle de la structure RC (= O) NR 2 sont appelés amides et ont des propriétés chimiques différentes. Amines importants comprennent les acides aminés , amines biogènes, triméthylamine (poisson odeur), et aniline; voir Catégorie: Amines pour une liste d'amines.
Introduction
Amines aliphatiques
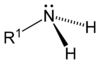
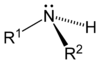
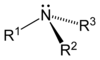
Comme le montre dans les images ci-dessous, les amines primaires survenir lorsque l'un des trois atomes d'hydrogène dans de l'ammoniac est remplacé par un substituant organique. Les amines secondaires ont deux substituants organiques liés à N avec un H. Dans amines tertiaires trois atomes d'hydrogène sont remplacés par organique substituants. Il est également possible d'avoir quatre substituants alkyle sur l'atome d'azote. Ces composés ont un centre d'azote chargé, et sont nécessairement avec un contre-ion négatif, de sorte qu'ils sont appelés quaternaire les sels d'ammonium.
| Amine primaire | Amine secondaire | Amine tertiaire |
|---|---|---|
 |  |  |
De même, un composé organique avec de multiples groupes amino est appelé une diamine, triamine, tétraamine et ainsi de suite.
Amines aromatiques
Les amines aromatiques sont l'atome d'azote relié à un cycle aromatique comme dans anilines. Le cycle aromatique diminue fortement la basicité de l'aminé, en fonction de ses substituants. Chose intéressante, la présence d'un groupe amine augmente fortement la réactivité du cycle aromatique, due à un effet donneur d'électrons. Une réaction organique comportant des amines aromatiques est le Réaction Goldberg.
Conventions de nommage
- le préfixe "N" indique la substitution sur l'atome d'azote
- comme préfixe: "amino"
- comme suffixe: "amine"
- ne oubliez pas que les composés chimiques ne sont pas les noms propres, de sorte cas inférieure est indiqué partout.
Noms systématiques pour certains amines communs:
| Amines inférieurs sont nommés avec l'amine de suffixe. | Des amines supérieures ont le préfixe amino comme groupe fonctionnel. |
- Les amines primaires:
- méthylamine
- l'éthanolamine ou le 2-aminoéthanol
- trisamine (ou plus communément tris) (Son Sel de HCl est utilisé comme pH agent tampon dans la biochimie )
- Les amines secondaires:
- diméthylamine
- méthyléthanolamine ou de 2- (méthylamino) éthanol
- Les amines cycliques:
- aziridine (anneau de 3 membres),
- azétidine (anneau 4 membres),
- pyrrolidine (cycle à 5 membres) et
- pipéridine (cycle à 6 membres)
- Les amines tertiaires:
- triméthylamine
- la méthyldiéthanolamine (MDEA)
- diméthyléthanolamine (DMEA) ou 2- (diméthylamino) éthanol
- bis-tris (Il est utilisé comme un agent de tamponnage de pH en biochimie)
Propriétés physiques
Propriétés générales
- La liaison hydrogène influe considérablement sur les propriétés des amines primaires et secondaires ainsi que les dérivés amines protonées de tous. Ainsi, le point d'ébullition est d'aminés supérieures à celles du correspondant les phosphines, mais généralement inférieures à celles des correspondants des alcools . Alcools, ou alcanols, ressemblent amines, mais disposent d'un groupe -OH à la place de NR 2. Puisque l'oxygène est plus électronégatif que l'azote, RO- H est généralement plus acide que le R 2 N- H composé apparenté.
- Méthyl-, diméthyl-, triméthyl-, et éthylamine sont des gaz dans des conditions normales, alors que la diéthylamine et la triéthylamine sont des liquides. La plupart des autres alkylamines commune sont des liquides; haute des amines de poids moléculaire sont, bien entendu, des matières solides.
- Amines gazeuses possèdent une odeur d'ammoniaque caractéristique, amines liquides ont une odeur caractéristique de «poisson».
- La plupart des amines aliphatiques présentent une certaine solubilité dans l'eau, en raison de leur capacité à former des liaisons hydrogène. Solubilité diminue avec l'augmentation du nombre d'atomes de carbone, en particulier lorsque le nombre d'atomes de carbone est supérieur à six.
- Amines aliphatiques affichent solubilité significative organiques solvants , notamment des solvants organiques polaires. Les amines primaires réagissent avec les cétones telles que l'acétone , et la plupart des amines sont incompatibles avec le chloroforme et le tétrachlorure de carbone .
- Les amines aromatiques, tels que aniline, ont leurs seuls électrons de ciseaux conjugué dans le noyau benzénique, ainsi leur tendance à se engager dans une liaison hydrogène est diminuée. Sinon, ils affichent les propriétés suivantes:
- Leurs points d'ébullition sont généralement encore élevé en raison de leur plus grande taille.
- Diminution de solubilité dans l'eau, même se ils conservent leur solubilité dans les solvants organiques appropriés seulement.
- Ils sont toxiques et sont facilement absorbés par la peau: ce est ainsi dangereux.
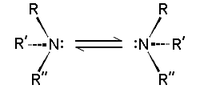
Chiralité
Les amines tertiaires du type NHRR 'et NRR'R "sont chiral: l'atome d'azote porte quatre substituants distincts de comptage la paire libre. La barrière d'énergie pour le inversion du stéréocentre est relativement faible, par exemple, ~ 7 kcal / mol pour une trialkylamine. L'interconversion des stéréo-isomères a été comparé à l'inversion d'un parapluie ouvert pour un fort vent. En raison de cette faible barrière, des amines telles que NHRR 'ne peuvent être résolus optiquement et NRR'R "ne peuvent être résolus lorsque le R, R' et R" groupes sont limités dans des structures cycliques.
Propriétés que des bases
Comme l'ammoniaque, les amines agissent comme bases et sont raisonnablement forte (voir le tableau pour des exemples de l'acide conjugué K a des valeurs). La basicité des amines dépend:
- La disponibilité de la paire libre d'électrons sur l'atome d'azote.
- Les propriétés électroniques des substituants (les groupes alkyle renforcer la basicité, des groupes aryle diminuent pas).
- Le degré d'hydratation de l'amine protonée.
L'atome d'azote possède un seule paire d'électrons qui peut se lier H + pour former un ion ammonium R 3 NH +. La paire électron célibataire est représentée dans cet article par un deux points au-dessus ou à côté du N. L'eau solubilité des amines simples est en grande partie en raison de une liaison hydrogène entre les protons sur des molécules d'eau et de ces paires d'électrons isolées.
- Effet inductif des groupes alkyle
| Les ions du composé | K b |
|---|---|
| L'ammoniac NH 3 | 1,8 · 10 -5 M |
| Méthylamine CH 3 NH 2 | 4,4 · 10 -4 M |
| propylamine CH 3 CH 2 CH 2 NH 2 | 4,7 · 10 -4 M |
| 2-propylamine (CH 3) 2 CHNH 2 | 5,3 · 10 -4 M |
| la diméthylamine (CH 3) 2 NH | 5,4 · 10 -4 M |
- + I 'effet de groupes alkyle soulève l'énergie de la paire libre d'électrons, élevant ainsi la basicité.
- Effet mésomère des systèmes aromatiques
| Les ions du composé | K b |
|---|---|
| L'ammoniac NH 3 | 1,8 · 10 -5 M |
| Aniline C 6 H 5 NH 2 | 3,8 · 10 -10 M |
| 4-méthylphénylamine 4-CH 3 C 6 H 4 NH 2 | 1,2 · 10 -9 M |
- + M effet de cycle aromatique délocaliser la paire électron célibataire dans le ring, entraînant une diminution de la basicité.
Le degré de protonation des amines protonées:
| Les ions du composé | Le nombre maximum de liaison H |
|---|---|
| NH 4 + | 4 très soluble dans H 2 O |
| RNH 3 + | 3 |
| R 2 NH 2 + | 2 |
| R 3 NH + | Une moins Soluble dans H 2 O |
Synthèse
Les méthodes de laboratoire suivantes existent pour la préparation d'amines:
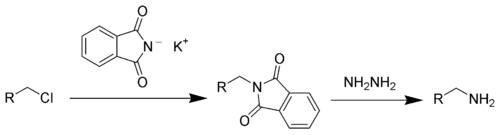
- via le Synthèse de Gabriel:
- via azides par la Réduction Staudinger.
- De acides carboxyliques dans le Réaction de Schmidt.
- Amines allyliques peuvent être préparés à partir de imines dans le Réaction Aza-Baylis-Hillman.
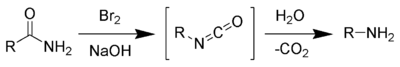
- via Dégradation d'Hofmann des amides. Cette réaction est valide seulement pour la préparation d'amines primaires. Donne de bons rendements en amines primaires non contaminée par d'autres amines.
- Sels d'ammonium quaternaire lors d'un traitement avec une base forte subissent les soi-disant Élimination de Hofmann
- Réduction de des nitriles, amides et des composés nitro:
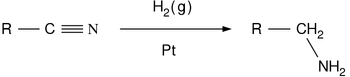
- Les nitriles sont réduits en amines à l'aide de l'hydrogène en présence d'un catalyseur de nickel, bien que des conditions acides ou alcalines devrait être évitée afin d'éviter l'hydrolyse du groupe -CN. LiAlH 4 est plus couramment utilisé pour la réduction de nitriles à l'échelle du laboratoire. De même, LiAlH4 réduit les amides d'amines:
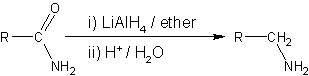
- La réduction des composés nitrés en amines peut être effectuée avec élémentaire zinc , d'étain ou de fer avec un acide .
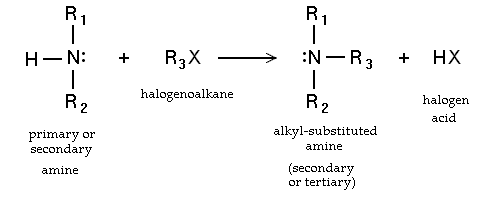
- Substitution nucléophile des haloalcanes. Les amines primaires peuvent également être synthétisés par alkylaton d'ammoniac. Haloalcanes réagissent avec des amines pour donner une amine à substituant alkyle correspondant, avec la libération d'un acide halogéné. Ces réactions, qui sont les plus utiles pour les iodures et les bromures d'alkyle, sont rarement utilisés en raison du degré d'alkylation est difficile à contrôler. Si la réaction d'amine tertiaire est un résultats ammonium quaternaires cationiques dans le Réaction de Menshutkin. Beaucoup sels d'ammonium quaternaire peuvent être préparés par cette voie avec divers groupes R et de nombreux halogénure et pseudohalogénure anions.
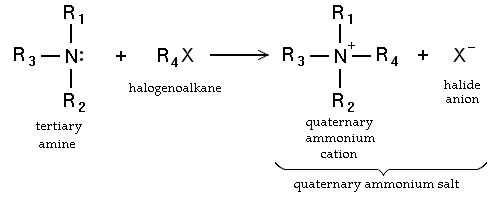
- par l'intermédiaire d'halogénures et de l'hexamine Réaction Delepine
- amines d'aryle peuvent être obtenus à partir des amines et des halogénures d'aryle de la Réaction de Buchwald-Hartwig
- à partir d'alcènes et d'alcynes à hydroamination
- de réarrangement des halogénamines dans le Réaction d'Hofmann-Löffler
Réactions
Les amines réagissent de différentes façons:
- Par substitution nucléophile. des chlorures d'acyle et des anhydrides d'acides réagissent avec des amines primaires et secondaires dans le froid pour former amides dans le Réaction de Schotten-Baumann. Les amines tertiaires peuvent pas être acylés en raison de l'absence d'un atome d'hydrogène remplaçable. Avec le beaucoup moins actif le chlorure de benzoyle, acylation peut encore être effectuée par l'utilisation d'un excès d'alcali aqeous pour faciliter la réaction.
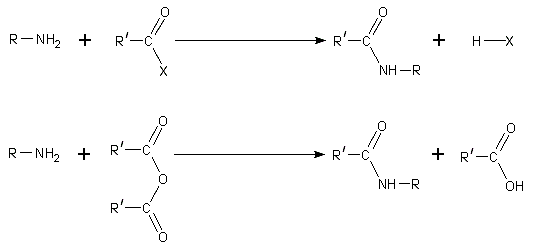
- Étant donné que les amines sont basiques, ils neutralisent les acides carboxyliques pour former les sels de carboxylate d'ammonium correspondants. Lors du chauffage à 200 ° C, les sels d'aminés primaires et secondaires déshydrater pour former le amides.
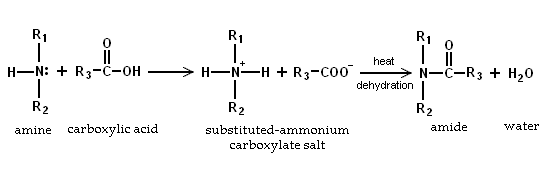
- Par formation d'un sel d'ammonium. Les amines R 3 N réagissent avec des acides forts tels que l'acide iodhydrique, l'acide bromhydrique et l'acide chlorhydrique dans les réactions de neutralisation de formage les sels d'ammonium R 3 NH +.
- Par formation d'un sel de diazonium. L'acide nitreux de formule HNO 2 est instable, donc habituellement un mélange de NaNO 2 et diluer l'acide chlorhydrique ou l'acide sulfurique est utilisé pour produire de l'acide nitreux indirectement. Amines aliphatiques primaires avec l'acide nitreux donnent sels de diazonium très instables qui se décomposent spontanément par perdre N 2 pour former l'ion carbonium. L'ion carbonium continue pour produire un mélange d' alcènes , alcanols ou des halogénures d'alkyle, avec des alcanols comme produit principal. Cette réaction est de peu d'importance synthétique parce que le sel de diazonium formé est trop instable, même dans des conditions froides.
- NaNO 2 + HCl → 2 HNO + NaCl

- Amines aromatiques primaires, tels que aniline (phénylamine) forme plus stable ions diazonium à 0-5 ° C. Au-dessus de 5 ° C, ils se décomposent pour donner le phénol et N 2. Arènediazonium sels peuvent être isolés sous forme cristalline, mais sont généralement utilisés en solution immédiatement après la préparation, en raison de la décomposition rapide au repos même à froid. Le sel arènediazonium solide est explosive à un choc ou un réchauffement doux. En raison de leur grande stabilité, les sels arènediazonium sont plus synthétiquement utiles que leurs homologues alliphatic. Comme il ne est pas nécessaire d'isoler le sel de diazonium, une fois qu'il est formé un autre réactif tel que le cyanure cuivreux peut simplement être ajouté au mélange, et avec un chauffage modéré de la solution, une réaction de remplacement a lieu en même temps que le dégagement d'azote. En outre, arènediazonium ions peuvent également subir une réaction de couplage avec un composé aromatique fortement activé tel qu'un phénol pour former un composé azoïque.

- Par formation imine. Les amines primaires réagissent avec les cétones et des aldéhydes pour former imines. Dans le cas de formaldéhyde (R '= H), ces produits sont typiquement cyclique trimères.
- RNH2 + R '2 C = O → R' 2 C = NR + H 2 O
- Les amines secondaires réagissent avec des cétones et des aldéhydes pour former énamines
- R 2 NH + R '(R "CH 2) C = O → R" CH = C (NR 2) R' + H 2 O
- Par oxydation de nitroso, par exemple avec Acide de Caro.
- Par réduction de des cations ammonium quaternaire à des amines tertiaires dans le La dégradation Emde.
- Par réarrangement d'anilines N-alkyl aryl à anilines substituées de la Réarrangement Hofmann-Martius.
- des amines primaires et secondaires réagissent avec des sels de pyridinium de la Réaction Zincke
- Par clivage des amines tertiaires (seulement) avec du bromure de cyanogène dans le Réaction Von Braun.
L'activité biologique
Amines, ont de fortes caractéristiques, les odeurs désagréables et sont toxiques. Les odeurs d'ammoniac, vieux poisson, l'urine, la chair en décomposition, et le sperme sont tous principalement composés d'amines. De nombreux types d'amines produisent une activité biologique par décomposition des acides aminés .
Utilisation d'amines
Colorants
Des amines aromatiques primaires sont utilisées comme matière de départ pour la fabrication de des colorants azoïques. Il réagit avec l'acide nitrique (III) pour former le sel de diazonium, qui peut subir une réaction de couplage pour former un composé azoïque. Comme composés azoïques sont très colorés, ils sont largement utilisés dans les industries de teinture, telles que:
- Methyl orange
- Brun Direct 138
- Jaune soleil FCF
- Ponceau
Médicaments
- Chlorpheniramine est un antihistaminique qui aide à soulager les troubles allergiques dues au froid, le rhume des foins, des démangeaisons, les piqûres d'insectes et les piqûres.
- Chlorpromazine est un tranquillisant qui endort sans induire le sommeil. Il est utilisé pour soulager l'anxiété, l'excitation, agitation ou même trouble mental.
- Éphédrine et Phényléphrine, comme chlorhydrates d'aminé, sont utilisés comme décongestionnants.
- Amphétamine, La méthamphétamine, et Méthcathinone sont des amines qui sont répertoriés comme substances réglementées par le BRIGADE DES STUPÉFIANTS.
- Amitriptyline, Imipramine, Lofepramine et Clomipramine sont tricyclique antidépresseurs et des amines tertiaires
- Nortriptyline, Désipramine, et Amoxapine sont les antidépresseurs tricycliques et les amines secondaires
- (Les tricylics sont regroupés par la nature du groupe amine final sur la chaîne latérale).
Traitement de gaz
- Aqueux monoéthanolamine (MEA), diglycolamine (DGA), diéthanolamine (DEA), la diisopropanolamine (DIPA) et la méthyldiéthanolamine (MDEA) sont largement utilisés industriellement pour éliminer le dioxyde de carbone (CO 2) et de l'hydrogène sulfuré (H 2 S) à partir de courants de gaz naturel et des courants de procédé de raffinerie. Ils peuvent également être utilisés pour éliminer le CO 2 des gaz de combustion / gaz de combustion et peuvent avoir un potentiel pour la réduction des gaz à effet de serre.