
Acétone
Contexte des écoles Wikipédia
Ce contenu de Wikipedia a été sélectionné par SOS Enfants d'aptitude dans les écoles à travers le monde. enfants SOS est le plus grand don de charité du monde enfants orphelins et abandonnés la chance de la vie familiale.
| Acétone | |
|---|---|
 |  |
 |  |
Nom à privilégier UICPA Propanone | |
Propane-2-one | |
Autres noms Diméthylformaldéhyde Diméthylcétone | |
| Identificateurs | |
| Abréviations | DMK |
| Numéro CAS | 67-64-1 |
| PubChem | 180 |
| ChemSpider | 175 |
| UNII | 1364PS73AF |
| Numéro CE | 200-662-2 |
| Numéro ONU | 1090 |
| KEGG | D02311 |
| MeSH | Acétone |
| ChEBI | CHEBI: 15347 |
| ChEMBL | CHEMBL14253 |
| Numéro RTECS | AL31500000 |
| Beilstein Référence | 635680 |
| Gmelin Référence | 1466 |
| 3DMet | B00058 |
| images de Jmol-3D | Image 1 Image 2 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | C 3 H 6 O |
| Masse molaire | 58,08 g mol -1 |
| Apparence | Liquide incolore (blanc sous forme de neige comme quand solide) |
| Densité | 0,7925 g / cm 3 |
| Point de fusion | -94,9 ° C, 178 K, -139 ° F |
| Point d'ébullition | 56,53 ° C, 330 K, 134 ° F |
| Solubilité dans l'eau | miscible |
| Acidité (p K a) | 24,2 |
| Indice de réfraction (n D) | 1,35900 (20 ° C) |
| Viscosité | 0,3075 c P |
| Structure | |
| Forme moléculaire | trigonale plane au C = O |
| Moment de dipôle | 2,91 Ré |
| Risques | |
| FS | MSDS externe |
| Classification UE | |
| Phrases-R | R11, R36, R66, R67 |
| Phrases S | (S2), S9, S16, S26 |
| NFPA 704 |  3 1 0
|
| Point d'éclair | -17 ° C |
| D'auto-inflammation température | 465 ° C |
| Limites d'explosivité | 4,0 à 57,0 |
| Valeur limite | 500 ppm (TWA), 750 ppm (STEL) |
| LD 50 | > 2000 mg / kg, par voie orale (rat) |
| Des composés apparentés | |
| Connexes solvants | Eau Éthanol Isopropanol Toluène |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
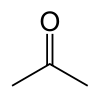
L'acétone est le composé organique avec la formule (CH 3) 2 CO. Ce mobile, liquide incolore, inflammable est l'exemple le plus simple des cétones . L'acétone est miscible avec l'eau et sert comme un important solvant en soi, typiquement en tant que solvant de choix pour des fins de nettoyage en laboratoire. À propos de 5100000 tonnes ont été produites dans le monde en 2009, principalement pour une utilisation comme solvant et la production de le méthacrylate de méthyle et le bisphénol A. domestique courante utilise de l'acétone sont tels que l'ingrédient actif dans dissolvant et comme un diluant à peinture. Ce est un bloc de construction courants en chimie organique.
L'acétone est produite naturellement et éliminés dans le corps humain à la suite de processus métaboliques normaux. Tests de toxicité sur la reproduction montrer qu'il a un faible potentiel de provoquer des problèmes de reproduction. En fait, le corps augmente naturellement le niveau d'acétone chez les femmes enceintes, mères qui allaitent et les enfants parce que leurs besoins énergétiques plus élevés conduisent à des niveaux plus élevés de la production de l'acétone. La communauté médicale utilise maintenant cétogène régimes qui augmentent l'acétone dans le corps pour réduire les crises d'épilepsie chez les nourrissons et les enfants qui souffrent d'épilepsie réfractaire récalcitrant.
Production
L'acétone est produit directement ou indirectement à partir de propylene. Le plus souvent, dans le procédé au cumène, le benzène est alkyle avec du propène et résultant le cumène (isopropylbenzène) est oxydé pour donner du phénol et de l'acétone:
- C 6 H 5 CH (CH 3) 2 + O 2 → C 6 H 5 OH + (CH 3) 2 CO
Cette conversion implique l'intermédiaire de l'hydroperoxyde de cumène, C 6 H 5 C (OOH) (CH 3) 2.
Des méthodes de production plus âgés
Auparavant, l'acétone a été réalisé par la distillation sèche de les acétates, par exemple l'acétate de calcium. Pendant la Première Guerre mondiale acétone a été produit par des bactéries fermentation, tel que développé par Chaim Weizmann (plus tard le premier président de Israël ) afin d'aider à l'effort de guerre britannique. Cette Processus acétone butanol éthanol a été abandonné en raison des faibles rendements.
Biosynthèse
De petites quantités d'acétone sont produits dans le corps par la decarboxylation de les corps cétoniques.
Utilisations
Environ un tiers de l'acétone au monde est utilisé comme solvant, et un quart est consommé comme un précurseur de le méthacrylate de méthyle. Cette application commence par la conversion initiale de l'acétone pour la cyanhydrine d'acétone:
- (CH 3) 2 CO + HCN → (CH 3) 2 C (OH) CN
Dans une étape ultérieure, le nitrile est hydrolyse au insaturé amide, qui est estérifié:
- (CH 3) 2 C (OH) CN + CH 3 OH → CH 2 = (CH 3) CCO 2 CH 3 NH 3 +
La troisième utilisation importante d'acétone (environ 20%) implique sa condensation avec du phénol pour donner Bisphénol A:
- (CH 3) 2 CO + 2 C 6 H 5 OH → (CH 3) 2 C (C 6 H 4 OH) 2 + H 2 O
Le bisphénol-A est un composant de nombreux polymères tels que polycarbonates, les polyuréthanes, et des résines époxy.
Comme solvant
L'acétone est un bon solvant pour la plupart des matières plastiques et des fibres synthétiques y compris ceux utilisés dans des bouteilles de laboratoire en polystyrène , polycarbonate et certains types de polypropylene. Il est idéal pour amincissement résine de fibre de verre, le nettoyage du matériel en fibre de verre et la dissolution en deux parties des époxydes et superglue avant le durcissement. Il est utilisé comme un composant volatil de certaines peintures et vernis. Comme un dégraissant robuste, il est utile dans la préparation de métal avant la peinture; il se amincit également des résines de polyester, vinyle et les adhésifs.
Plusieurs millions de kg d'acétone sont consommés dans la production de l'alcool de solvants méthylisobutylcétone et la méthyl isobutyl cétone. Ces produits se présentent par l'intermédiaire d'une première aldolisation pour donner diacétone alcool.
- 2 (CH 3) 2 → CO (CH 3) 2 (OH) CH 2 C (O) CH 3 C
L'acétone est utilisé comme solvant dans l'industrie pharmaceutique et en tant qu'agent de dénaturation dans de l'alcool dénaturé. L'acétone est également présent en tant que excipient dans certains produits pharmaceutiques.
Stockage de l'acétylène
Bien inflammable lui-même, l'acétone est aussi largement utilisé comme solvant pour le transport et le stockage sûr de l'acétylène , qui ne peut être mise en pression en toute sécurité en tant que composé pur. Des récipients contenant un matériau poreux sont d'abord remplis avec de l'acétone suivie d'acétylène, qui se dissout dans l'acétone. Un litre d'acétone peut dissoudre environ 250 litres d'acétylène.
Les applications médicales et cosmétiques
L'acétone est utilisé dans une variété d'applications médicales et cosmétiques générales et est aussi listé en tant que composant dans les additifs alimentaires et les emballages alimentaires.
L'acétone est couramment utilisé dans le processus de rajeunissement de la peau dans les cabinets médicaux et les spas médicaux. Depuis l'époque de l'Egypte ancienne, les gens ont eu recours à des méthodes de chemexfoliation, également connu sous le pelage chimique, pour rajeunir la peau. Agents couramment utilisés aujourd'hui pour les peelings chimiques sont l'acide salicylique, l'acide glycolique, acide salicylique 30% dans l'éthanol, et l'acide trichloracétique (TCA). Avant chemexfoliation, la peau doit être correctement nettoyé et l'excès de graisse retirée. Ce processus est connu comme le dégraissage. Acétone, SOLISEP, ou une combinaison de ces agents est couramment utilisé dans ce processus.
utilisations de laboratoire
En laboratoire, on utilise l'acétone comme polaire solvant aprotique dans une gamme de réactions organiques, tels que S N 2 réactions. L'utilisation d'un solvant de l'acétone est également critique pour le Oxydation de Jones. Ce est un solvant commun pour le rinçage verrerie de laboratoire en raison de son faible coût et de la volatilité, cependant, il ne forme pas un azéotrope avec l'eau (voir azéotrope (données)). En dépit de son utilisation commune comme une supposée agent de séchage, il ne est pas efficace, sauf par déplacement en vrac et la dilution. L'acétone peut être refroidi avec de la glace sèche à -78 ° C sans congélation; acétone / bains de glace sèche sont couramment utilisés pour effectuer des réactions à basse température. L'acétone est fluorescent sous une lumière ultraviolette, et la vapeur peut être utilisé comme traceur fluorescent dans des expériences d'écoulement de fluide.
Les usages domestiques et autres créneaux
L'acétone est souvent le composant primaire dans des agents de nettoyage tels que dissolvant. Acétate d'éthyle, un autre solvant organique, est parfois utilisé ainsi. L'acétone est un composant de décapant colle et il enlève facilement résidus de verre et la porcelaine.
Il peut être utilisé en tant qu'agent artistique; quand on le frotte sur le dos d'une impression laser ou la photocopie placé face vers le bas sur une autre surface et bruni fermement, le toner des transferts d'images à la surface de destination.
Maquilleurs utilisent l'acétone pour enlever l'adhésif de la peau de la compensation des perruques et des moustaches en immergeant l'élément dans un bain d'acétone, puis en éliminant le résidu de colle ramolli avec une brosse dure.
Certains passionnés de l'automobile ajoutent acétone à environ 1 500 à participer à leur carburant, la suite d'allégations d'amélioration de l'économie de carburant et la vie du moteur.
Sécurité
Inflammabilité
Le danger le plus commun associé avec de l'acétone est son extrême inflammabilité. Il auto-enflamme à une température de 465 ° C (869 ° F). À des températures supérieures de l'acétone point de -20 ° C (-4 ° F) flash, des mélanges air comprises entre 2,5% et 12,8% d'acétone, en volume, peut exploser ou provoquer un incendie flash. Les vapeurs peuvent se écouler le long des surfaces vers des sources d'ignition éloignées et arrière. Décharge statique peut aussi enflammer les vapeurs d'acétone.
Information sur la santé
L'acétone a été largement étudié et est généralement reconnue comme ayant une faible toxicité aiguë et chronique en cas d'ingestion et / ou par inhalation. L'inhalation de concentrations élevées (autour de 9200 ppm) dans l'air a causé une irritation de la gorge chez l'homme en aussi peu que 5 minutes. L'inhalation de concentrations de 1000 ppm a causé une irritation de l'oeil et de la gorge en moins de 1 heure; Toutefois, Inhalation 500 ppm d'acétone dans l'air n'a pas causé de symptômes d'irritation chez les humains même après 2 heures d'exposition. L'acétone est actuellement pas considérée comme une cancérogène, mutagène ou un produit chimique une préoccupation pour les effets neurotoxiques chroniques.
L'acétone peut être trouvé comme ingrédient dans une variété de produits de consommation allant des cosmétiques aux aliments transformés et non transformés. L'acétone a été classé comme un GRAS (Generally Recognized as Safe) substance quand il est présent dans les boissons, pâtisseries, desserts, et conserve à des concentrations allant de 5 à 8 mg / L. En outre, une étude américano-européenne commune a constaté que de l'acétone "les risques pour la santé sont faibles."
Toxicologie
L'acétone est censé présenter une toxicité légère en utilisation normale, et il n'y a pas de preuves solides d'effets chroniques sur la santé si des précautions de base sont respectées.
À des concentrations très élevées de vapeurs, l'acétone est irritant et, comme beaucoup d'autres solvants, peut déprimer le système nerveux central. Ce est aussi un irritant au contact avec les yeux, et un potentiel risque d'aspiration pulmonaire. Dans un cas documenté, l'ingestion d'une quantité importante d'acétone conduit à une toxicité systémique, bien que le patient finit par complètement récupéré. Certaines sources estiment LD 50 pour l'ingestion humaine à 1,159 g / kg; DL 50 par inhalation souris est donnée à 44 g / m 3, pendant 4 heures.
L'acétone a été démontré que effets anticonvulsivants chez les modèles animaux de l'épilepsie , en l'absence de toxicité, lorsqu'ils sont administrés à des concentrations millimolaires. Il a été émis l'hypothèse que la faible teneur en glucides riches en matières grasses régime cétogène utilisé cliniquement pour contrôler l'épilepsie résistante aux médicaments chez les enfants fonctionne en élevant l'acétone dans le cerveau.
- EPA EPCRA Radiation (1995). EPA retiré acétone à partir de la liste des "produits chimiques toxiques" entretenus vertu de l'article 313 de la Emergency Planning and Community Right to Know Act (EPCRA). En prenant cette décision, l'EPA a effectué un examen approfondi des données disponibles sur la toxicité sur l'acétone et a constaté que l'acétone "présente une toxicité aiguë seulement à des niveaux qui dépassent largement rejets et des expositions qui en résultent», et en outre que l'acétone "présente une faible toxicité dans des études chroniques."
- Génotoxicité. L'acétone a été testée en plus de deux douzaines in vitro et in vivo dans des essais.
Ces études indiquent que l'acétone ne est pas génotoxique.
- Cancérogénicité. EPA en 1995 a conclu: «Il ne existe actuellement aucune preuve pour suggérer un sujet de préoccupation pour la cancérogénicité." (EPCRA examen, décrit à la section 3.3). NTP scientifiques ont recommandé contre les essais de toxicité chronique / de cancérogénicité de l'acétone, car «les études ne ont démontré prechronic une réponse toxique très doux à très fortes doses chez les rongeurs."
- Neurotoxicité et la neurotoxicité développementale. Le potentiel neurotoxique à la fois de l'acétone et l'isopropanol, le précurseur métabolique de l'acétone, ont été largement étudiées. Ces études démontrent que, bien que l'exposition à de fortes doses d'acétone peut provoquer des effets transitoires du système nerveux central, de l'acétone ne est pas neurotoxique. Une directive étude de neurotoxicité développementale a été réalisée avec de l'isopropanol, et aucun des effets neurotoxiques de développement ont été identifiés, même à la plus forte dose testée. (SIAR, pp. 1, 25, 31).
- L'environnement. Lorsque l'EPA exempté de la réglementation de l'acétone comme un composé organique volatil (COV) en 1995, l'EPA a déclaré que cette exemption serait "contribuer à la réalisation de plusieurs objectifs environnementaux importants et appuierait les efforts de prévention de la pollution de l'EPA." 60 Fed. Reg. 31634 (16 Juin, 1995). 60 Fed. Reg. 31634 (16 Juin, 1995). EPA a noté que l'acétone pourrait être utilisé "comme un substitut pour plusieurs composés qui sont énumérés comme les polluants atmosphériques dangereux (HAP) en vertu de l'article 112 de la [Clean Air] Loi.
Effets sur l'environnement
Acétone se évapore rapidement, même de l'eau et du sol. Une fois dans l'atmosphère, il est dégradé par la lumière UV avec une demi-vie de 22 jours. Acétone dissipe lentement dans le sol, les animaux ou les cours d'eau, car il est parfois consommé par les micro-organismes, mais ce est un contaminant significative des eaux souterraines en raison de sa forte solubilité dans l'eau. Le LD 50 de l'acétone pour poisson est de 8,3 g / l d'eau (soit environ 0,8%) de plus de 96 heures, et sa demi-vie de l'environnement est d'environ 1 à 10 jours. L'acétone peut poser un risque important de raréfaction de l'oxygène dans les systèmes aquatiques en raison de l'activité microbienne consommer.
Peroxyde d'acétone
Lorsqu'il est oxydé, forme acétone acétone peroxyde comme sous-produit, qui est un composé très instable. Elle peut être formée accidentellement, par exemple lors de déchets peroxyde d'hydrogène est versé dans un solvant des déchets contenant de l'acétone. peroxyde d'acétone est plus de dix fois plus sensible aux frottements et chocs nitroglycérine. En raison de son instabilité, il est rarement utilisé, en dépit de sa synthèse chimique facile.

