
Acide carboxylique
Contexte des écoles Wikipédia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Une bonne façon d'aider d'autres enfants est de parrainer un enfant



Les acides carboxyliques sont des acides organiques caractérisés par la présence d'un groupe carboxyle , qui a la formule -C (= O) OH, -COOH habituellement écrit ou -CO 2 H. Les acides carboxyliques sont Acides de Brønsted-Lowry - ils sont donneurs de protons. Les sels et les anions d'acides carboxyliques sont appelés carboxylates.
Le plus simple de la série des acides carboxyliques sont les acides alcanoïques, R-COOH, où R est un atome d'hydrogène ou un groupe alkyle groupe. Les composés peuvent aussi avoir deux ou plusieurs groupes acide carboxylique par molécule.
Propriétés physiques
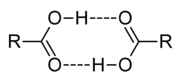
Les acides carboxyliques sont polaire, et la forme des liaisons hydrogène entre eux. A des températures élevées, en phase vapeur, les acides carboxyliques existent habituellement sous forme de paires dimères. Des acides carboxyliques inférieurs (1 à 4 carbones) sont de miscible à l'eau, tandis que les acides carboxyliques supérieurs sont beaucoup moins solubles en raison de la nature hydrophobe de plus en plus de la chaîne alkyle. Ils ont tendance à être assez soluble dans des solvants moins polaires comme les éthers et les alcools.
Les acides carboxyliques sont largement répandus dans la nature et sont typiquement acides faibles, ce qui signifie qu'ils seulement partiellement dissocier en H + cations et RCOO - anions dans aqueuse solution. Par exemple, à la température ambiante, seulement 0,02% des acides acétiques molécules sont dissociées dans l'eau.
Étant donné que les acides carboxyliques sont des acides faibles, dans l'eau, les deux formes existent dans un équilibre:
- RCOOH ↔ RCOO - + H +
L'acidité des acides carboxyliques peut se expliquer soit par la stabilité de l'acide ou de la stabilité de la de base conjugué à l'aide effets inductifs ou des effets de résonance.
Stabilité de l'acide
Utilisation des effets inductifs, l'acidité des acides carboxyliques peut être rationalisée par les deux électronégatifs oxygène atomes de distorsion les nuages d'électrons entourant la liaison OH, l'affaiblissant. La faible liaison OH provoque la molécule d'acide pour être moins stable, et l'origine de l'atome d'hydrogène labile pour être, donc il se dissocie facilement pour donner l'ion H +. Depuis l'acide est instable, l' équilibre se situera sur la droite.
D'autres atomes ou groupes électronégatifs, tels que le chlore ou un groupe hydroxyle, substitués sur le groupe R ont un semblable, quoique moindre effet. La présence de ces groupes augmente l'acidité par effets inductifs. Par exemple, l'acide trichloroacétique (trois groupes -Cl) est un acide plus fort que l'acide lactique (un groupe -OH), qui à son tour est plus fort que l'acide acétique (pas de constituant électronégatif).
Stabilité de la base conjuguée

L'acidité d'un acide carboxylique peut aussi se expliquer par des effets de résonance. Le résultat de la dissociation d'un acide carboxylique est un produit stabilisé par résonance dans laquelle la charge négative est partagée (délocalisé) entre les deux atomes d'oxygène. Chacune des liaisons carbone-oxygène a ce qu'on appelle une caractéristique partielle double liaison. Étant donné que la base conjuguée est stabilisée, l'équilibre ci-dessus se trouve sur la droite.
Spectroscopie
Les acides carboxyliques sont plus facilement identifiées comme telles par spectrométrie infrarouge. Ils présentent une forte étirement C = O à entre 1680 et 1725 cm -1, et le tronçon caractéristique OH du groupe carboxyle apparaît comme un pic large dans les 2500 à 3000 cm -1 région.
Dans une H spectrométrie RMN, l'hydrogène hydroxyle apparaît dans la zone de 10 à 13 ppm, mais il est souvent soit élargi ou non respectée par échange avec des traces d'eau.
Synthèse
- Les acides carboxyliques peuvent être préparés par oxydation des alcools primaires et aldéhydes avec des oxydants forts tels que Bichromate de potassium, Le réactif de Jones, le permanganate de potassium , ou le chlorite de sodium.
- Ils peuvent également être produits par le clivage oxydant d' oléfines par le permanganate de potassium ou le dichromate de potassium. En particulier, ne importe quel groupe alkyle sur un noyau benzénique sera entièrement oxydé en un acide carboxylique, indépendamment de sa longueur de chaîne. Ce est la base pour la synthèse industrielle de l'acide benzoïque à partir de toluène .
- Les acides carboxyliques peuvent être également obtenues par hydrolyse de des nitriles, des esters, ou des amides, avec l'addition d'acide ou de base.
- Ils peuvent également être préparés à partir de l'action d'un Réactif de Grignard sur le dioxyde de carbone , bien que cette méthode ne est pas utilisée dans l'industrie.
Les acides carboxyliques peuvent également se former à partir des réactions suivantes:
- Dismutation d'un aldéhyde en Réaction de Cannizzaro
- Réaménagement des dicétones dans le benzilic réarrangement acide
- L'halogénation suivie d'une hydrolyse des cétones méthyliques de la réaction haloforme
- L'hydroformylation d'un alcène suivie d'une hydrolyse en le Réaction de Koch
- Réactions moins communes impliquant la génération d'acides benzoïque sont les von Richter réaction de nitrobenzènes et la Réaction de Kolbe-Schmitt à partir de phénols .
Réactions
- Les acides carboxyliques réagissent avec des bases pour former des sels de carboxylate, dans lequel l'hydrogène du groupe hydroxyle (-OH) est remplacé par un métal cationique . Ainsi, l'acide acétique présent dans le vinaigre réagit avec bicarbonate de sodium (bicarbonate de sodium) pour former de l'acétate de sodium, le dioxyde de carbone et de l'eau:
- CH 3 COOH + NaHCO 3 → CH 3 COONa + CO 2 + H 2 O
- Les acides carboxyliques réagissent également avec des alcools et des amines pour donner esters et amides. Comme d'autres alcools et des phénols , le groupe hydroxyle d'acides carboxyliques peut être remplacé par un atome de chlore en utilisant le chlorure de thionyle pour donner des chlorures d'acyle.
- Comme avec tous les composés carbonylés, les protons sur la α-carbone sont labiles en raison de céto-énol tautomérisation. Ainsi, l'α-carbone est facilement halogéné dans le Hell-Volhard halogénation-Zelinsky.
- Le Arndt-Eistert synthèse insère un groupe α-méthylène en un acide carboxylique.
- Le Un réarrangement de Curtius convertit les acides carboxyliques à isocyanates.
- Le Réaction de Schmidt convertit les acides carboxyliques à des amines .
- Les acides carboxyliques sont décarboxylés en HUNSDIECKER réaction.
- Le Réaction de Dakin-West convertit un acide aminé à l'extrémité amino-cétone correspondante.
- Dans la dégradation Barbier-Wieland (1912), le groupe alpha-méthylène dans un acide carboxylique aliphatique est éliminé dans une séquence d'étapes de réaction, de manière efficace une chaîne grasse.
- L'addition d'un groupe carboxyle en un composé qui est connu comme carboxylation; l'enlèvement de decarboxylation est une. Les enzymes qui catalysent ces réactions sont connues sous le nom (carboxylases EC 6.4.1) et décarboxylases (CE 4.1.1).
Nomenclature et exemples
Le anion carboxylate R-COO - est généralement nommé avec le -ate suffixe, l'acide acétique afin, par exemple, devient un ion acétate. Dans la nomenclature IUPAC , les acides carboxyliques ont un suffixe d'acide -oic (par exemple, l'acide octadécanoïque). En nomenclature commune, le suffixe est habituellement de l'acide -ic (par exemple, acide stéarique).
| Les atomes de carbone | Nom commun | Nom IUPAC | Formule chimique | L'emplacement ou l'utilisation commune |
|---|---|---|---|---|
| 1 | L'acide formique | L'acide formique | HCOOH | Les piqûres d'insectes |
| 2 | Acide acétique | Acide acétique | CH 3 COOH | Vinaigre |
| 3 | L'acide propionique | Propanoïque | CH 3 CH 2 COOH | |
| 4 | L'acide butyrique | Butanoïque | CH 3 (CH 2) 2 COOH | Beurre rance |
| 5 | L'acide valérique | Pentanoïque | CH 3 (CH 2) 3 COOH | |
| 6 | Caproïque | Hexanoïque | CH 3 (CH 2) 4 COOH | |
| 7 | L'acide énanthique | Heptanoïque | CH 3 (CH 2) 5 COOH | |
| 8 | L'acide caprylique | Acide octanoïque | CH 3 (CH 2) 6 COOH | |
| 9 | L'acide pélargonique | L'acide nonanoïque | CH 3 (CH 2) 7 COOH | |
| 10 | L'acide caprique | L'acide décanoïque | CH 3 (CH 2) 8 COOH | |
| 12 | L'acide laurique | L'acide dodécanoïque | CH 3 (CH 2) 10 COOH | Huile de noix de coco |
| 16 | L'acide palmitique | L'acide hexadécanoïque | CH 3 (CH 2) 14 COOH | |
| 18 | Acide stéarique | L'acide stéarique | CH 3 (CH 2) 16 COOH |
D'autres acides carboxyliques comprennent:
- À chaîne courte acides monocarboxyliques insaturés
- L'acide acrylique (acide 2-propanoïque) - CH 2 = CHCOOH, utilisé dans la synthèse de polymères
- Les acides gras - moyenne à longue chaîne saturés et acides monocarboxyliques insaturés, à nombre pair d'atomes de carbone
- L'acide docosahexaénoïque - supplément nutritionnel
- L'acide eicosapentaénoïque - supplément nutritionnel
- Les acides aminés - les blocs de construction de protéines
- Cétoacides - acides d'importance biochimique qui contiennent une cétone groupe
- L'acide pyruvique
- Acide acétoacétique
- Les acides carboxyliques aromatiques
- L'acide benzoïque - C 6 H 5 COOH; le benzoate de sodium, le sel de sodium de l'acide benzoïque est utilisé comme conservateur alimentaire
- L'acide salicylique - dans de nombreux produits de soins de la peau
- Les acides dicarboxyliques - contenant deux groupes carboxyle
- Acide aldarique - une famille d'acides de sucre
- L'acide oxalique - dans de nombreux aliments
- L'acide malonique
- L'acide malique - trouve dans les pommes
- L'acide succinique - un composant de la cycle de l'acide citrique
- L'acide glutarique
- L'acide adipique - le monomère utilisé pour produire nylon
- - Acides tricarboxyliques contenant trois groupes carboxyle
- L'acide citrique - trouvé dans les agrumes
- Acides alpha hydroxy - contenant un groupe hydroxy
- L'acide lactique (acide 2-hydroxypropanoïque) - présent dans le lait aigre

