
Corrosion
Contexte des écoles Wikipédia
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
| |||||
La corrosion est la destruction progressive du matériau, habituellement des métaux, par réaction chimique avec son environnement. Dans l'utilisation la plus courante du mot, cela signifie électrochimique oxydation des métaux dans la réaction avec un oxydant tel que l'oxygène . La rouille, la formation de fer oxydes, est un exemple bien connu de corrosion électrochimique. Ce type de dégât produit typiquement oxyde (s) ou sel (s) du métal d'origine. La corrosion peut également se produire dans des matériaux autres que des métaux, tels que céramique ou polymères, bien que dans ce contexte, le terme dégradation est plus fréquente. La corrosion se dégrade les propriétés utiles des matériaux et des structures dont la force, l'allure et la perméabilité aux liquides et aux gaz.
Beaucoup structurelle alliages corrodent simplement d'exposition à l'humidité dans l'air, mais le processus peut être fortement affectés par l'exposition à certaines substances. La corrosion peut être concentrée sur place pour former un puits ou le crack, ou il peut se étendre sur une vaste zone corrosion plus ou moins uniformément la surface. Étant donné que la corrosion est un processus de diffusion contrôlé, il se produit sur les surfaces exposées. En conséquence, des procédés pour réduire l'activité de la surface exposée, telle que passivation et conversion de chromate, peut augmenter la résistance à la corrosion d'un matériau. Toutefois, certains mécanismes de corrosion sont moins visibles et moins prévisibles.



La corrosion galvanique

La corrosion galvanique se produit lorsque deux métaux différents sont en contact physique ou électrique avec l'autre et sont immergées dans une commune électrolyte, ou lorsque le même métal est exposé à l'électrolyte avec des concentrations différentes. Dans un couple galvanique, le métal plus actif (l'anode) se corrode à une vitesse accélérée et plus métal noble (la cathode) corrode à un taux retardée. Lorsqu'elle a été immergée séparément, chaque métal corrode à son propre rythme. Quel type de métal (s) à utiliser est déterminée facilement par la suite de la série galvanique. Par exemple, le zinc est souvent utilisée comme une anode sacrificielle pour structures en acier. La corrosion galvanique est d'un intérêt majeur pour l'industrie maritime et également partout l'eau (sels) contenant contacts tuyaux ou des structures métalliques.
Des facteurs tels que la taille relative de anode, le type de métal, et des conditions de fonctionnement ( température , l'humidité, salinité, etc.) affecte la corrosion galvanique. Le rapport d'aire de surface de l'anode et cathode affecte directement les taux de corrosion des matériaux. La corrosion galvanique est souvent utilisé dans anodes sacrificielles.
Série galvanique
Dans un environnement donné (une moyenne standard est aérée, à température ambiante d'eau de mer ), un métal est soit plus noble ou plus actifs que d'autres, en fonction de la force avec ses ions sont liés à la surface. Deux métaux de parts de contact électrique les mêmes électrons, de sorte que le "bras-de-guerre» à chaque surface est analogue à la concurrence pour les électrons libres entre les deux matériaux. Utilisation de l'électrolyte comme hôte pour le flux d'ions dans le même sens, le métal actif se électrons de l'une noble. Le flux de masse résultante ou courant électrique peuvent être mesurés pour établir une hiérarchie des matériaux dans le milieu d'intérêt. Cette hiérarchie est appelé une série galvanique et est utile pour prédire et comprendre la corrosion.
Suppression de la corrosion
Souvent, il est possible d'enlever chimiquement les produits de corrosion. Par exemple l'acide phosphorique sous forme de gelée navale est souvent appliqué à des outils ou surfaces ferreuses pour enlever la rouille. Suppression de la corrosion ne doit pas être confondue avec électrolytique, qui supprime certaines couches de métal sous-jacent de faire une surface lisse. Par exemple, l'acide phosphorique peut également être utilisé pour le polissage électrolytique de cuivre, mais il le fait en enlevant le cuivre, et non les produits de corrosion du cuivre.
Résistance à la corrosion
Certains métaux sont intrinsèquement plus résistant à la corrosion que les autres (pour des exemples, voir la série galvanique). Il ya différentes façons de protéger les métaux contre la corrosion y compris la peinture, galvanisation par immersion à chaud, et des combinaisons de ceux-ci.
La chimie intrinsèque

Les matériaux les plus résistants à la corrosion sont ceux pour lesquels la corrosion est thermodynamiquement défavorable. Les produits de corrosion de l'or ou le platine ont tendance à se décomposer spontanément en métal pur, ce est pourquoi ces éléments peuvent être trouvés sous forme métallique sur Terre et ont été longtemps la valeur. Plus "base" commune métaux ne peut être protégée par des moyens plus temporaires.
Certains métaux ont naturellement lente cinétique de la réaction, même si leur corrosion est thermodynamiquement favorable. Ceux-ci comprennent des métaux tels que le zinc , le magnésium et le cadmium . Bien que la corrosion de ces métaux est continue et permanente, il arrive à un taux acceptable lente. Un exemple extrême est graphite, ce qui libère de grandes quantités d'énergie sur oxydation, mais a une cinétique lente tels que ce est effectivement l'abri de la corrosion électrochimique dans des conditions normales.
Passivation
La passivation se réfère à la formation spontanée d'un film ultra-mince de produits de corrosion connus comme film passif sur la surface du métal qui agissent comme une barrière à l'oxydation. La composition chimique et la microstructure d'un film passif est différent du métal sous-jacent. Épaisseur du film passive typique sur aluminium, aciers inoxydables et alliages est à 10 nanomètres. Le film passif est différent de couches d'oxyde qui se forment lors du chauffage et qui sont dans la gamme d'épaisseur micrométrique - le film passif se retrouve retirée ou endommagée alors que la couche d'oxyde ne est pas. Passivation dans des environnements naturels tels que l'air, l'eau et le sol à modérée pH se voit dans des matériaux tels que l'aluminium , acier inoxydable, titane et silicium .
Passivation est principalement déterminée par des facteurs métallurgiques et environnementaux. L'effet du pH est résumée à l'aide Pourbaix diagrammes, mais de nombreux autres facteurs sont influents. Certaines conditions qui inhibent la passivation comprennent un pH élevé pour l'aluminium et le zinc, à faible pH ou la présence de des ions chlorure pour l'acier inoxydable, de titane à haute température (dans ce cas, l'oxyde se dissout dans le métal, au lieu de l'électrolyte) et ions fluorure pour le silicium. D'autre part, les conditions inhabituelles peuvent entraîner une passivation de matériaux qui sont normalement non protégé, que l'environnement alcalin de béton fait pour l'acier barres d'armature. L'exposition à un métal liquide tel que du mercure ou à chaud soudure peut souvent contourner les mécanismes de passivation.
Corrosion des matériaux passives
Passivation est extrêmement utile dans l'atténuation des dommages de corrosion, mais même un allié de haute qualité sera corrode si sa capacité à former un film de passivation est entravée. Une sélection adéquate de la bonne classe de matériel pour l'environnement spécifique est important pour la performance durable de ce groupe de matériaux. Si panne survient dans le film passif en raison de facteurs chimiques ou mécaniques, les principaux modes de corrosion pourraient inclure la corrosion par piqûres, la corrosion et crevasse corrosion sous contrainte.
La corrosion par piqûres

Certaines conditions, telles que de faibles concentrations d'oxygène ou de fortes concentrations d'espèces telles que le chlorure qui complète comme anions , peuvent interférer avec la capacité d'un alliage donné de re-former un film de passivation. Dans le pire des cas, la quasi-totalité de la surface restera protégé, mais minuscules fluctuations locales seront dégrader le film d'oxyde en quelques points critiques. Corrosion à ces points sera grandement amplifié, et peut causer des piqûres de corrosion de plusieurs types, en fonction des conditions. Alors que les piqûres de corrosion seulement nucléation dans des circonstances assez extrêmes, ils peuvent continuer à croître même lorsque les conditions reviennent à la normale, depuis l'intérieur d'une fosse est naturellement privé d'oxygène et localement le pH diminue à des valeurs très faibles et le taux de corrosion augmente en raison d'un processus autocatalytique. Dans les cas extrêmes, les pointes acérées de piqûres de corrosion très longues et étroites peuvent causer concentration de contraintes au point que les alliages autrement difficiles peuvent éclater; un film mince transpercé par une invisible petit trou peut cacher une fosse taille du pouce de la vue. Ces problèmes sont particulièrement dangereuses car elles sont difficiles à détecter avant une partie ou de la structure échoue. Piqûres reste parmi les formes les plus courantes et les plus dommageables de la corrosion dans les alliages passives, mais elle peut être prévenue par le contrôle de l'environnement de l'alliage.
Carie soudure et knifeline attaque


L'acier inoxydable peut poser des problèmes de corrosion spéciaux, puisque son comportement de passivation repose sur la présence d'un élément d'alliage majeure ( chrome , au moins 11,5%). En raison des températures élevées de soudage et de traitement thermique, de chrome peuvent former des carbures dans le joints de grains des alliages inoxydables. Cette réaction chimique enlève le matériau de chrome dans la zone proche de la limite de grain, ce qui rend ces régions beaucoup moins résistant à la corrosion. Cela crée un couple galvanique avec l'alliage bien protégé à proximité, ce qui conduit à souder décroissance (corrosion des joints de grains dans les zones affectées par la chaleur) dans des environnements hautement corrosifs.
Un acier inoxydable est dit être sensibilisées si carbures de chrome sont formés dans la microstructure. Une microstructure typique d'un acier inoxydable de type 304 normalisée montre aucun signe de sensibilisation pendant un acier fortement sensibilisées montre la présence de précipités aux joints de grains. Les lignes foncées dans la microstructure sensibilisés sont des réseaux de carbures de chrome formés le long des joints de grains.
Alliages spéciaux, soit à faible teneur en carbone ou avec du carbone ajouté " getters ", tels que le titane et le niobium (dans les 321 et 347, respectivement), peut empêcher cet effet, mais celle-ci nécessitent un traitement thermique spécial après le soudage pour éviter le phénomène similaire de knifeline attaque. Comme son nom l'indique, la corrosion est limitée à un zone très étroite adjacente à la soudure, souvent seulement quelques micromètres de diamètre, ce qui en fait encore moins perceptible.
Corrosion

Corrosion caverneuse est une forme localisée de la corrosion se produisant dans des espaces confinés (de crevasses), dont l'accès du fluide de travail de l'environnement est limité. La formation d'une cellule d'aération différentiel conduit à la corrosion à l'intérieur des fentes. Des exemples de crevasses sont les lacunes et les zones de contact entre les parties, sous les joints ou les joints, les fissures et les coutures à l'intérieur, les espaces remplis de dépôts et sous des tas de boue.
Corrosion caverneuse est influencée par le type de crevasse (métal-métal, métal non métallique), la géométrie de la crevasse (taille, état de surface), et les facteurs métallurgiques et environnementaux. La sensibilité à la corrosion caverneuse peut être évaluée à l'aide des procédures standard ASTM. A la température critique de corrosion fissurante est couramment utilisé pour classer la résistance d'un matériau à la corrosion caverneuse.
Corrosion microbienne
Corrosion microbienne, ou communément connu sous le nom biocorrosion (MIC), est une corrosion provoquée ou promu par les micro-organismes, habituellement chimiotrophes. Elle peut se appliquer à la fois des matériaux métalliques et non métalliques, en présence ou en absence d'oxygène. les bactéries sulfato-réductrices sont actifs en l'absence d'oxygène (anaérobie); ils produisent sulfure d'hydrogène, ce qui provoque sulfure de fissuration sous contrainte. En présence d'oxygène (aérobie), certaines bactéries peuvent oxyder directement fer en oxydes et hydroxydes de fer, d'autres bactéries oxyder le soufre et produisent de l'acide sulfurique causant corrosion biogène de sulfure. Cellules de concentration peuvent se former dans les dépôts de produits de corrosion, ce qui conduit à la corrosion localisée.
Corrosion accélérée de basse mer (ALWC) est une forme particulièrement agressive de MIC qui affecte pieux d'acier en eau de mer près de la laisse de basse mer de l'eau. Elle est caractérisée par une boue orange, qui sent de sulfure d'hydrogène lorsqu'il est traité avec de l'acide. Les taux de corrosion peuvent être très élevés et les indemnités conception de corrosion pourront bientôt être dépassé conduisant à une défaillance prématurée de la pile de l'acier. Piles qui ont été revêtement et de protection cathodique installé au moment de la construction ne sont pas sensibles à ALWC. Pour les pieux non protégés, anodes sacrificielles peuvent être installés locale dans les zones touchées pour inhiber la corrosion ou d'un système d'anode sacrificielle modernisé complète peut être installé. Les zones affectées peuvent également être traités par voie électrochimique en utilisant une électrode à la première chlore produits pour tuer les bactéries, puis produit un dépôt calcaire, ce qui aidera à protéger le métal contre de nouvelles attaques.
Corrosion à haute température
La corrosion à haute température est une détérioration chimique d'un matériau (en général un métal) à la suite de chauffage. Cette forme non galvanique de corrosion peut se produire lorsque le métal est soumis à une atmosphère chaude contenant de l'oxygène, de soufre ou d'autres composés capables d'oxydation (ou d'aider l'oxydation des) matériau considéré. Par exemple, les matériaux utilisés dans l'aérospatiale, la production d'électricité et même des moteurs de voiture doivent résister à des périodes prolongées à haute température dans laquelle ils peuvent être exposés à une atmosphère contenant des produits potentiellement hautement corrosifs de combustion.
Les produits de corrosion à haute température peuvent potentiellement être tourné à l'avantage de l'ingénieur. La formation d'oxydes sur les aciers inoxydables, par exemple, peut fournir une couche protectrice prévenir d'autres agressions atmosphériques, permettant pour un matériau à utiliser pour des périodes prolongées à la fois chambre et des températures élevées dans des conditions hostiles. De tels produits de corrosion à haute température, sous la forme de compactés glaçures couche d'oxyde, d'empêcher ou de réduire l'usure à haute température pendant le contact de la surface métallique (ou métallique et céramique) coulissant.
Dépoussiérage de Métal
poudrage métallique est une forme catastrophique corrosion qui se produit lorsque des matériaux sensibles sont exposés à des environnements avec des activités de carbone élevés, tels que le gaz de synthèse et d'autres environnements à haut CO. La corrosion se manifeste comme une rupture du métal massif à la poudre de métal. Le mécanisme est soupçonné d'abord le dépôt d'une couche de graphite sur la surface du métal, généralement de monoxyde de carbone (CO) dans la phase vapeur. Cette couche de graphite est ensuite supposé former des espèces métastables M 3 C (où M est le métal), qui migrent loin de la surface métallique. Toutefois, dans certains régimes est observé aucune espèce M 3 C indiquant un transfert direct d'atomes de métal dans la couche de graphite.
Protection contre la corrosion
Les traitements de surface
Revêtements appliqués

Placage, la peinture, et l'application de émail sont les plus communs les traitements anti-corrosion. Ils agissent en fournissant une barrière de matériau résistant à la corrosion entre l'environnement et endommager le matériau de structure. Mis à part les problèmes esthétiques et de la fabrication, il ya des compromis à souplesse mécanique par rapport résistance à l'abrasion et à haute température. Placages échouent habituellement seulement en petites sections, et si le placage est plus noble que le substrat (par exemple, le chrome sur l'acier), un couple galvanique causeront une zone exposée aux corrode beaucoup plus rapidement que ne le ferait une surface non plaqué. Pour cette raison, il est souvent judicieux de la plaque de métal actif tel que le zinc ou le cadmium. Peinture soit par rouleau ou au pinceau est plus souhaitable pour les espaces restreints; vaporisez serait mieux pour les zones de revêtement plus grandes telles que les ponts en acier et des applications de front de mer. Revêtements souples de polyuréthane, comme Durabak-M26 par exemple, peuvent fournir un joint anti-corrosive avec une membrane antidérapante très durable. Revêtements peints sont relativement faciles à appliquer et à avoir des temps de séchage rapide, bien que la température et l'humidité peuvent causer des temps de séchage varient à.
Revêtements réactifs
Si l'environnement est contrôlée (en particulier dans les systèmes à recirculation), des inhibiteurs de corrosion peuvent souvent être ajoutés. Ceux-ci forment un revêtement électriquement isolant imperméable ou chimiquement sur les surfaces métalliques exposées, de supprimer les réactions électrochimiques. Ces méthodes font évidemment le système moins sensible aux rayures ou des défauts dans le revêtement, puisque les inhibiteurs supplémentaires peuvent être mis à la disposition où le métal est exposé. Les produits chimiques qui inhibent la corrosion comprennent une partie des sels de l'eau dure (systèmes d'eau romaine sont célèbres pour leurs gisements minéraux ), les chromates, des phosphates, polyaniline, autre polymères conducteurs et un large éventail de produits chimiques spécialement conçus qui ressemblent des agents tensioactifs (par exemple à longue chaîne de molécules organiques avec des groupes terminaux ioniques).
Anodisation

Les alliages d'aluminium sont souvent soumis à un traitement de surface. Conditions électrochimiques dans le bain sont soigneusement ajustés de sorte que plusieurs uniforme pores nanomètres de large apparaissent dans le film d'oxyde de métal. Ces pores permettent l'oxyde de croître beaucoup plus épais que les conditions de passivation permettraient. A la fin du traitement, les pores sont autorisés à saisir, en formant une couche de surface plus dure que d'habitude. Si ce revêtement est rayé, processus de passivation normales prennent le relais pour protéger la zone endommagée.
L'anodisation est très résistant aux intempéries et à la corrosion, il est couramment utilisé pour les façades de bâtiments et d'autres domaines que la surface sera en contact régulier avec les éléments. Tout en étant souple, il doit être nettoyé fréquemment. Si laissé sans nettoyage, bord du panneau coloration va naturellement se produire.
revêtements de biofilms
Une nouvelle forme de protection a été mis au point par l'application de certaines espèces bactériennes de films à la surface des métaux dans des environnements hautement corrosifs. Ce processus augmente la résistance à la corrosion sensiblement. Alternativement, antimicrobien producteurs biofilms peuvent être utilisés pour inhiber la corrosion de l'acier doux de bactéries sulfato-réductrices.
Coffrage de perméabilité contrôlée,
Coffrage de perméabilité contrôlée (CPF) est une méthode de prévention de la corrosion de renfort en améliorant la durabilité naturelle du couvrir lors de la pose de béton. CPF a été utilisé dans des environnements à combattre les effets de carbonatation, chlorures, le gel et à l'abrasion.
La protection cathodique
La protection cathodique (CP) est une technique pour contrôler la corrosion d'une surface métallique en faisant que la surface d'une cathode Cellule électrochimique. Systèmes de protection cathodique sont les plus couramment utilisés pour protéger l'acier, de l'eau et du carburant pipelines et des réservoirs; quai de l'acier piles, des navires et en mer plates-formes pétrolières.
La protection de l'anode sacrificielle

Pour CP efficace, le potentiel de la surface en acier est polarisé (poussé) plus négatif jusqu'à ce que la surface de métal a un potentiel uniforme. Avec un potentiel uniforme, la force motrice de la réaction de corrosion est stoppée. Pour les systèmes de PC galvanique, le matériau d'anode se corrode sous l'influence de l'acier, et, éventuellement, il doit être remplacé. Le polarisation est provoquée par le flux de courant de l'anode à la cathode, grâce à la différence de potentiel électrochimique entre l'anode et la cathode.
Protection cathodique à courant imposé
Pour de plus grandes structures, anodes galvaniques ne peuvent pas livrer économiquement assez de courant pour fournir une protection complète. Protection cathodique à courant imposé (ICCP) systèmes utilisent des anodes connectées à un Source de courant continu (comme un Redresseur de protection cathodique). Anodes pour systèmes ICCP sont des formes de tiges tubulaires et solides de divers matériaux spécialisés. Elles incluent une forte silicium la fonte, le graphite, l'oxyde de métal mixte ou en platine recouvert de titane ou le niobium et le fil revêtu de la tige.
La protection anodique
Protection anodique impressionne courant anodique sur la structure à protéger (opposée à la protection cathodique). Il convient pour les métaux qui présentent la passivité (par exemple, l'acier inoxydable) et convenablement petit courant passive sur une large gamme de potentiels. Il est utilisé dans des environnements agressifs, par exemple, des solutions d'acide sulfurique.
Taux de corrosion
Un simple test pour la mesure de la corrosion est la méthode de perte de poids. Le procédé consiste à exposer une pièce propre pesé du métal ou de l'alliage de l'environnement corrosif pendant une durée spécifiée suivi d'un nettoyage pour éliminer les produits de corrosion et d'un poids de la pièce pour déterminer la perte de poids. La vitesse de corrosion (R) est calculé comme
- R = kW / (ρAt)
où k est une constante, W est la perte de poids du métal dans le temps t, A est l'aire de surface du métal exposé, et ρ est la densité du métal (en g / cm³).
Impact économique

En 2002, les États-Unis Federal Highway Administration a publié une étude intitulée coûts de la corrosion et les stratégies de prévention aux États-Unis sur les coûts directs associés à la corrosion métallique dans l'industrie américaine. En 1998, le coût direct annuel total de la corrosion dans les États-Unis était d'environ $ 276 000 000 000 (environ 3,2% des États-Unis produit intérieur brut ).
Rust est l'une des causes les plus fréquentes d'accidents de pont. Comme la rouille a un volume beaucoup plus élevé que la masse originaire de fer, de son accumulation peut également provoquer une insuffisance en forçant dehors parties adjacentes. Ce était la cause de l'effondrement de la Mianus pont de la rivière en 1983, lorsque les paliers rouillés interne et poussé un coin de la dalle de route de son support. Trois pilotes sur la chaussée au moment morts que la dalle est tombé dans la rivière en contrebas. Ce qui suit Enquête du NTSB a montré que un drain dans la route avait été bloquée pour la route re-surfaçage, et ne avait pas été débloqué; par conséquent, les eaux de ruissellement pénétré les crochets de support. Rust était également un facteur important dans la Silver Bridge désastre de 1967 à West Virginia , lorsqu'un acier pont suspendu se est effondré dans une minute, tuant 46 conducteurs et passagers sur le pont à l'époque.
De même, la corrosion de l'acier de béton couverte et fer peut provoquer le béton écaillage, créant de graves problèmes structurels. Ce est un des modes de défaillance les plus courantes de béton armé ponts . Instruments de mesure basé sur la potentiel de demi-cellule est capable de détecter les points de corrosion potentiels avant défaillance totale de la structure en béton est atteinte.
Jusqu'à il ya 20 à 30 ans; tuyaux en acier galvanisé a été largement utilisé dans les systèmes d'eau potable pour les résidents mono et multi-familiales ainsi que la construction commerciale et publique. Aujourd'hui, ces systèmes ont consommé la longue zinc et de protection sont corrosion résultant des défaillances à l'intérieur de mauvaise qualité de l'eau et de tuyaux. L'impact économique sur les propriétaires, les habitants des condos, et de l'infrastructure publique est estimé à 22 milliards de dollars que les accolades de l'industrie de l'assurance d'une vague de revendications en raison de défaillances de tuyaux.
Corrosion dans les non-métaux
Plus matériaux céramiques sont presque entièrement à l'abri de la corrosion. Les fortes liaisons chimiques qui les détiennent ensemble laissent très peu d'énergie chimique libre dans la structure; ils peuvent être considérés comme déjà corrodé. Lorsque la corrosion se produit, il est presque toujours un simple dissolution de la réaction du matériel ou chimique, plutôt que d'un processus électrochimique. Un exemple commun de protection contre la corrosion dans la céramique est le chaux ajoutée à la soude et de chaux verre pour réduire sa solubilité dans l'eau; si elle ne est pas aussi soluble que pur silicate de sodium, le verre normal ne former défauts sous-microscopiques lorsqu'ils sont exposés à l'humidité. En raison de sa fragilité, ces défauts provoquent une réduction spectaculaire de la force d'un objet en verre au cours de ses premières heures à la température ambiante.
La corrosion des polymères
dégradation du polymère implique plusieurs processus physico-chimiques complexes et souvent mal comprises. Ce sont étonnamment différent des autres processus est question ici, et ainsi le terme "corrosion" est appliquée seulement à eux dans un sens large du mot. En raison de leur poids moléculaire élevé, très peu d' entropie peut être obtenue par mélange d'une masse donnée de polymère avec une autre substance, ce qui les rend généralement très difficiles à dissoudre. Alors que la dissolution est un problème dans certaines applications de polymères, il est relativement simple de concevoir contre. Un problème plus général et relatives est un gonflement, où de petites molécules infiltrer la structure, réduisant la force et de la rigidité et de provoquer un changement de volume. Inversement, de nombreux polymères (notamment souple vinyle) sont intentionnellement gonflé avec des plastifiants, qui peuvent être lessivés de la structure, ce qui provoque une fragilité ou d'autres changements indésirables. La forme la plus courante de dégradation est toutefois une diminution de la longueur de la chaîne polymère. Mécanismes qui brisent les chaînes polymères sont familiers aux biologistes en raison de leur effet sur l'ADN : les rayonnements ionisants (le plus souvent ultraviolet lumière), radicaux libres, et les oxydants tels que l'oxygène, l'ozone et chlore . craquage d'ozone est un problème bien connu qui affecte caoutchouc naturel par exemple. Additifs peuvent ralentir ce processus très efficace, et peut être aussi simple qu'un absorbant les UV pigment (c.-à- le dioxyde de titane ou noir de carbone). Les sacs en plastique, souvent, ne comprennent pas ces additifs afin qu'ils se décomposent plus facilement que la litière .
La corrosion des verres

Verre maladie est la corrosion des verres de silicate à des solutions aqueuses. Elle est régie par deux mécanismes: lixiviation (échange d'ions) contrôlée par la diffusion et la dissolution du réseau hydrolytique du verre. Les deux mécanismes dépendent fortement du pH de la solution en contact: le taux d'échange d'ions diminue avec pH 10 -0.5pH alors que le taux de dissolution d'hydrolyse augmente avec le pH de 10 0,5 pH.
Mathématiquement, les taux de lunettes de corrosion sont caractérisés par des taux de corrosion normalisés des éléments N ° I (g / cm 2 · d) qui sont déterminés comme étant le rapport de la quantité totale des espèces rejetées dans l'eau M i (g) de la surface de contact avec l'eau aire S (cm 2), temps de contact t (jours) et la fraction de poids de l'élément contenu dans le verre f i:
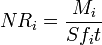 .
.
Le taux de corrosion globale est une somme de contributions des deux mécanismes (lessivage + dissolution) NR i = i + Nrx NRH. Diffusion contrôlée lixiviation (échange d'ions) est caractéristique de la phase initiale de corrosion et implique le remplacement d'ions alcalins dans le verre par un hydronium (H 3 O +) ionique de la solution. Il provoque une diminution sélective d'ions de couches de verres proches de la surface et donne une fonction de racine carrée inverse de la vitesse de corrosion en fonction du temps d'exposition. Le taux de lixiviation normalisé contrôlée par diffusion de cations de lunettes (g / cm 2 · d) est donnée par:
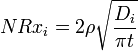 ,
,
où t est le temps, D i est le cation coefficient i-ième efficace de diffusion (cm2 / d), qui dépend du pH de l'eau en contact comme D i = D i0 · 10 -pH, et ρ est la densité du verre ( g / cm 3).
dissolution du réseau de verre est caractéristique des phases ultérieures de la corrosion et provoque un dégagement d'ions conforme à la solution d'eau à une vitesse indépendante du temps dans des solutions diluées (g / cm 2 · d):
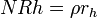 ,
,
où R h est à l'arrêt hydrolyse (la dissolution) Taux du verre (cm / j). Dans les systèmes fermés de la consommation de protons à partir de la phase aqueuse augmente le pH et provoque une transition rapide à l'hydrolyse. Cependant, une autre solution de saturation de la silice empêche l'hydrolyse et provoque le verre pour revenir à un échange d'ions, par exemple régime de diffusion contrôlée de corrosion.
Dans les conditions naturelles typiques taux de corrosion normalisées de verres de silicates sont très faibles et sont de l'ordre de 10 -7 -10 -5 g / (cm 2 · d). La durabilité très élevé de verres de silicate dans l'eau les rend appropriés pour l'immobilisation de déchets dangereux et nucléaires.
Essais de corrosion en verre

Il existe de nombreuses procédures normalisées pour la mesure de la corrosion (également appelée résistance chimique) des verres dans des environnements neutres, basiques et acides, dans des conditions d'environnement simulées, dans un fluide corporel simulé, à haute température et de pression, et dans d'autres conditions.
La procédure standard ISO 719 décrit un test de l'extraction de composés basiques solubles dans l'eau dans des conditions neutres: 2 g de verre, la taille de particule de 300 à 500 um, est maintenue pendant 60 min dans 50 ml d'eau désionisée de grade 2 à 98 ° C; 25 ml de la solution obtenue est titré à 0,01 mol / l HCl solution. Le volume de HCl nécessaire pour la neutralisation est classé selon le tableau ci-dessous.
| Montant de HCl 0,01 M nécessaire pour neutraliser les oxydes de base extraites, ml | Extrait Na 2 O équivalent, ug | Hydrolyse classe |
|---|---|---|
| <0,1 | <31 | 1 |
| 0,1-0,2 | 31-62 | 2 |
| 0,2 à 0,85 | 62-264 | 3 |
| 0,85 à 2,0 | 264-620 | 4 |
| 2,0 à 3,5 | 620-1085 | 5 |
| > 3,5 | > 1085 | > 5 |

