
Magnésium
Contexte des écoles Wikipédia
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. parrainage SOS enfant est cool!
| Magnésium | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
12 Mg | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
brillant solide gris  Raies spectrales de magnésium | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | magnésium, Mg, 12 | ||||||||||||||||||||||||
| Prononciation | / m æ ɡ n Je z Je ə m / pleur NEE -zee-əm | ||||||||||||||||||||||||
| Élément Catégorie | métal alcalino-terreux | ||||||||||||||||||||||||
| Groupe, période, bloc | 2 (métaux alcalino-terreux) , 3, s | ||||||||||||||||||||||||
| Poids atomique standard | 24,3050 (6) | ||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3s 2 2, 8, 2 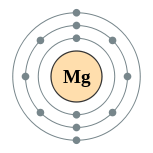 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Découverte | Joseph Black (1755) | ||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1808) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Densité (à proximité rt) | 1,738 g · cm -3 | ||||||||||||||||||||||||
| Liquid densité au mp | 1,584 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | 923 K , 650 ° C, 1202 ° F | ||||||||||||||||||||||||
| Point d'ébullition | 1363 K, 1091 ° C, 1994 ° F | ||||||||||||||||||||||||
| La chaleur de fusion | 8,48 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 128 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | 24,869 J · mol -1 · K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 2, 1 (Fortement oxyde de base) | ||||||||||||||||||||||||
| Électronégativité | 1,31 (échelle de Pauling) | ||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 737,7 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 1450,7 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 7732,7 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon atomique | 160 h | ||||||||||||||||||||||||
| Rayon covalente | 141 ± 19 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 173 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 43,9 nΩ · m | ||||||||||||||||||||||||
| Conductivité thermique | 156 W · m -1 · K -1 | ||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 24,8 um · m -1 · K -1 | ||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (recuit) 4940 m · s -1 | ||||||||||||||||||||||||
| Le module d'Young | 45 GPa | ||||||||||||||||||||||||
| Module de cisaillement | 17 GPa | ||||||||||||||||||||||||
| Module Bulk | 45 GPa | ||||||||||||||||||||||||
| Coefficient de Poisson | 0,290 | ||||||||||||||||||||||||
| Dureté Mohs | 2,5 | ||||||||||||||||||||||||
| Dureté Brinell | 260 MPa | ||||||||||||||||||||||||
| Numéro de registre CAS | 7439-95-4 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes du magnésium | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Le magnésium est un élément chimique avec le symbole Mg et le nombre atomique 12. Son nombre d'oxydation commun est deux. Il se agit d'un métal alcalino-terreux et le huitième plus élément abondant dans la croûte terrestre et la neuvième dans le connu univers dans son ensemble. Le magnésium est le quatrième élément le plus commun dans la Terre dans son ensemble (derrière le fer, l'oxygène et le silicium), qui composent 13% de la masse de la planète et une grande partie du manteau de la planète. L'abondance relative de magnésium est lié au fait qu'il se appuie facilement dans supernovae étoiles à partir d'une addition séquentielle de trois noyaux d'hélium de carbone (qui à son tour est composé de trois noyaux d'hélium). En raison de la forte ion magnésium solubilité dans l'eau, ce est le troisième élément le plus abondant dissous dans l'eau de mer .
L'élément libre (métal) ne est pas présent naturellement sur Terre, tel qu'il est hautement réactif (mais une fois produite, elle est revêtue d'une couche mince d'oxyde (cf. passivation), qui masque en partie cette réactivité). Le métal libre brûle avec une lumière blanche brillante caractéristique, ce qui en fait un ingrédient utile dans des fusées éclairantes. Le métal est maintenant principalement obtenu par électrolyse de sels de magnésium obtenues à partir de la saumure. Commercialement, l'utilisation en chef pour le métal est comme un l'agent de faire alliage aluminium alliages de -Magnésium, parfois appelé magnalium ou magnelium. Comme le magnésium est moins dense que l'aluminium, ces alliages sont prisés pour leur relative légèreté et la force.
En la biologie humaine, le magnésium est le onzième élément le plus abondant en masse dans le corps humain. Ses ions sont essentiels à tous les vivants cellules , où ils jouent un rôle majeur dans la manipulation biologique importante composés de polyphosphate comme l'ATP , l'ADN , et ARN. Des centaines de enzymes nécessitent donc ions magnésium pour fonctionner. composés de magnésium sont utilisés en médecine comme commune laxatifs, antiacides (par exemple, lait de magnésie), et un certain nombre de situations où la stabilisation de anormale l'excitation nerveuse et des vaisseaux sanguins spasme est nécessaire (par exemple, pour traiter éclampsie). Les ions magnésium sont aigre au goût et à de faibles concentrations, ils contribuent à conférer un goût acidulé naturel de frais eaux minérales.
Dans la végétation, le magnésium est l'ion métallique au centre de chlorophylle, et ne est donc un additif courant pour les engrais .
Origine et caractéristiques
PROPRIETES physiques et chimiques
Magnésium élémentaire est un blanc argenté, métal léger plutôt forte (deux tiers de la densité de l'aluminium). Il ternit légèrement lorsqu'il est exposé à l'air, bien que contrairement aux métaux alcalins , un environnement exempt d'oxygène ne est pas nécessaire pour le stockage, car le magnésium est protégée par une fine couche d'oxyde qui est assez imperméable et difficile à enlever. Comme son plus faible périodique groupe voisin de table de calcium , de magnésium réagit avec l'eau à la température ambiante, mais il réagit beaucoup plus lentement que le calcium. Lorsque immergé dans l'eau, l'hydrogène bulles commencent presque imperceptible pour former sur la surface du métal sous forme de poudre, bien que, il réagit beaucoup plus rapidement. La réaction se produit plus rapidement avec des températures plus élevées (voir les précautions). La capacité de magnésium à réagir avec de l'eau peut être exploitée pour produire de l'énergie et de lancer un à base de magnésium du moteur. Le magnésium réagit de façon exothermique avec la plupart des acides, tels que l'acide chlorhydrique (HCl). Comme avec l'aluminium, le zinc et d'autres métaux, la réaction avec de l'acide chlorhydrique produit le chlorure d'hydrogène du gaz de métal et sorties.
Le magnésium est un très métallique inflammable, mais se il est facile pour se enflammer lorsqu'il poudre ou rasé en fines lanières, il est difficile de se enflammer dans la masse ou en vrac. Une fois allumé, il est difficile à éteindre, être capable de brûler dans l'azote (formant le nitrure de magnésium), le dioxyde de carbone (formant l'oxyde de magnésium et de carbone ) et d'eau (pour former l'oxyde de magnésium et d'hydrogène). Cette propriété a été utilisé dans les armes incendiaires utilisés dans le bombardement des villes de la Seconde Guerre mondiale , la seule pratique la défense civile étant d'étouffer une torche brûlant sous le sable sec d'exclure l'atmosphère. En brûlant dans l'air, de magnésium produit une lumière blanche brillante qui comprend forte ultraviolet. Ainsi, la poudre de magnésium ( poudre de flash) a été utilisé comme une source d'éclairage dans les premiers jours de la photographie . Plus tard, ruban de magnésium a été utilisé dans les ampoules flash allumage électrique. la poudre de magnésium est utilisé dans la fabrication de feux d'artifice et marine fusées où une lumière blanche brillante est nécessaire. Les températures de flamme des alliages de magnésium et de magnésium peuvent atteindre 3100 ° C (3370 K; 5610 ° F), bien que la hauteur de flamme au-dessus du métal brûlant est généralement inférieure à 300 mm (12 po). Le magnésium peut être utilisé en tant que source d'allumage pour thermite, une autrement difficiles à enflammer le mélange de poudre d'aluminium et d'oxyde de fer.
composés de magnésium sont généralement cristaux blancs. La plupart sont solubles dans l'eau, fournissant le magnésium goût sûr ions Mg 2+. De petites quantités d'ions de magnésium dissous contribuent à l'acidité et le goût des eaux naturelles. ion magnésium en grandes quantités est un laxatif ionique, et sulfate de magnésium (nom commun: le sel d'Epsom) est parfois utilisé à cette fin. Les soi-disant "lait de magnésie" est une suspension aqueuse de l'un des rares composés de magnésium insolubles, l'hydroxyde de magnésium. Les particules non dissoutes donnent lieu à son apparence et le nom. Lait de magnésie est un doux base couramment utilisée comme antiacide, qui a un certain effet secondaire laxatif.
Isotopes
Le magnésium a trois stables isotopes : 24 mg, 25 mg et 26 mg. Tous sont présents en quantités importantes (voir tableau des isotopes ci-dessus). Environ 79% de Mg est de 24 mg. L'isotope 28 Mg est radioactif et dans les années 1950 à 1970 a été faite dans le commerce par plusieurs centrales nucléaires pour un usage à des expériences scientifiques. Cet isotope a une demi-vie relativement courte (21 heures) et de sorte que son utilisation a été limitée par des temps de livraison.
26 Mg a trouvé une application dans isotopique géologie , semblable à celle de l'aluminium. 26 Mg est un produit de filiation radiogène de 26 Al, qui a une demi-vie de 717.000 années. Grands enrichissements de stable 26 Mg ont été observés dans le Ca-Al-riches inclusions de certains chondrite carbonée météorites. L'abondance anormale du 26 Mg est attribuée à la désintégration de la société mère 26 Al dans les inclusions. Par conséquent, la météorite doit avoir formé dans le nébuleuse solaire avant la 26 Al avait pourri. Par conséquent, ces fragments sont parmi les plus anciens objets dans le système solaire et ont conservé des informations sur son histoire au début.
Il est classique de tracer 26 Mg / Mg 24 contre un rapport Al / Mg. Dans un isochrone datant intrigue, le rapport Al / Mg est tracée 27 Al / 24 mg. La pente de la isochrone n'a pas de signification d'âge, mais indique la première 26 Al / Al 27 dans l'échantillon au moment où les systèmes ont été séparés à partir d'un réservoir commun.
Création
Le magnésium est produit dans les étoiles de plus de 3 masses solaires par fusion de l'hélium et de néon dans le processus d'alpha à des températures supérieures à 600 megakelvins.
Occurrence
| Pays | La production 2010 ( tonnes) |
|---|---|
| Chine | 650000 |
| Russie | 40000 |
| Israël | 30000 |
| Kazakhstan | 20000 |
| Brésil | 16000 |
| Ukraine | 2000 |
| Serbie | 2000 |
Bien que le magnésium est présent dans plus de 60 minéraux , seulement dolomite, magnésite, brucite, carnallite, le talc , et olivine sont d'une importance commerciale.
Le Mg 2+ cation est le cation deuxième plus abondant dans l'eau de mer (se produisant à environ 12% de la masse de sodium y), ce qui rend l'eau de mer et le sel marin une source commerciale attractive de Mg. Pour extraire le magnésium, l'hydroxyde de calcium est ajouté à l'eau de mer pour former l'hydroxyde de magnésium précipiter.
- MgCl 2 + Ca (OH) 2 → Mg (OH) 2 + CaCl2
l'hydroxyde de magnésium ( brucite) est insoluble dans l'eau de sorte qu'il peut être séparé par filtration, et mis à réagir avec de l'acide chlorhydrique concentré pour obtenir chlorure de magnésium.
- Mg (OH) 2 + HCl → 2 MgCl 2 + 2 H 2 O
À partir de chlorure de magnésium, l'électrolyse de magnésium produit.
Au Etats-Unis , le magnésium est principalement obtenu par l'électrolyse de chlorure de magnésium fondu à partir de saumures, puits et l'eau de mer . Au cathode, les ions Mg 2+ est réduite de deux électrons au métal de magnésium:
- Mg 2+ + 2 e - → Mg
Au anode, chaque paire d'ions Cl - est oxydé en chlore gazeux, en libérant deux électrons pour compléter le circuit:
- 2 Cl - → Cl 2 (g) + 2 e -
Les États-Unis ont toujours été le principal fournisseur mondial de ce métal, fournissant 45% de la production mondiale, même aussi récemment qu'en 1995. Aujourd'hui, la part de marché des États-Unis est à 7%, avec un seul producteur national à gauche, US Magnesium, un Société Renco Group Utah né à partir de maintenant défunte Magcorp.
En 2005, la Chine a pris le relais en tant que fournisseur dominant, arrimé à 60% de part de marché mondial, qui est passée de 4% en 1995. Contrairement à la ci-dessus décrit procédé électrolytique, la Chine est presque complètement dépendants d'un autre méthode d'obtenir le métal de ses minerais, le silicothermique Processus Pidgeon (la réduction de l'oxyde à des températures élevées avec le silicium).
Histoire

Le nom de magnésium provient du grec mot pour un district Thessalie appelé Magnésie. Elle est liée à magnétite et de manganèse , qui a également son origine à partir de cette zone, et la différenciation nécessaire que les substances séparées. Voir le manganèse pour cette histoire.
Le magnésium est le huitième élément le plus abondant dans la croûte de la Terre en masse et à égalité en septième place avec le fer en termes de molarité. Il se trouve dans de grands gisements de magnésite, dolomite, et d'autres minéraux , et dans les eaux minérales, où l'ion magnésium est soluble. En 1618, un agriculteur à Epsom en Angleterre a tenté de donner son vaches eau d'un puits là. Les vaches ont refusé de boire parce goût amer de l'eau, mais l'agriculteur remarqué que l'eau semblait guérir rayures et les éruptions cutanées. La substance est devenu connu comme Sels d'Epsom et sa renommée se répandit. Il a finalement été reconnu comme le sulfate de magnésium hydraté, MgSO 4 · 7 H 2 O.
Le métal lui-même a été produit la première fois par Sir Humphry Davy en Angleterre en 1808. Il a utilisé électrolyse sur un mélange de magnésie et l'oxyde mercurique. Antoine Bussy préparé en forme cohérente en 1831. première suggestion de Davy pour un nom était magnium, mais le nom de magnésium est maintenant utilisé.
Applications
Comme métal

Le magnésium est le troisième métal structural le plus couramment utilisé, à la suite de fer et d'aluminium. Il a été appelé le plus léger métal utile en Le tableau périodique des vidéos.
Les principales applications de magnésium sont, dans l'ordre: composante des alliages d'aluminium, dans le moulage sous pression (allié avec du zinc ), à supprimer le soufre dans la production du fer et de l'acier, la production de titane dans le Procédé Kroll.
Magnésium, dans sa forme la plus pure, peut être comparé à l'aluminium, et est solide et léger, il est utilisé dans plusieurs applications de fabrication de pièces à haut volume, y compris les composants automobiles et de camions. Spécialité, des roues de voiture de haute qualité en alliage de magnésium sont appelés " mag wheels ", bien que le terme est souvent mal appliqué plus largement pour inclure des roues en aluminium.
La haute teneur en magnésium utilisé pour le carter de la fin de la Seconde Guerre mondiale Moteur de l'aviation radiale de dix-huit cylindres Wright Duplex Cyclone était un grave problème pour les premiers exemples de la Boeing B-29 bombardier lourd, comme les incendies de moteur en vol pourraient définir les carters moteur allumé, littéralement "incendier" l'aile longeron à part dans le cadre d'un échec de l'aile minute provoquant.
Un précédent Mercedes-Benz modèle de voiture de course, le Mercedes-Benz 300 SLR, avait un corps fait de Elektron, un alliage de magnésium; ces voitures ont couru (avec succès) à Le Mans, le Mille Miglia, et d'autres événements de course de classe mondiale en 1955 (si l'on a été impliqué dans le seule pire accident dans l'histoire de la course automobile, en termes de pertes en vies humaines, au Mans.) tous azimuts la quête de Porsche pour diminuer le poids de leurs voitures de course a conduit à l'utilisation de cadres en alliage de magnésium dans le célèbre 917/053 qui a remporté Le Mans en 1971, et détient toujours le record de distance absolue.
Volkswagen Group a utilisé du magnésium dans ses composants du moteur pendant de nombreuses années. Depuis longtemps, Porsche utilisé en alliage de magnésium pour son blocs en raison de l'avantage en poids du moteur. Il ya un regain d'intérêt dans les blocs moteurs en alliage de magnésium, tel que présenté dans le 2006 BMW 325i et 330i modèles.
Le moteur BMW utilise un insert en alliage d'aluminium pour les parois du cylindre et les manchons de refroidissement entourés d'un alliage de magnésium AJ62A à haute température.
L'application d'un alliage de magnésium dans AE44 de la Corvette 2006 Z06 berceau moteur a avancé la technologie de conception de pièces automobiles robustes en magnésium. Ces deux alliages sont les développements récents en haute basse température au fluage des alliages de magnésium.
Mitsubishi Motors utilise aussi du magnésium (alliage de magnésium de marque) pour ses palettes. La stratégie générale pour ces alliages est de former intermétallique précipite à la joints de grains, par exemple en ajoutant mischmétal ou calcium . Développement d'alliages nouveaux et de réduire les coûts qui font magnésium concurrentiel avec de l'aluminium va augmenter le nombre d'applications automobiles.

Le deuxième champ d'application de magnésium est dispositifs électroniques. En raison de son faible poids, de bonnes propriétés mécaniques et électriques, le magnésium est largement utilisé pour la fabrication de téléphones portables, ordinateur portable et les ordinateurs tablettes, les caméras et autres composants électroniques.
Historiquement, le magnésium est l'un des principaux métaux de construction aérospatiale et a été utilisé pour les avions militaires allemands dès la Première Guerre mondiale et largement avec les avions allemands de la Seconde Guerre mondiale.
Les Allemands ont inventé le nom " Elektron 'elles sont en alliage de magnésium. Le terme est encore utilisé aujourd'hui. L'application de magnésium dans l'industrie de l'aérospatiale commerciale est généralement limitée à moteur liées composantes, dues soit à des risques perçus avec des pièces de magnésium dans le cas d'incendie ou de la corrosion. Actuellement, l'utilisation des alliages de magnésium dans l'aérospatiale est en augmentation, principalement tirée par l'importance croissante de l'économie de carburant et la nécessité de réduire le poids. Le développement et le test de nouveaux alliages de magnésium continue, notamment Elektron 21, qui a subi avec succès des tests approfondis de l'aérospatiale pour aptitude dans les composantes des moteurs, internes et de la cellule. La Communauté européenne gère trois projets de magnésium R & D dans la priorité aérospatiales du Programme-cadre Six.
Niche utilise du métal
Le magnésium, en étant facilement disponible et relativement non toxique, a une variété d'utilisations:
- Le magnésium est inflammable, la combustion à une température d'environ 3100 ° C (3370 K; 5610 ° F), et le température d'auto-allumage de ruban de magnésium est d'environ 473 ° C (746 K; 883 ° F). Il produit intense lumineux, la lumière, blanc quand il brûle. Température de combustion élevée de magnésium en fait un outil utile pour allumer des feux d'urgence pendant loisirs de plein air. D'autres utilisations incluent éclair photographie , des fusées éclairantes, pyrotechniques et de feux d'artifice feux de Bengale. Le magnésium est également souvent utilisé pour enflammer thermite, ou d'autres matériaux qui nécessitent une haute température d'allumage.
 Magnésium Firestarter (dans la main gauche), utilisé avec un couteau de poche et silex pour créer des étincelles qui enflamment les copeaux
Magnésium Firestarter (dans la main gauche), utilisé avec un couteau de poche et silex pour créer des étincelles qui enflamment les copeaux
- Dans la forme de tournures ou de rubans, de préparer Des réactifs de Grignard, qui sont utiles dans synthèse organique.
- Comme agent additif dans des agents propulseurs conventionnels et la production de nodulaire en fonte.
- Comme un agent réducteur pour la production d' uranium et d'autres métaux à partir de leur sels.
- Comme un sacrificielle (galvanique) anode pour protéger les réservoirs souterrains, les pipelines, structures enterrées, et chauffe-eau.
- Allié de zinc pour produire la feuille de zinc utilisé dans photogravure plaques dans l'industrie de l'impression, sèche-cellulaire murs de la batterie, et toiture.
- En tant que métal, utilisation principale de cet élément est comme additif d'alliage d'aluminium avec ces alliages aluminium-magnésium utilisés principalement pour canettes de boissons.
Dans les composés de magnésium
composés de magnésium, principalement l'oxyde de magnésium (MgO), sont utilisés en tant que en matériau réfractaire revêtements de fours pour la production de fer , l'acier , métaux non ferreux, verre et ciment. L'oxyde de magnésium et d'autres composés de magnésium sont également utilisés dans les industries agricoles, chimiques, et de la construction.
Le magnésium réagit avec un halogénure d'alkyle donne un Réactif de Grignard, qui est un outil très utile pour la préparation d' alcools .
Dans l'agriculture et de la biologie, l'ion magnésium est nécessaire pour toute la vie (voir en biologie magnésium), de sorte que les sels de magnésium sont souvent inclus dans divers aliments , des engrais (magnésium est un composant de chlorophylle), et milieux de culture.
Niche et illustratives utilisations des composés de magnésium
Biologique
Les préparations pharmaceutiques de magnésium sont utilisés pour traiter la carence en magnésium et hypomagnésémie, ainsi que éclampsie. Habituellement, dans des doses plus faibles, le magnésium est couramment inclus dans préparations minérales alimentaires, y compris de nombreux préparations de multivitamines.
Triés par type de sel de magnésium, applications biologiques de magnésium comprennent:
- Le sulfate de magnésium, comme le heptahydraté appelés sels d'Epsom, est utilisé comme sels de bain, comme un laxatif et comme hautement soluble engrais .
- L'hydroxyde de magnésium, en suspension dans l'eau, est utilisé en magnésie hydratée antiacides et laxatifs.
- Le chlorure de magnésium, oxyde, gluconate, le malate, l'orotate, le glycinate et citrate sont tous utilisés comme suppléments de magnésium par voie orale. Certains ont prétendu que les suppléments de magnésium par voie orale sont thérapeutique pour Syndrome des jambes sans repos (SJSR) chez certains individus.
- Borate de magnésium, le salicylate de magnésium, et du sulfate de magnésium sont utilisés comme antiseptiques.
- le bromure de magnésium est utilisé comme un doux sédatif (cette action est due à la bromure, et non le magnésium).
- Le stéarate de magnésium est un peu inflammable blanc poudre avec propriétés lubrifiantes. Dans pharmaceutique technologie, il est utilisé dans la fabrication de nombreux types de comprimés pour empêcher les comprimés de se coller à l'équipement au cours du processus de compression de comprimés (par exemple, lorsque la substance du comprimé est pressé dans la forme de comprimé).
- poudre de carbonate de magnésium est utilisé par les athlètes comme les gymnastes , haltérophiles et grimpeurs pour éliminer l'humidité et l'amélioration de l'adhérence sur un appareil de gymnastique, soulevant bar et rochers d'escalade.
Non biologique
- Magnésite calcinée à mort ( oxyde de magnésium) est utilisé à des fins réfractaires tels que la brique et les chemises dans des fours et des convertisseurs.
L'oxyde de magnésium à partir calcination est utilisé comme isolant électrique dans câbles résistants au feu.
- Sulfite de magnésium est utilisé dans la fabrication de papier ( processus sulfite).
- le phosphate de magnésium est utilisé à l'épreuve du feu de bois utilisé dans la construction.
- Hexafluorosilicate de magnésium est utilisé dans le traitement antimite des textiles .
- Dans la forme de tournures ou de rubans, Mg est utile dans la purification de solvants , par exemple la préparation d'éthanol super-sec
Rôle biologique
En raison de l'interaction importante entre des ions phosphate et de magnésium, des ions magnésium sont essentiels à la base chimie des acides nucléiques de la vie, et donc sont essentiels pour toutes les cellules de tous les organismes vivants connus. Plus de 300 enzymes nécessitent la présence d'ions magnésium pour leur action catalytique, y compris toutes les enzymes de synthèse ou en utilisant de l'ATP , ou ceux qui utilisent d'autres nucléotides pour synthétiser l'ADN et ARN. ATP existe dans les cellules normalement en tant que chelate d'ATP et d'un ion magnésium.
Plantes ont une utilisation supplémentaire pour le magnésium dans ce chlorophylles sont le magnésium-centrée porphyrines. Une carence en magnésium dans les plantes provoque en fin de saison jaunissement entre les nervures des feuilles, en particulier dans les vieilles feuilles, et peut être corrigé par l'application Sels d'Epsom (qui est rapidement lixivié), ou bien écrasé dolomitique calcaire au sol.

Le magnésium est un élément essentiel d'un régime alimentaire humain sain. Carence en magnésium humaine (y compris les conditions qui montrent peu de symptômes manifestes) est relativement rare bien que seulement 32% des personnes aux États-Unis répondent à la RDA-DRI; de faibles niveaux de magnésium dans le corps a été associée à l'élaboration d'un certain nombre de maladies humaines telles que l'asthme , le diabète , et l'ostéoporose. Pris dans le magnésium quantité appropriée joue un rôle dans la prévention des AVC et de crise cardiaque. Les symptômes des personnes atteintes de fibromyalgie, les migraines, et les filles en passant par leur syndrome prémenstruel sont moins sévères et le magnésium peuvent raccourcir la durée des symptômes de la migraine.
Corps humains adultes contiennent environ 24 grammes de magnésium, avec 60% dans le squelette, 39% intracellulaire (20% dans le muscle squelettique), et 1% extracellulaire. Les taux sériques sont généralement de 0,7 à 1,0 mmol / L ou 1.8 à 2.4 mEq / L. Les niveaux sériques de magnésium peuvent sembler normaux, même en cas de carence intracellulaire sous-jacente, même si aucun mécanisme connu maintient un niveau homéostatique dans le sang autre que l'excrétion rénale des taux sanguins élevés.
Magnésium intracellulaire est corrélée avec intracellulaire du potassium . Le magnésium est absorbé dans le tractus gastro-intestinal, avec plus absorbé lorsque l'état est plus faible. Chez l'homme, le magnésium semble faciliter calcium absorption. L'apport de magnésium absorption inhibition de protéine basse et haute, et d'autres facteurs tels que phosphate, phytate, et graisses affecte l'absorption. Magnésium alimentaire absorbé est largement excrété par l'urine, bien que la plupart magnésium "administré par voie orale" est excrété dans les fèces. état de magnésium peut être évaluée approximativement à travers le sérum et les concentrations de Mg érythrocytaires et excrétion urinaire et fécale, mais les tests de chargement de magnésium par voie intraveineuse sont probablement le plus précis et pratique dans la plupart des gens. Dans ces essais, le magnésium est injecté par voie intraveineuse; une rétention de 20% ou plus indique une carence. Autres carences en éléments nutritifs sont identifiés grâce biomarqueurs, mais aucun ne est mis en place pour le magnésium.
Épices, noix, les céréales, le café, le cacao, le thé et les légumes sont riches en magnésium. Légumes à feuilles vertes tels que les épinards sont également riches en magnésium car ils contiennent de la chlorophylle. Observations de l'apport en magnésium alimentaire réduite dans les pays occidentaux modernes par rapport aux générations précédentes peuvent être liés à l'affinage de la nourriture et des engrais modernes qui ne contiennent pas magnésium.
Nombreux préparations pharmaceutiques de magnésium, ainsi que du magnésium compléments alimentaires sont disponibles. L'oxyde de magnésium, l'une des formes les plus courantes dans les compléments alimentaires de magnésium, car il a une teneur élevée en magnésium par poids, a été rapporté le moins biodisponible. Le citrate de magnésium a été rapporté comme plus biodisponible que l'oxyde ou l'acide amino-chélate (glycinate) formes.
Magnésium en excès dans le sang est librement filtrée à les reins, et pour cette raison il est difficile de faire une overdose de magnésium à partir des seules sources alimentaires. Avec suppléments, surdosage est possible, cependant, en particulier chez les personnes ayant une fonction rénale pauvres; de temps en temps, avec l'utilisation de doses élevées de cathartiques sels de magnésium, de graves hypermagnésémie a été signalé à se produire même sans dysfonction rénale. L'alcoolisme peut produire une carence en magnésium, qui est facilement inversée par administration orale ou parenterale, en fonction du degré de carence.
Détection dans des fluides biologiques
concentrations de magnésium dans le plasma ou le sérum peut être mesurée pour surveiller l'efficacité et la sécurité chez ceux recevant le médicament thérapeutique, pour confirmer le diagnostic chez les victimes d'empoisonnement potentiels ou pour aider à l'enquête médico-légale dans un cas de surdosage fatal. Les enfants nés de mères qui ont reçu du sulfate de magnésium parentérale pendant le travail peuvent présenter une toxicité à des niveaux sériques de magnésium qui ont été considérées comme appropriées pour les mères.
Magnésium dans la dépression résistante au traitement (TRD)
Il ya eu des spéculations que la carence en magnésium peut conduire à la dépression. Liquide céphalo-rachidien (LCR) magnésium cérébrale a été trouvé faible en dépression suicidaire résistant au traitement et chez les patients qui ont tenté de se suicider. magnésium cerveau a été trouvé faible en TRD en utilisant la spectroscopie de résonance magnétique nucléaire de phosphore, un moyen précis pour mesurer cerveau magnésium. Sang et CSF magnésium ne semblent pas bien corrélés avec la dépression majeure. Le chlorure de magnésium à des doses relativement faibles a été trouvé comme efficace dans le traitement de la dépression de type 2 âgés diabétiques avec une hypomagnésémie comme l'imipramine 50 mg par jour.
Dans la maladie de magnésium
Les résultats d'une méta-analyse d'essais cliniques randomisés ont démontré que la supplémentation en magnésium abaisse la pression artérielle de manière dose-dépendante. Faible taux de magnésium sérique sont associés à syndrome métabolique, le diabète sucré de type 2 et l'hypertension . Faible taux de magnésium sérique ont été associés à un risque plus élevé de développer un syndrome métabolique. la thérapie de magnésium est recommandé par l'ACC / AHA / ESC lignes directrices de 2006 pour la gestion des patients atteints Arythmies ventriculaires et la prévention de la mort subite cardiaque chez les patients atteints ventriculaire associée à l'arythmie torsade de pointes qui se présentent avec syndrome du QT long, ainsi que pour le traitement des patients avec des arythmies induites par l'intoxication à la digoxine. Le magnésium est également le médicament de choix dans la direction de pré-éclampsie et éclampsie.
Outre son rôle thérapeutique, le magnésium a un effet bénéfique supplémentaire sur calcification. Les patients atteints de maladie rénale chronique ont une forte prévalence de la calcification vasculaire, et maladies cardiovasculaires sont la principale cause de décès dans cette population. Plusieurs études in vitro et animales pointent vers un rôle de protection du magnésium par des mécanismes moléculaires multiples. Le magnésium est un antagoniste du calcium naturel et les deux études humaines et animales ont montré que le faible taux circulants de magnésium sont associés à la calcification vasculaire. Les résultats d'une étude observationnelle menée dans la population générale japonaise démontré que les taux sériques de magnésium inférieurs étaient significativement et indépendamment associés à une épaisseur intima-média moyenne supérieure et le risque d'au moins deux plaques carotidiennes. Une supplémentation en magnésium pourrait être utile dans la réduction de la progression de l'athérosclérose chez les patients dialysés chroniques. Magnésium sérique faible peut être un facteur de risque indépendant de décès chez les patients atteints de maladie rénale chronique, et les patients avec des niveaux de magnésium de sérum légèrement élevée pourrait avoir un avantage de survie par rapport à ceux avec les niveaux de magnésium inférieurs.
Consignes de sécurité pour le métal de magnésium
Le magnésium métal et ses alliages sont des risques d'explosion; ils sont hautement inflammables dans leur forme pure à l'état fondu ou en poudre ou sous forme de ruban. Brûler ou en métal de magnésium fondu réagit violemment avec l'eau. Lorsque vous travaillez avec du magnésium en poudre, des lunettes de sécurité avec le soudage des lunettes de protection sont employés, parce que la lumière blanche produite par la combustion du magnésium contient ultraviolet lumière qui peut endommager de façon permanente les rétines des yeux.
Le magnésium est capable de réduire l'eau à très inflammable hydrogène du gaz:
- Mg (s) + 2 H 2 O (l) → Mg (OH) 2 (s) + H 2 (g)
En conséquence, l'eau ne peut pas éteindre les feux de magnésium. Le gaz d'hydrogène produit ne fait qu'intensifier le feu. Sable sec est un agent d'étouffement efficace, mais uniquement sur des surfaces relativement de niveau et plane.
Le magnésium réagit également avec le dioxyde de carbone pour former de l'oxyde de magnésium et de carbone :
- 2 Mg (s) + CO 2 → 2 MgO (s) + C (s)
donc, dioxyde de carbone extincteurs ne peuvent pas être utilisés pour éteindre les incendies de magnésium soit.
Brûler magnésium est généralement désactivée par l'aide d'un Classe D extincteur chimique, ou en couvrant le feu avec du sable ou de la fonderie de magnésium flux pour éliminer la source de l'air.

