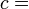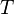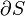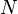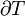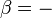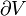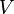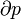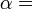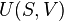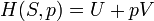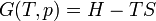Introdução de entropia
Informações de fundo
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Visite o site da SOS Children at http://www.soschildren.org/
| Termodinâmica | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 O motor de calor de Carnot clássico | |||||||||||||||||||||
Ramos | |||||||||||||||||||||
Sistemas Estado: Equação de estado Gás Ideal · Gás real Fase de matéria · Equilíbrio Controle o volume · Instruments Processos: Isobaric · Isocórico · Isotérmico Adiabatic · Isentrópico · Isentálpica Quasiestático · Politrópica Expansão livre Reversibilidade · Irreversibilidade Endoreversibility Ciclos: Motores de calor · Bombas de calor A eficiência térmica | |||||||||||||||||||||
Propriedades do sistema Diagramas de propriedade Propriedades intensivas e extensivas Funções do estado: Temperatura / Entropy (intro). † Pressão / Volume † Potencial químico / Partículas não. † († Variáveis conjugado) Qualidade Vapor Propriedades Reduzidas Funções do processo: Trabalho · Calor |
|||||||||||||||||||||
As propriedades dos materiais
| |||||||||||||||||||||
Equações Teorema de Carnot · Teorema Clausius · Relação fundamental · Lei dos gases ideais · Relações de Maxwell · Relações recíprocas Onsager · Equações termodinâmicas de Bridgman Tabela de equações termodinâmicas | |||||||||||||||||||||
Potenciais Energia livre · Entropia livre
| |||||||||||||||||||||
História e cultura Filosofia: A entropia e tempo · Entropia e vida Catraca Browniano Demônio de Maxwell Paradoxo morte de calor O paradoxo de Loschmidt Synergetics História: Geral · Calor · Entropia · Leis de gás Movimento perpétuo Teorias: Teoria do calórico · Vis viva Teoria do calor Equivalente mecânico do calor Força motriz Publicações: " Uma Experimental Investigação sobre ... Heat " " Sobre o Equilíbrio de Substâncias heterogêneas " "Reflexões sobre a Motive Power of Fire " Timelines de: Termodinâmica · Motores de calor Arte: Superfície termodinâmica de Maxwell Educação: Entropia como dispersão de energia | |||||||||||||||||||||
A entropia é uma medida de como a energia é distribuída uniformemente num sistema. Em um sistema de entropia física proporciona uma medida da quantidade de energia que não pode ser usado para fazer o trabalho .
Quando o calor flui a partir de uma região quente para uma região fria entropia aumenta, como o calor é distribuído por todo o sistema. O conceito de entropia é central para a segunda lei da termodinâmica . A segunda lei determina quais processos físicos podem ocorrer. Por exemplo, prevê que o calor flui do de alta temperatura a temperaturas baixas em processos espontâneos. A segunda lei da termodinâmica pode ser indicado como tendo dito que a entropia de um isolado sistema sempre aumenta, e processos que aumentam a entropia pode ocorrer espontaneamente. Desde entropia aumenta à medida que aumenta a uniformidade, a segunda lei diz qualitativamente que a uniformidade aumenta.
O termo foi cunhado entropia em 1865 pelo físico alemão Rudolf Clausius, das palavras gregas en-, "in" e trope "uma viragem", em analogia com energia .
Explicação
O conceito de entropia termodinâmica surge a partir da segunda lei da termodinâmica . Ele usa entropia para quantificar a capacidade de um sistema de mudança, ou seja, que os fluxos de calor a partir de uma região de temperatura mais elevada para uma temperatura mais baixa com, e para determinar se um processo termodinâmico pode ocorrer.
A entropia é definida por duas descrições, primeiro como macroscópica relação entre o fluxo de calor para um sistema e a mudança do sistema de temperatura e, por outro, a um nível microscópico, como o logaritmo natural do número de microestados de um sistema.
Seguindo o formalismo de Clausius, a primeira definição pode ser matematicamente indicado como:
Onde d S é a variação de entropia e q δ é o calor adicionado ao sistema reversível. Se a temperatura é deixada a diferenciação da equação deve ser integradas ao longo do caminho de temperatura. Esta definição de entropia não permite a determinação de um valor absoluto, apenas diferenças.
A segunda definição de entropia vem da mecânica estatística . A entropia de uma determinada macroestado é definido como sendo Boltzmann constante vezes o logaritmo natural do número de micro correspondente a esse macroestado, ou matematicamente
Onde S é a entropia, k é a constante de Boltzmann, e omega é o número de micro.
O macroestado de um sistema é o que nós sabemos sobre o sistema, por exemplo, a temperatura , pressão, e volume de um gás dentro de uma caixa. Para cada conjunto de valores de temperatura, pressão e volume existem muitos arranjos de moléculas que resultam nesses valores. O número de arranjos de moléculas que podem resultar nos mesmos valores de temperatura, pressão e volume é o número de micro-estados.
O conceito de energia está relacionada com a primeira lei da termodinâmica , que trata da conservação de energia e em que a perda de calor irá resultar numa diminuição na energia interna do sistema termodinâmico. A entropia termodinâmica fornece uma medida comparativa da quantidade de esta diminuição na energia interna do sistema eo correspondente aumento na energia interna do ambiente a uma dada temperatura. A visualização simples e mais concreto da segunda lei é que a energia de todos os tipos de mudanças que está sendo localizada para se tornar dispersa ou espalhar-se, se não for impedido de fazê-lo. Mudança de entropia é a medida quantitativa desse tipo de um processo espontâneo: quanta energia fluiu ou quão amplamente tornou-se espalhar a uma temperatura específica.
A entropia foi desenvolvido para descrever qualquer um dos vários fenómenos, dependendo do campo e o contexto no qual ele está a ser usado. Informações entropia leva os conceitos matemáticos de termodinâmica estatística em áreas de teoria da probabilidade não relacionada com o calor e energia.

Exemplo de aumentar a entropia
Derretimento do gelo fornece um exemplo em que a entropia aumenta em um pequeno sistema, um sistema termodinâmico, composto pelos arredores (o quarto quente) ea entidade de recipiente de vidro, gelo, água que foi deixada atingir equilíbrio termodinâmico à temperatura de fusão do gelo. Neste sistema, algum calor (δQ) a partir dos arredores mais quentes a 298 K (77 ° F, 25 ° C) transfere para o sistema de refrigeração de gelo e água à sua temperatura constante (T) de 273 K (32 ° F, 0 ° C), a temperatura de fusão do gelo. A entropia do sistema, que é δQ / t, aumenta em δQ / 273K. O δQ calor para este processo é a energia necessária para mudar a água a partir do estado sólido para o estado líquido, e é chamado o entalpia de fusão, ou seja, AH para a fusão do gelo.
É importante perceber que a entropia da sala circundante diminui menos do que a entropia das gelo e água aumenta: a temperatura ambiente de 298 K é superior a 273 K e, por conseguinte, a relação, (variação de entropia), de δQ / 298K durante o ambiente é menor do que a relação (variação de entropia), de δQ / 273K para o sistema de gelo e água. Isto é sempre verdadeiro em eventos espontâneos em um sistema termodinâmico e mostra a importância preditivo de entropia: a entropia líquido final após tal evento é sempre maior do que era a entropia inicial.
À medida que a temperatura da água fresca sobe para a do ambiente e o quarto mais arrefece imperceptivelmente, a soma do δQ / T sobre o intervalo contínuo ", em muitos incrementos", na água quente, inicialmente, finalmente arrefecer até pode ser encontrado cálculo. A miniatura inteira 'universo', ou seja, este sistema termodinâmico, aumentou em entropia. Energia tornou-se espontaneamente mais dispersa e espalhar-se pelo facto de "universo" do que quando o copo de gelo + água foi introduzida e tornou-se um "sistema" dentro dele.
Origens e usos
Originalmente, a entropia foi nomeado para descrever o calor residual, ou mais precisamente as perdas de energia, a partir de motores de calor e outros dispositivos mecânicos que nunca poderia correr com 100% de eficiência na conversão de energia para o trabalho. Mais tarde, o termo passou a adquirir vários descrições adicionais como mais veio a ser entendido sobre o comportamento das moléculas no nível microscópico. No final do século 19 a palavra "desordem" foi usado por Ludwig Boltzmann no desenvolvimento visualizações estatísticas de entropia usando a teoria da probabilidade para descrever o movimento molecular aumentado no nível microscópico. Isso foi antes de comportamento quântico veio a ser melhor compreendida por Werner Heisenberg e aqueles que seguiram. Descrições de termodinâmica (calor) entropia no nível microscópico são encontrados em termodinâmica estatística e mecânica estatística .
Para a maioria do século 20 livros tendiam a descrever a entropia como "desordem", na sequência de conceituação inicial de Boltzmann da energia motional de moléculas. Mais recentemente, tem havido uma tendência em livros didáticos de química e física para descrever a entropia em termos de "dispersão de energia". A entropia pode também envolver a dispersão de partículas, que são eles próprios energético. Assim, há casos em que ambas as partículas dispersam a energia e a velocidades diferentes quando as substâncias são misturadas em conjunto.
A matemática desenvolvidas em termodinâmica estatística foram encontrados para ser aplicável em outras disciplinas. Em particular, ciências da informação desenvolveu o conceito de entropia de informação onde uma constante substitui a temperatura que é inerente a entropia termodinâmica.
Calor e entropia
A um nível microscópico, a energia cinética das moléculas é responsável por a temperatura de uma substância ou de um sistema. "Calor" é a energia cinética das moléculas a ser transferida: quando a energia é transferida de motional ambiente mais quente para um sistema de refrigeração, as moléculas que se deslocam mais rapidamente no meio colidem com as paredes do sistema, que transfere alguma da sua energia para as moléculas do sistema e torna-los se mover mais rápido.
- Moléculas de um gás como azoto à temperatura ambiente, a qualquer instante estão se movendo a uma velocidade média de cerca de 500 milhas por hora (210 m / s), colidindo repetidamente e, portanto, a troca de energia de modo que suas velocidades individuais estão sempre mudando, mesmo sendo imóvel por um instante, se duas moléculas com exatamente a mesma velocidade colidem frontalmente, antes de uma outra molécula de bate-los e eles correm fora, tão rápido quanto 2500 milhas por hora. (Em temperaturas mais elevadas velocidades médias aumentar e energia motional torna-se proporcionalmente maior.)
- Energia molecular Assim motional ("energia térmica") a partir de um ambiente mais quente, como as moléculas se movendo mais rápido em uma chama ou violentamente vibrando átomos de ferro em uma placa quente, vai derreter ou ferver uma substância (o sistema) na temperatura do seu ponto de fusão ou ponto de ebulição . Essa quantidade de energia motional do meio envolvente que é necessária para a fusão ou ponto de ebulição é chamada de energia de mudança de fase, especificamente a entalpia de fusão ou de vaporização, respectivamente. Isso quebra de energia de mudança de fase ligações entre as moléculas no sistema (não ligações químicas no interior das moléculas que mantêm os átomos juntos) em vez de contribuir para a energia motional e fazer as moléculas se movem mais rápido - por isso não elevar a temperatura, mas em vez permite que as moléculas de se libertar a mover-se como um líquido ou como um vapor.
- Em termos de energia, quando um sólido torna-se um líquido ou um líquido a vapor, energia motional vindo dos arredores é alterada para "energia potencial" na substância (energia de mudança de fase, que é liberado de volta para o ambiente quando o ambiente se tornar mais frio de ebulição ou de fusão a temperatura da substância, respectivamente). Mudança de fase de energia aumenta a entropia de uma substância ou sistema, pois é a energia que tem de ser transmitida para fora do sistema a partir do ambiente de modo a que a substância pode existir como um líquido ou de vapor a uma temperatura acima do seu ponto de fusão ou ponto de ebulição. Quando este processo ocorre em um "universo" que consiste nos ambientes mais o sistema, a energia total do universo torna-se mais disperso ou espalhar-se como parte da maior energia que era apenas nos arredores transferências mais quentes, de modo que alguma é no sistema de refrigeração. Esta dispersão de energia aumenta a entropia do "universo".
O princípio geral importante é que "A energia de todos os tipos muda de ser localizado para se tornar dispersa ou espalhar-se, se não for impedido de fazê-lo. A entropia (ou melhor, alteração de entropia), é a medida quantitativa de que tipo de um processo espontâneo: a quantidade de energia ter sido transferida / T ou como amplamente Tornou-se espalhar a uma temperatura específica.
Cálculo clássico de entropia
Quando entropia foi definido pela primeira vez em 1865 e usado a própria existência de átomos ainda era controversa e não havia o conceito de que a temperatura foi devido à energia motional de moléculas ou que "calor" foi realmente a transferência dessa energia molecular motional de um lugar para outro. Mudança de entropia,  , Foi descrito em termos macroscópicos que pode ser medido directamente, tais como o volume, a temperatura ou a pressão. No entanto, hoje a equação clássica de entropia,
, Foi descrito em termos macroscópicos que pode ser medido directamente, tais como o volume, a temperatura ou a pressão. No entanto, hoje a equação clássica de entropia,  pode ser explicado, parte por parte, em termos modernos descrevem como as moléculas são responsáveis pelo que está acontecendo:
pode ser explicado, parte por parte, em termos modernos descrevem como as moléculas são responsáveis pelo que está acontecendo:
 é a mudança na entropia de um sistema (alguma substância física de juros) depois de um pouco de energia motional ("calor") foi transferido para ele por moléculas que se movem rapidamente. Assim,
é a mudança na entropia de um sistema (alguma substância física de juros) depois de um pouco de energia motional ("calor") foi transferido para ele por moléculas que se movem rapidamente. Assim,  .
.
- Em seguida,
 , O quociente da energia motional ("térmica") q que é transferido "reversivelmente" (rev) para o sistema a partir do ambiente (ou a partir de um outro sistema em contacto com o primeiro sistema) dividido por T, a temperatura absoluta em que a transferência ocorre.
, O quociente da energia motional ("térmica") q que é transferido "reversivelmente" (rev) para o sistema a partir do ambiente (ou a partir de um outro sistema em contacto com o primeiro sistema) dividido por T, a temperatura absoluta em que a transferência ocorre. - "Reversível" ou "reversivelmente" (rev) significa simplesmente que a T, a temperatura do sistema, tem que ficar (quase) exactamente a mesma, enquanto toda a energia está a ser transferido para ou a partir dele. É fácil no caso de mudanças de fase, onde o sistema absolutamente deve permanecer no estado sólido ou líquido até que a energia suficiente lhe é dado para quebrar as ligações entre as moléculas antes que possa mudar para um líquido ou um gás. Por exemplo na fusão de gelo a 273,15 K, não importa qual a temperatura do ambiente são - a partir de 273,20 K e 500 K, ou mesmo mais, a temperatura do gelo irá ficar a 273,15 K até que os últimos moléculas no gelo são alterados para líquidos água, ligações de hidrogênio ou seja, até que todas as ligações de hidrogênio entre as moléculas de água em gelo são quebrados eo novo, fixos menos exatamente entre as moléculas de água líquida são formadas. Esta quantidade de energia necessária para a fusão do gelo por mole foi encontrado para ser 6.008 joules a 273 K. Assim, a variação de entropia por mole é
 , Ou 22 J / K.
, Ou 22 J / K. - Quando a temperatura não está na fusão ou ponto de ebulição de uma substância nenhum vínculo quebra-intermoleculares é possível, e assim toda a energia molecular motional ("calor") do entorno transferidos para um sistema eleva a sua temperatura, tornando suas moléculas se movem mais rapidamente e mais rápido. À medida que a temperatura aumenta constantemente, já não existe um valor particular do "T", na qual a energia é transferida. No entanto, um "reversível" transferência de energia pode ser medida a um aumento muito pequeno da temperatura, e um total cumulativo pode ser encontrado através da adição de cada um dos diversos intervalos de temperatura ou pequenos incrementos. Por exemplo, para encontrar a variação de entropia
 a partir de 300 K a 310 K, medir a quantidade de energia transferida no dezenas ou centenas de incrementos de temperatura, digamos, de 300,00 K para 300,01 K e, em seguida, 300,01-300,02 e assim por diante, dividindo o q por cada T e, finalmente, a adição de todos eles.
a partir de 300 K a 310 K, medir a quantidade de energia transferida no dezenas ou centenas de incrementos de temperatura, digamos, de 300,00 K para 300,01 K e, em seguida, 300,01-300,02 e assim por diante, dividindo o q por cada T e, finalmente, a adição de todos eles. - Cálculo pode ser usado para fazer este cálculo mais fácil se o efeito da entrada de energia para o sistema é linearmente dependente da variação de temperatura, como em simples aquecimento de um sistema em moderadas a temperaturas relativamente elevadas. Assim, a energia a ser transferida "por alteração incremental na temperatura" (a capacidade de calor,
 ), Multiplicado pelo integrante de
), Multiplicado pelo integrante de  de
de  para
para  , É directamente determinada pela
, É directamente determinada pela  .
.
- "Reversível" ou "reversivelmente" (rev) significa simplesmente que a T, a temperatura do sistema, tem que ficar (quase) exactamente a mesma, enquanto toda a energia está a ser transferido para ou a partir dele. É fácil no caso de mudanças de fase, onde o sistema absolutamente deve permanecer no estado sólido ou líquido até que a energia suficiente lhe é dado para quebrar as ligações entre as moléculas antes que possa mudar para um líquido ou um gás. Por exemplo na fusão de gelo a 273,15 K, não importa qual a temperatura do ambiente são - a partir de 273,20 K e 500 K, ou mesmo mais, a temperatura do gelo irá ficar a 273,15 K até que os últimos moléculas no gelo são alterados para líquidos água, ligações de hidrogênio ou seja, até que todas as ligações de hidrogênio entre as moléculas de água em gelo são quebrados eo novo, fixos menos exatamente entre as moléculas de água líquida são formadas. Esta quantidade de energia necessária para a fusão do gelo por mole foi encontrado para ser 6.008 joules a 273 K. Assim, a variação de entropia por mole é
Descrições introdutórios de entropia
Tradicionalmente, livros do século 20 introduziram entropia como ordem e desordem de modo que ele fornece "uma medida da desordem ou aleatoriedade de um sistema". Tem sido argumentado que ambiguidades nos termos utilizados (como "desordem" e "caos") contribuem para a confusão generalizada e pode dificultar a compreensão de entropia para a maioria dos estudantes. Uma formulação mais recente associado com Frank L. Lambert descrevendo entropia como dispersão de energia descreve entropia como medir "a dispersão espontânea de energia - a uma temperatura específica."