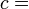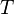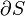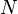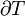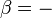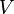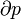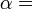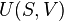Temperatura termodinâmica
Fundo para as escolas Wikipédia
Crianças SOS feita esta seleção Wikipedia ao lado de outros recursos escolas . Clique aqui para mais informações sobre Crianças SOS.
| Termodinâmica | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 O clássico Máquina térmica de Carnot. | |||||||||||||||||||||
Ramos
| |||||||||||||||||||||
Sistemas Estado
Processos
Cycles
| |||||||||||||||||||||
Propriedades do sistema
Funções do Estado ( Variáveis conjugadas em itálico)
| |||||||||||||||||||||
As propriedades dos materiais
| |||||||||||||||||||||
Equações
| |||||||||||||||||||||
Potenciais
| |||||||||||||||||||||
Filosofia
História
Teorias
Principais publicações
Timelines
Arte
Educação
| |||||||||||||||||||||
Os cientistas
| |||||||||||||||||||||
Temperatura termodinâmica é a medida absoluta de temperatura e é um dos principais parâmetros de termodinâmica .
Temperatura termodinâmica é um "absoluto" escala, porque é a medida da propriedade fundamental subjacente temperatura: nulo ou seu ponto zero, zero absoluto , é a temperatura a que os componentes das partículas de matéria têm um movimento mínimo e não pode tornar-se mais frio.
Na sua forma mais simples, a temperatura surge a partir da energia cinética dos movimentos vibracionais de matéria de partículas constituintes ( moléculas , átomos , e partículas subatômicas). A variedade completa destes movimentos cinéticos, juntamente com energias potenciais de partículas, e também, ocasionalmente, alguns outros tipos de energia de partícula em equilíbrio com estes, contribuir total energia interna dentro de uma substância. A energia interna é vagamente chamado de calor ou energia energia térmica em condições quando nenhum trabalho é feito em cima da substância por seus arredores, ou pela substância sobre os arredores. A energia interna pode ser armazenado em um número de maneiras dentro de uma substância, mas apenas a energia cinética das partículas contribui para a temperatura da substância.
Visão global
Temperatura resulta das vibrações aleatórias submicroscópicas de os constituintes de partículas de matéria . Estas propostas constituem o cinética de energia em uma substância. Mais especificamente, a temperatura termodinâmica de qualquer quantidade em massa de matéria é a medida da energia cinética média de um certo tipo de movimento vibracional de suas partículas constituintes chamados movimentos de translação. Movimentos de translação, são movimentos normais do corpo inteiro em . espaço através do qual as partículas se movimentar e trocar energia em colisões tridimensional Figura 1 abaixo mostra movimento de translação em gases; Figura 4 abaixo mostra movimento de translação em sólidos. Da temperatura termodinâmica ponto nulo, zero absoluto, é a temperatura à qual as partículas constituintes da matéria são tão próximo quanto possível para completar repouso; ou seja, eles têm movimento mínimo, mantendo apenas mecânica quântica movimento. Zero energia cinética permanece em uma substância no zero absoluto (veja energia térmica no zero absoluto , abaixo).
Em todo o mundo científico, onde as medições são feitas em Unidades SI, temperatura termodinâmica é medida em graus Kelvin (símbolo: K). Muitos campos de engenharia em o US no entanto, medir a temperatura termodinâmica usando o Escala Rankine.
Por acordo internacional, o kelvin unidade e sua escala são definidas por dois pontos: zero absoluto, eo ponto triplo da Viena Padrão Médio Ocean Water (água com uma mistura especificada de isótopos de hidrogênio e oxigênio). Zero absoluto, a temperatura mais baixa possível, é definido como sendo precisamente 0 K e -273,15 ° C . O ponto triplo da água é definida como sendo precisamente 273,16 K e de 0,01 ° C. Essa definição faz três coisas:
- Ela corrige a magnitude da unidade kelvin como sendo precisamente uma parte em 273,16 partes a diferença entre zero absoluto e o ponto triplo da água;
- Estabelece que um kelvin tem precisamente a mesma magnitude como um incremento de um grau na Celsius escala; e
- Estabelece a diferença entre os dois pontos nulos escalas 'como sendo precisamente 273,15 kelvins (0 K = -273,15 ° C e 273,16 K = 0,01 ° C).
As temperaturas expressas em graus Kelvin são convertidos em graus Rankine simplesmente multiplicando por 1,8 como se segue: t R = 1,8 ° K T, em que T e T ° K R temperaturas estão em graus Kelvin e Rankine respectivamente. As temperaturas expressas em graus Rankine são convertidos em graus Kelvin, dividindo por 1,8 como se segue: T = T K ° R / 1,8.
Realização prática
Embora as escalas Kelvin Celsius e são definidas através do zero absoluto (0 K) e o ponto triplo da água (273,16 K e de 0,01 ° C), não é prático usar esta definição, a temperaturas que são muito diferentes do ponto triplo da água. ITS-90 é então projetada para representar a temperatura termodinâmica, tanto quanto possível em toda a sua gama. Muitos desenhos termómetro diferentes são necessários para cobrir toda a gama. Estes incluem termômetros de pressão de vapor de hélio, termômetros de gás hélio, Termômetros de resistência de platina padrão (conhecido como sprts, PRT ou Platium RTDs) e termómetros de radiação monocromática.
Para alguns tipos de termómetro da relação entre a propriedade observada (por exemplo, o comprimento de uma coluna de mercúrio) e temperatura, está próximo de linear, de modo que para a maioria dos fins de uma escala linear é suficiente, sem calibração de ponto-por-ponto. Para outros é necessária uma curva de calibração ou equação. O termômetro de mercúrio, inventados antes da temperatura termodinâmica foi entendida, inicialmente definido a escala de temperatura; sua linearidade feitas leituras correlacionam-se bem com a verdadeira temperatura, ou seja, o "mercúrio" escala de temperatura foi um bom ajuste para a escala verdadeira.
A relação de temperatura, movimentos, a condução, e a energia calorífica
A natureza da energia cinética, movimento de translação, e temperatura
Na sua forma mais simples, a temperatura surge a partir da energia cinética dos movimentos vibracionais de matéria de partículas constituintes ( moléculas , átomos , e partículas subatômicas). A variedade completa destes movimentos cinéticos, juntamente com energias potenciais de partículas, e também, ocasionalmente, alguns outros tipos de energia de partícula em equilíbrio com estes, contribuir total energia interna (vagamente, o calor energia) dentro de uma substância. Assim, a energia interna pode ser armazenado em um número de maneiras dentro de uma substância, mas apenas a energia cinética das partículas contribui para a temperatura da substância. O capacidade de calor, que se refere entrada de calor e da mudança de temperatura, é discutida abaixo.
A relação de energia cinética, em massa, e a velocidade é dado pela fórmula E = k 1/2 mv 2. Assim, as partículas com uma unidade de massa em movimento em uma unidade de velocidade tem precisamente a mesma energia cinética, e precisamente a mesma temperatura, como aqueles com quatro vezes a massa, mas metade da velocidade.
Excepto no regime quântico a temperaturas extremamente baixas, a temperatura termodinâmica de qualquer quantidade em massa de uma substância (uma quantidade estatisticamente significativa de partículas) é directamente proporcional à energia cinética média média de um tipo específico de partícula de movimento conhecido como movimento de translação. Estes simples movimentos nas três x, y, e z -axis dimensões de espaço, as partículas movem-se em três espacial graus de liberdade. Esta forma particular de energia cinética é por vezes referida como temperatura cinética. movimento translacional, mas é uma forma de energia térmica e é o que dá gases não só a sua temperatura, mas também a sua pressão e a grande maioria do seu volume. Esta relação entre a temperatura, a pressão e o volume dos gases é estabelecida pela pV fórmula de lei do gás ideal = nRT e está incorporada na leis dos gases.
A extensão em que a energia cinética do movimento de translação de um átomo ou molécula individual (partículas) num gás contribui para a pressão e volume de gás que é uma função da temperatura proporcional termodinâmica, tal como estabelecido pela Constante de Boltzmann (símbolo: k B). A constante de Boltzmann também se refere a temperatura termodinâmica de um gás para a energia cinética do movimento de translação média de uma partícula individual como se segue:
onde:
 é a energia cinética média em joules (J) e é pronunciado "barra E"
é a energia cinética média em joules (J) e é pronunciado "barra E" - k B = 1,380 6 504 (24) × 10 -23 J / K e é pronunciado "Kay sub bee"
- T é a temperatura termodinâmica em kelvin (K) e é pronunciado "T"
Enquanto a constante de Boltzmann é útil para localizar a energia cinética média de uma partícula, é importante notar que, mesmo quando uma substância é isolada e em equilíbrio termodinâmico (todas as peças estão a uma temperatura uniforme e sem calor vai para dentro ou para fora dela), os movimentos de translação de átomos e moléculas individuais ocorre em uma ampla gama de velocidades (ver animação em Figura 1 acima). Em qualquer instante, a proporção de partículas que se deslocam a uma determinada velocidade dentro desta gama é determinada pela probabilidade como descrito pela Distribuição de Maxwell-Boltzmann. O gráfico mostrado na Fig. 2 mostra a distribuição de velocidade de 5500 K átomos de hélio. Eles têm uma velocidade mais provável de 4,780 km / s. No entanto, uma certa proporção de átomos, em determinado instante estão se movendo mais rápido, enquanto outros estão se movendo de forma relativamente lenta; alguns são momentaneamente em uma paralisação virtual (fora do eixo x para a direita). Este gráfico usa a velocidade inversa para a sua eixo x de modo que a forma da curva pode ser facilmente comparada com as curvas da Figura 5 abaixo. Em ambos os gráficos, zero no eixo x representa a temperatura infinito. Além disso, os x e eixo y em ambos os gráficos são escalados proporcionalmente.
As altas velocidades de movimento de translação
Embora o equipamento muito especializado de laboratório é necessária para detectar directamente movimentos de translação, as colisões resultantes de átomos ou moléculas com pequenas partículas suspensas num fluido produz Movimento Browniano que pode ser visto com um microscópio convencional. Os movimentos de translação das partículas elementares são muito rápidos e temperaturas próximas do zero absoluto são obrigados a observá-los diretamente. Por exemplo, quando os cientistas no NIST conseguiu uma temperatura fria recorde de 700 NK (bilionésimos de um kelvin), em 1994, eles usaram treliça equipamento de laser óptico para adiabaticamente legal de césio átomos. Eles, então, desligado os lasers de aprisionamento de átomos e das velocidades medidas diretamente de 7 mm por segundo, a fim de calcular a sua temperatura. Fórmulas para calcular a velocidade e a velocidade do movimento de translação são dadas na seguinte nota.
Os movimentos internos de moléculas e calor específico

Há outras formas de energia térmica para além da energia cinética do movimento de translação. Como pode ser visto na animação à direita, as moléculas são objectos complexos; eles são uma população de átomos e agitação térmica pode esticar seus internos ligações químicas de três maneiras diferentes: através de rotação, comprimento de ligação, e vínculo movimentos angulares. Estes são todos os tipos de graus de liberdade internos. Isso faz com que as moléculas distintas de substâncias monoatômicos (que consistem em átomos individuais), como o nobre gases hélio e argônio , que têm apenas três graus de liberdade de translação. A energia cinética é armazenada em graus internos de liberdade, o que lhes dá uma temperatura interna das moléculas. Mesmo que estes movimentos são chamados interno, as porções externas de moléculas ainda mover-um pouco como a jiggling de um estacionário balão de água. Isto permite a troca bidireccional de energia cinética entre movimentos internos e movimentos de translação com cada colisão molecular. Por conseguinte, como o calor é removido a partir de moléculas, tanto a sua temperatura cinética (a energia cinética do movimento de translação) e a sua temperatura interna diminuir simultaneamente em proporções iguais. Este fenómeno é descrito pela teorema da equipartição, que afirma que, para qualquer quantidade em massa de uma substância em equilíbrio, a energia cinética do movimento das partículas é distribuído uniformemente entre todos os graus de liberdade activos disponíveis para as partículas. Uma vez que a temperatura interna das moléculas são geralmente igual à sua temperatura cinética, a distinção é usualmente apenas de interesse no estudo detalhado do não- equilíbrio termodinâmico (LTE) fenómenos locais, tais como combustão, o sublimação de sólidos, e o difusão de gases quentes em um vácuo parcial.
A energia cinética armazenada internamente em moléculas faz com que as substâncias que contêm mais energia de calor a qualquer dada temperatura e para absorver a energia térmica adicional para um dado aumento de temperatura. Isto é porque qualquer energia cinética que é, num dado instante, ligado nos movimentos internos não é nesse mesmo instante, contribuindo para os movimentos de translação das moléculas. Esta energia cinética adicional simplesmente aumenta a quantidade de energia de calor absorve uma substância para uma dada elevação de temperatura. Esta propriedade é conhecida como uma substância de capacidade de calor específico.
Diferentes moléculas absorvem diferentes quantidades de energia térmica para cada aumento incremental na temperatura; ou seja, eles têm diferentes capacidades caloríficas específicas. Alta capacidade de calor específico surge, em parte, porque as moléculas de certas «substâncias possuem graus de liberdade internos mais do que os outros fazem. Por exemplo, à temperatura ambiente de azoto , que é um molécula diatomic, tem cinco graus ativos de liberdade: o movimento de translação três compreendendo mais dois graus de liberdade rotacionais internamente. Não é de surpreender, de acordo com o teorema da equipartição, nitrogênio tem cinco terços a capacidade específica de calor por mol (um determinado número de moléculas) como os gases monoatômicos. Outro exemplo é gasolina (ver tabela mostrando a sua capacidade de calor específico). A gasolina pode absorver uma grande quantidade de energia térmica por mole, com apenas uma mudança de temperatura modesta porque cada molécula compreende uma média de 21 átomos de carbono e, portanto, tem muitos graus de liberdade internos. Mesmo moléculas complexas maiores, mais pode ter dezenas de graus de liberdade internos.
A difusão de energia térmica: Entropia, fônons, e elétrons de condução móveis

Condução de calor é a difusão de energia térmica a partir de partes quentes de um sistema a frio. Um sistema pode ser uma única entidade global ou uma pluralidade de entidades a granel discretas. A maior prazo neste contexto, significa uma quantidade estatisticamente significativa de partículas (que pode ser uma quantidade microscópica). Sempre que a energia de calor difunde dentro de um sistema isolado, diferenças de temperatura dentro do sistema de redução (e entropia aumenta).
Um particular mecanismo de condução de calor ocorre quando o movimento de translação, a temperatura subjacente partícula movimento, transfere impulso a partir de partículas de partículas em colisões. Em gases, estes movimentos de translação são da natureza mostrada acima na fig. 1 . Tal como pode ser visto em que a animação, não só o impulso (calor) difusa por todo o volume do gás através de colisões de série, mas as moléculas ou átomos inteiras pode mover-se para a frente no território novo, trazendo a sua energia cinética com eles. Por conseguinte, as diferenças de temperatura em toda a equalizar gases muito rapidamente, especialmente para os átomos ou moléculas de luz; convecção acelera esse processo ainda mais.
Movimento de translação em sólidos no entanto, assume a forma de fônons (ver Fig. 4 à direita). Fônons são constrangidos, pacotes quantificados onda viajando à velocidade do som para uma determinada substância. A maneira pela qual fonões interagir dentro de um sólido determina uma variedade de suas propriedades, incluindo a sua condutividade térmica. Em sólidos eletricamente isolantes, condução de calor à base de phonon é geralmente ineficiente e tais sólidos são considerados isolantes térmicos (tais como vidro, plástico, borracha, cerâmica e pedra). Isto porque, em sólidos, átomos e moléculas estão bloqueadas no lugar em relação aos seus vizinhos e não são livres para se movimentarem.
Metais no entanto, não se restringem a condução de calor apenas com base-fonão. Energia térmica realiza através de metais extraordinariamente rapidamente, porque em vez de colisões diretas molécula a molécula, a grande maioria da energia de calor é mediada através de muito luz, condução móveis elétrons . É por isso que há uma correlação quase perfeita entre metais » e a sua condutividade térmica condutividade elétrica. Elétrons de condução imbuir metais com sua condutividade extraordinária, porque eles são deslocalizados (isto é, não ligados a um átomo específico) e comportam-se mais como um tipo de gás quântico devido aos efeitos de energia do ponto zero (para mais informações sobre ZPE, ver nota 1 abaixo). Além disso, os elétrons são relativamente leves com uma massa de repouso única 1/1836 th a de um próton . Esta é aproximadamente a mesma proporção que a .22 Bala Curta (29 grãos ou 1,88 g) em comparação com o rifle que atira-lo. Como Isaac Newton escreveu com sua terceira lei do movimento ,
Lei # 3: Todas as forças ocorrem em pares, e estas duas forças são iguais em magnitude e oposta em direcção.
No entanto, uma bala acelera mais rápido do que um rifle dado uma força igual. Desde energia cinética aumenta como o quadrado da velocidade, quase toda a energia cinética vai para a bala, e não o rifle, mesmo que ambos experimentam a mesma força dos gases propulsores em expansão. Do mesmo modo, porque eles são muito menos massiva, a energia calorífica é facilmente suportado pelos electrões de condução móvel. Além disso, porque eles são deslocalizados e muito rápido, a energia cinética de calor conduz muito rapidamente através de metais com abundantes elétrons de condução.
A difusão da energia de calor: radiação de corpo negro
A radiação térmica é um subproduto das colisões resultantes de vários movimentos de vibração dos átomos. Essas colisões fazer com que os elétrons dos átomos para emitir térmicas fótons (conhecido como radiação de corpo negro). Os fótons são emitidos a qualquer momento uma carga elétrica é acelerado (como acontece quando nuvens de elétrons de dois átomos colidem). Mesmo moléculas individuais com temperaturas internas maiores que zero absoluto também emitem radiação de corpo negro de seus átomos. Em qualquer quantidade em massa de uma substância em equilíbrio, os fótons de corpo negro são emitidos através de uma gama de em comprimentos de onda de um espectro que tem uma forma curva, como uma chamada de sino Curva de Planck (ver gráfico na Fig. 5 à direita). A parte superior de uma curva de Planck ( o comprimento de onda de pico emitância) situa-se numa parte específica do espectro electromagnético, dependendo da temperatura do corpo negro. Substâncias na extrema temperaturas criogênicas emitem em comprimentos de onda de rádio de comprimento enquanto que temperaturas extremamente quentes produzir curta raios gama (ver Tabela de temperaturas comuns ).
Radiação de corpo negro difunde energia térmica ao longo de uma substância como os fótons são absorvidos pelos átomos vizinhos, transferindo impulso no processo. Fótons de corpo negro também facilmente escapar de uma substância e pode ser absorvida pelo ambiente circundante; energia cinética é perdida durante o processo.
Conforme estabelecido pela Lei de Stefan-Boltzmann, a intensidade do aumento de radiação de corpo negro como a quarta potência da temperatura absoluta. Assim, um corpo negro a 824 K (pouco menos de vermelho escuro brilhante) emite 60 vezes a radiantes poder como faz a 296 K (temperatura ambiente). É por isso que se pode facilmente sentir o calor radiante de objetos quentes à distância. A temperaturas mais elevadas, tais como aqueles encontrados em um lâmpada incandescente, a radiação de corpo negro pode ser o principal mecanismo pelo qual a energia de calor escapa de um sistema.
Tabela de temperaturas termodinâmicas
A gama completa da escala de temperatura termodinâmica, a partir do zero absoluto para absoluto quente, e alguns pontos notáveis entre os mesmos são mostrados na tabela abaixo.
| kelvin | Emittance Peak comprimento de onda de fótons de corpo negro | |
| Do zero absoluto (Precisamente pela definição) | 0 K | ∞ |
| Coldest medida temperatura | 450 pK | 6400 km |
| Uma millikelvin (Precisamente pela definição) | 0.001 K | 2.897 77 metros (Radio, FM banda) |
| Água de ponto triplo (Precisamente pela definição) | 273,16 K | 10,608.3 nm (Comprimento de onda longo IV) |
| Lâmpada incandescente B | 2500 K | 1.160 nm (Near infravermelho) C |
| Da Sun superfície visível C | 5778 K | 501,5 nm ( luz verde ) |
| Parafuso de relâmpago de canal | 28.000 K | 100 nm (Far Ultraviolet luz) |
| Núcleo do Sol | 16 MK | 0,18 nm ( Raios-X) |
| Arma termonuclear (Temperatura de pico) | 350 MK | 8,3 x 10 -3 nm ( Os raios gama) |
| Sandia National Labs ' Z máquina D | 2 GK | 1,4 x 10 -3 nm (raios gama) |
| Núcleo de um de alta massa estrelar em seu último dia | 3 GK | 1 × 10 -3 nm (raios gama) |
| Mesclando binário nêutron sistema de estrelas | 350 GK | 8 × 10 -6 nm (raios gama) |
| Explosão de raios gama progenitores | 1 TK | 3 × 10 nm -6 (raios gama) |
| Pesado Relativistic Ion Collider | 1 TK | 3 × 10 nm -6 (raios gama) |
| Próton vs. do CERN colisões núcleo | 10 TK | 3 × 10 -7 nm (raios gama) |
| Universo 5,391 x 10 -44 s após o Big Bang | 1,417 × 10 32 K | 1,616 x 10 -26 nm (Frequência Planck) |
A O valor K 2500 é aproximada.
B Para um verdadeiro corpo negro (que não são filamentos de tungstênio). Emissividade 'filamentos de tungstênio é maior em comprimentos de onda mais curtos, o que faz com que pareçam mais brancos.
C photosphere temperatura efectiva.
D Para um verdadeiro corpo negro (que o plasma não era). Emissão dominante da máquina Z se originou a partir de 40 elétrons MK (emissões de raios-X moles) dentro do plasma.
O calor de mudança de fase

A energia cinética do movimento das partículas é apenas um contribuinte para a energia térmica total em uma substância; outro é transições de fase, que são o energia potencial das ligações moleculares que podem se formar em uma substância como esfria (como durante e condensando congelamento). A energia térmica necessária para uma transição de fase é chamada . calor latente Este fenómeno pode ser compreendido mais facilmente, considerando-o na direcção reversa: calor latente é a energia necessária para quebrar as ligações químicas (tais como durante evaporação e fusão). Quase todos estão familiarizados com os efeitos das transições de fase; por exemplo, a vapor a 100 ° C pode causar queimaduras graves em muito mais rápidos do que a 100 ° C o ar de um secador de cabelo. Isto acontece porque uma grande quantidade de calor latente é libertado na forma de vapor condensa em água em estado líquido sobre a pele.
Mesmo que a energia térmica é liberada ou absorvida durante transições de fase, puros elementos químicos , compostos , e eutectic ligas não apresentam qualquer mudança de temperatura, enquanto eles passam por eles (ver Fig. 7, abaixo, à direita). Considere um tipo particular de transição de fase: de fusão. Quando um sólido derretendo, estrutura de cristal ligações químicas estão sendo quebrada; a substância é a transição do que é conhecido como um estado mais ordenado para um estado menos ordenado. Na Fig. 7, o derretimento do gelo é mostrado na posição de azul para verde caixa inferior esquerdo.

Em um ponto termodinâmico específico, o ponto de fusão (que é de 0 ° C através de uma ampla faixa de pressão no caso da água), todos os átomos ou moléculas são, em média, no limite máximo de energia suas ligações químicas pode suportar sem quebrar afastado a partir da rede. As ligações químicas são tudo-ou-nada forças: ou guarda-o, ou quebrar; não existe um estado no meio. Por conseguinte, quando uma substância está no seu ponto de fusão, cada joule de energia de calor acrescentado só quebra os laços de uma quantidade específica de seus átomos ou moléculas, convertendo-os em um líquido de exatamente a mesma temperatura; nenhuma energia cinética é adicionado ao movimento de translação (que é o que dá substâncias sua temperatura). O efeito é um pouco como pipoca: a uma determinada temperatura, a energia térmica adicional não é possível fazer os grãos mais quente até que a transição (estalo) é completa. Se o processo é invertido (como na congelação de um líquido), a energia de calor deve ser removido a partir de uma substância.
Como dito acima, a energia térmica necessária para uma transição de fase é chamado calor latente. Nos casos específicos de fusão e congelamento, ele é chamado entalpia de fusão ou entalpia de fusão. Se as ligações moleculares num cristal reticulado são fortes, o calor de fusão pode ser relativamente grande, tipicamente na gama de 6 a 30 kJ por mole de água e a maior parte dos elementos metálicos. Se a substância é um dos gases (monoatômicos, que têm pouca tendência para formar ligações moleculares) do calor de fusão é mais modestos, variando 0,021-2,3 kJ por mole. Relativamente falando, transições de fase podem ser eventos verdadeiramente energéticos. Para fundir completamente o gelo a 0 ° C em água a 0 ° C, deve-se adicionar cerca de 80 vezes a energia de calor, como é necessário para aumentar a temperatura da mesma massa de água no estado líquido por um grau Celsius. Rácios dos metais são ainda maior, tipicamente na gama de 400-1200 vezes. E a fase de transição ebulição é muito mais enérgico do que o congelamento. Por exemplo, a energia requerida para ferver completamente ou vaporizar água (o que é conhecido como entalpia de vaporização) é cerca de 540 vezes que necessárias para um aumento de um grau.
Entalpia considerável de vaporização da água é por isso que a pele da pessoa pode ser queimado tão rapidamente quanto o vapor se condensa sobre ele (posição de vermelho para verde na Fig. 7 acima). Na direção oposta, é por isso que sua pele sente frio como a água líquida se evapora em (um processo que ocorre em um ambiente sub- temperatura do termómetro húmido que é dependente humidade relativa). Entalpia altamente energético de vaporização da água é também um factor importante subjacente porque piscina cobre solares (flutuantes, cobertores isolantes que cobrem piscinas quando não em uso) são tão eficazes na redução de custos de aquecimento: eles evitar a evaporação. Por exemplo, a evaporação de apenas 20 mm de água a partir de um pool de 1,29 m de profundidade de água gela a 8,4 graus Celsius (15,1 ° F).
Energia interna
A energia total cinética de todo o movimento de partículas, incluindo a de elétrons de condução, mais a energia potencial de mudanças de fase, mais energia de ponto zero compreendem o energia interna de uma substância, que é a sua energia térmica total. A energia interna termo não deve ser confundido com graus de liberdade internos. Considerando que os graus de liberdade internos de moléculas refere-se a um lugar especial onde a energia cinética é obrigado, a energia interna de uma substância compreende todas as formas de energia térmica.

Energia térmica no zero absoluto
Como uma substância esfria, diferentes formas de energia de calor e seus efeitos relacionados diminuir simultaneamente em magnitude: o calor latente de transições de fase disponíveis são liberados como uma substância muda de um estado menos ordenado para um estado mais ordenado; os movimentos de translação de átomos e moléculas diminuir (sua temperatura cinética diminui); os movimentos internos de moléculas diminuir (sua temperatura interna diminui); elétrons de condução (se a substância é um condutor elétrico) viajar um pouco mais lento; e pico de radiação de corpo negro emittance comprimento de onda aumenta (a energia dos fótons diminui). Quando as partículas de uma substância são tão próximas quanto possível concluir descanso e reter apenas o movimento mecânico quântico induzida por ZPE, a substância se encontra na temperatura de zero absoluto (T = 0).
Note-se que enquanto que o zero absoluto é o ponto zero temperatura termodinâmica e é também o ponto em que os componentes de partículas de matéria têm um movimento mínimo, de zero absoluto não é necessariamente o ponto em que uma substância contém de zero a energia calorífica; é preciso ser muito preciso com o que se entende por energia térmica. Muitas vezes, todas as mudanças de fase que podem ocorrer em uma substância, terá ocorrido no momento em que atinge o zero absoluto. No entanto, isto nem sempre é o caso. Notavelmente, t = 0 hélio permanece líquido à pressão ambiente e deve estar sob uma pressão de pelo menos 25 bar (2,5 MPa) para cristalizar. Isso porque o calor de fusão de hélio (a energia necessária para fundir o hélio gelo) é tão baixa (apenas 21 joules por mole) de que o efeito de indução de movimento da energia do ponto zero é suficiente para impedir que o congelamento a baixas pressões. Só se sob pelo menos 25 bar (2,5 MPa) de pressão vai essa energia de calor latente ser liberado como congelamentos de hélio enquanto se aproxima do zero absoluto. Uma complicação adicional é que muitos sólidos mudar sua estrutura de cristal para arranjos mais compactos a pressões extremamente elevadas (até milhões de bares, ou centenas de gigapascals). Estes são conhecidos como transições de fase sólida-sólida, em que o calor latente é libertado como uma estrutura de cristal muda para um termodinamicamente mais favorável, um compacto.
As complexidades acima para fazer declarações cobertor bastante complicada em relação à energia interna em T = 0 substâncias. Independentemente da pressão, porém, o que se pode dizer é que no zero absoluto, todos os sólidos com um cristal estrutura de menor energia, como aqueles com um embalado-arranjo mais próximo (ver Fig. 8, acima, à esquerda) contêm energia interna mínima, mantendo apenas que, devido à sempre presente fundo de energia de ponto zero. Pode-se também dizer que, para uma determinada substância, à pressão constante, o zero absoluto é o ponto de menor entalpia (uma medida do potencial de trabalho que leva energia interna, pressão e volume em consideração). Por último, é sempre verdade dizer que todos os T = 0 substâncias contêm energia zero calor cinética.
As aplicações práticas para temperatura termodinâmica

Temperatura termodinâmica é útil não só para os cientistas, ele também pode ser útil para os leigos em muitas disciplinas que envolvem gases. Ao expressar variáveis em termos absolutos e aplicando Gay Lussac-lei de proporcionalidade de temperatura / pressão, soluções para problemas cotidianos são simples; por exemplo, o cálculo como uma mudança de temperatura afecta a pressão no interior de um pneu de automóvel. Se o pneu tem uma pressão relativamente fria de 200 kPa-Gage, em seguida, em termos absolutos (em relação a um vácuo), a sua pressão de 300 kPa-absoluto. Temperatura ambiente ("frio" em termos do pneu) é 296 K. Se a pressão do pneu é de 20 ° C mais quente (20 graus Kelvin), a solução é calculada como 316 K / 296 K = 6,8% maior temperatura termodinâmica e pressão absoluta; isto é, uma pressão de 320 kPa-absoluto, que é de 220 kPa-gage.
Definição de temperatura termodinâmica
Estritamente falando, a temperatura de um sistema é bem definido somente se as suas partículas ( átomos , moléculas , electrões , fotões ) estão em equilíbrio, de modo que suas energias obedecer a um Distribuição de Boltzmann (ou sua mecânica quântica homólogo). Existem muitas possíveis escalas de temperatura, derivadas de uma variedade de observações de fenómenos físicos. A temperatura termodinâmica pode ser demonstrado possuir propriedades especiais, e em particular, pode ser visto para ser definido unicamente (até alguns fator multiplicativo constante), considerando o eficiência de idealizada motores de calor. Assim, o razão T 2 / T 1 de duas temperaturas T 1 e T 2 é a mesma em todas as escalas absolutos.
Genericamente dito, a temperatura controla o fluxo de calor entre os dois sistemas, e o universo como um todo, como com qualquer sistema natural, tende a progredir de modo a maximizar a entropia . Isto sugere que não deve haver uma relação entre a temperatura e entropia. Para elucidar isto, considere primeiro a relação entre calor, trabalho e temperatura. Uma forma de estudar este é analisar um motor de calor, o qual é um dispositivo para converter calor em trabalho mecânico, tal como o Máquina térmica de Carnot. Tais funções de um motor de calor, utilizando um gradiente de temperatura entre uma temperatura elevada T H e uma baixa temperatura de T C para gerar trabalho, e o trabalho realizado (por ciclo, por exemplo) por o motor de calor é igual à diferença entre a energia de calor q H colocado em o sistema a uma temperatura elevada e o calor Q C ejectado a baixa temperatura (em que ciclo). A eficiência do motor é o trabalho dividido pelo calor introduzido no sistema ou
em que W cy é o trabalho por ciclo. Assim, a eficiência depende apenas q C / q H .
Teorema de Carnot estabelece que todos os motores reversíveis que operam entre os mesmos reservatórios de calor são igualmente eficientes.Assim, qualquer motor térmico reversível operando entre as temperaturasT 1eT 2tem de ter a mesma eficiência, isto é, a eficiência é a função apenas de temperaturas
Além disso, um motor de calor reversível operando entre as temperaturas T 1 e T 3 tem de ter a mesma eficiência que uma consiste em dois ciclos, entre um T 1 e um outro (intermediário) temperatura T 2 , e a segunda entre t 2 e t 3 . Uma maneira rápida de ver isso é que isto não deveria ser o caso, então a energia (na forma de Q ) será desperdiçado ou adquirida, resultando em diferentes eficiências globais cada vez que um ciclo é dividido em ciclos de componentes; claramente de um ciclo pode ser constituído por um número de ciclos mais pequenos.
Com esse entendimento deQ 1,Q 2eQ 3, nós também notar que, matematicamente,
Mas a primeira função é não uma função de T 2 , portanto, o produto de duas funções finais deve resultar na remoção de t 2 como uma variável. A única maneira é, por conseguinte, para definir a função f como se segue:
e
de modo que
ou seja a relação de troca de calor é uma função das respectivas temperaturas nas quais elas ocorrem.Podemos escolher qualquer função monótona para o nosso ;é uma questão de conveniência e de convenções que nós escolhemos
;é uma questão de conveniência e de convenções que nós escolhemos .Escolhendo entãoumatemperatura de referência fixo (ou seja, ponto triplo da água), que estabelecem a escala de temperatura termodinâmica.
.Escolhendo entãoumatemperatura de referência fixo (ou seja, ponto triplo da água), que estabelecem a escala de temperatura termodinâmica.
É para ser notado que tal definição coincide com a da derivação dos gases perfeitos; Também é esta definição da temperatura termodinâmica que nos permite representar a eficiência de Carnot em termos de T H e T C , e, portanto, derivar que o (completo) ciclo de Carnot é isentropic:
Substituindo este volta para a primeira fórmula de eficiência produz uma relação em termos de temperatura:
Note-se que para T C = 0 é a eficiência de 100% e que a eficiência torna-se maior do que 100% por t C <0, que casos não são realistas. Subtraindo o lado direito da equação 4 a partir da porção média e reorganizando dá
onde o sinal negativo indica calor ejetado do sistema.A generalização desta equação éClausius teorema, o que sugere a existência de umafunção de estadoS(isto é, uma função que depende apenas do estado do sistema, e não sobre a forma como ele atingido esse estado) definido (-se a um aditivo constante) por
onde o subscrito indica a transferência de calor num processo reversível. A função S corresponde à entropia do sistema, mencionado anteriormente, e a mudança de S em torno de qualquer ciclo é zero (como é necessário para qualquer função de estado). Equação 5 podem ser reorganizados para obter uma definição alternativa para a temperatura em termos de entropia e de calor (para evitar loop de lógica, nós devemos primeiro definir a entropia através de mecânica estatística):
Para um sistema em que a entropiaSé uma funçãoS(E) da sua energiaE, a temperatura termodinâmicaTé, por conseguinte, dada por
de modo que o inverso da temperatura termodinâmica é a taxa de aumento da entropia com energia.
História
- Ca. 485 aC: Parmênides em seu tratado "On Nature" postulou a existente de frigidum primum , uma fonte de substância elementar hipotética de todos arrefecimento ou frio no mundo.
- 1702-1703: Guillaume Amontons (1663-1705) publicou dois artigos que podem ser utilizados para creditar a ele como sendo o primeiro pesquisador a deduzir a existência de um (termodinâmica) escala fundamentais temperatura com um zero absoluto. Ele fez a descoberta enquanto se esforçando para melhorar os termômetros de ar em uso no momento. Seus termómetros J-tubo composto por uma coluna de mercúrio que foi suportado por uma massa fixa de ar retido no interior da parte sensora do termómetro. Em termos termodinâmicos, os termómetros invocada a relação volume / temperatura de um gás sob pressão constante. Seus medições do ponto de água e o ponto de fusão do gelo ebulição mostraram que, independentemente da massa de ar aprisionado no interior seus termómetros ou o peso de mercúrio do ar foi de apoio, a redução no volume de ar no ponto de gelo foi sempre a mesma proporção . Esta observação levou a postular que uma redução suficiente da temperatura reduziria o volume de ar para zero. Na verdade, seus cálculos projetou que o zero absoluto foi equivalente a -240 ° C somente 33,15 graus curtas do verdadeiro valor de -273,15 ° C.
- 1742: Anders Celsius (1701-1744) criou uma versão "para trás" da escala moderna temperatura Celsius. Na escala original de Celsius, zero, representou o ponto de ebulição da água e 100 representou o ponto de fusão do gelo. Em seu artigo Observações de dois graus persistentes em um termômetro, ele relatou suas experiências que mostram que o ponto de fusão do gelo foi efetivamente afetado pela pressão. Ele também determinou com precisão notável como ponto de ebulição da água variou em função da pressão atmosférica. Ele propôs que zero na sua escala de temperatura (ponto de ebulição da água) seriam calibrados na pressão barométrica média ao nível médio do mar.
- 1744: Coincidente com a morte de Anders Celsius, o famoso botânico Carolus Linnaeus (1707-1778) efetivamente revertido escala de Celsius após o recebimento de sua primeira termômetro com uma escala em que zero representa o ponto de gelo e 100 ponto de ebulição da água representava fusão. A custom-made linnaeus-termômetro , para uso em suas estufas, foi feita por Daniel Ekström, principal fabricante de instrumentos científicos no momento da Suécia. Para os próximos 204 anos, as comunidades científicas e termometria em todo o mundo que se refere a esta escala como a escala centígrados . As temperaturas na escala Celsius foram frequentemente relatados simplesmente como graus ou, quando maior especificidade foi desejados, graus centígrados . O símbolo para valores de temperatura nesta escala era ° C (em vários formatos ao longo dos anos). Porque o termo centígrados era também o nome de língua francesa para uma unidade de medida angular (um centésimo de um ângulo reto) e tinha uma conotação semelhante em outros idiomas, o termo "grau centesimal" foi utilizado quando, linguagem inequívoca foi muito preciso requerido pelos organismos de normalização internacionais, como o Bureau Internacional de Pesos e Medidas (BIPM). A 9ª CGPM ( Conferência Geral de Pesos e Medidas ( Conférence générale de pesos e medidas ) e CIPM ( Comitê Internacional de Pesos e Medidas ( Comitê Internacional de Pesos e Medidas ) aprovou formalmente graus Celsius (símbolo: ° C) em 1948.
- 1777: Em seu livro Pyrometrie (Berlin: Haude & Spener de 1779) completou quatro meses antes de sua morte, Johann Heinrich Lambert (1728-1777), por vezes incorretamente referido como Joseph Lambert, propôs uma escala de temperatura absoluta com base na pressão / temperatura relação de um volume fixo de gás. Isto é distinto da relação volume / temperatura de um gás sob pressão constante que Guillaume Amontons descobriu 75 anos antes. Lambert afirmou que o zero absoluto foi o ponto onde uma simples extrapolação linear alcançou a pressão de gás zero e foi igual a -270 ° C.
- Circa 1787: Não obstante o trabalho de Guillaume Amontons 85 anos antes, Jacques Alexandre César Charles (1746-1823) muitas vezes é creditado com a descoberta, mas não publicar, que o volume de gás sob pressão constante é proporcional à sua temperatura absoluta. A fórmula que ele criou foi V 1 / T 1 = V 2 / T 2 .
- 1802: Joseph Louis Gay-Lussac (1778-1850) trabalhos publicados (reconhecendo as notas de laboratório inéditos de Jacques Charles quinze anos antes) que descrevem como o volume de gás sob mudanças de pressão constante linearmente com a sua (termodinâmica) temperatura absoluta. Este comportamento é chamado Lei de Charles e é uma das leis dos gases. suas são as fórmulas primeiro conhecidas para usar o número 273 para o coeficiente de expansão do gás em relação ao ponto de fusão do gelo (indicando que o zero absoluto foi equivalente a -273 ° C).
- 1848: William Thomson , (1824-1907), também conhecido como Lord Kelvin, escreveu em seu papel, em uma escala termométrica absoluta, da necessidade de uma escala em que frio infinito (zero absoluto) foi ponto nulo da escala, e que usou o graus Celsius para a sua unidade de incremento. Como Gay-Lussac, Thomson calculou que o zero absoluto foi equivalente a -273 ° C nos termômetros de ar do tempo. Esta escala absoluta é hoje conhecida como a escala de temperatura termodinâmica Kelvin. É digno de nota que o valor da Thomson de -273 foi realmente derivado de 0,00366, o que foi aceito o coeficiente de expansão de gás por grau Celsius em relação ao ponto de gelo. O inverso de -,00366 expressa a cinco dígitos significativos é -273,22 ° C, que é notavelmente perto do verdadeiro valor de -273,15 ° C.
- 1859: William John Macquorn Rankine (1820-1872) propôs uma escala de temperatura termodinâmica semelhante à de William Thomson, mas que usou o grau Fahrenheit para seu incremento unidade. Esta escala absoluta é conhecida hoje como a escala de temperatura termodinâmica Rankine.
- 1877-1884: Ludwig Boltzmann (1844-1906) fez grandes contribuições para a termodinâmica por meio de uma compreensão do papel que a cinética de partículas e radiação de corpo negro jogado. Seu nome está agora ligado a várias das fórmulas utilizadas hoje em termodinâmica.
- Circa 1930:experimentos termometria Gas cuidadosamente calibrados para o ponto de gelo e ponto de ebulição da água de fusão mostrou que o zero absoluto foi equivalente a -273,15 ° C.
- 1948: Resolução 3 da 9ª CGPM (Conferência Geral de Pesos e Medidas, também conhecida como a Conferência Geral de Pesos e Medidas), fixou o ponto triplo da água, precisamente 0,01 ° C. Neste momento, o ponto triplo ainda não tinha definição formal para o seu valor equivalente kelvin, que a resolução declarada "será corrigido em uma data posterior". A implicação é que , se o valor de zero absoluto medido na década de 1930 foi verdadeiramente -273,15 ° C, então o ponto triplo da água (0,01 ° C) foi equivalente a 273,16 K. Além disso, tanto o CIPM (Comité Internacional de Pesos e Medidas , também conhecido como o Comitê Internacional de Pesos e Medidas) e do CGPM adoptou formalmente o nome Celsius para o grau Celsius ea escala de temperatura Celsius .
- 1954: Resolução 3 da 10ª CGPM deu a escala Kelvin sua definição moderna, escolhendo o ponto triplo da água como seu segundo ponto que define e atribuiu-lhe uma temperatura de precisão 273,16 kelvin (o que foi realmente escrito 273,16 graus Kelvin na época). Isto, em combinação com a Resolução 3 da 9ª CGPM, teve o efeito de definição do zero absoluto como sendo precisamente de zero kelvin e -273,15 ° C.
- 1967/1968: Resolução 3 da 13ª CGPM renomeado o incremento unidade de temperatura termodinâmica kelvin , símbolo K, substituindo grau absoluto , símbolo ° K. Além disso, sentindo-se útil definir de forma mais explícita a magnitude do incremento unidade, a 13ª CGPM decidiu também na Resolução 4 que "O kelvin, unidade de temperatura termodinâmica, é a fracção 1 / 273,16 da temperatura termodinâmica do ponto triplo da água ".
- 2005:O CIPM (Comité Internacional de Pesos e Medidas, também conhecido como oComitê Internacional de Pesos e Medidas)afirmou que, para efeitos de delinear a temperatura do ponto triplo da água, a definição da escala de temperatura termodinâmica Kelvin remete para água tendo uma composição isotópica definida como sendo precisamente igual à especificação nominal deViena Padrão Médio Ocean Water.