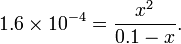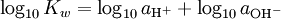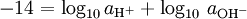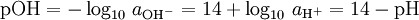pH
Antecedentes
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?
| Ácidos y Bases |
|---|
| Constante de disociación del ácido Extracción ácido-base Reacción ácido-base Valoración ácido-base Constante de disociación Función de acidez Soluciones tampón pH Afinidad protónica Auto-ionización del agua La fuerza del ácido |
| Ácido tipos |
| Brønsted · Lewis · Mineral Orgánica · Fuerte Superácidos · Débil |
| Los tipos base |
| Brønsted · Lewis · Orgánico Fuerte · Superbases No nucleófila · Débil |
pH es una medida de la acidez o alcalinidad de una solución. Las soluciones acuosas a 25 ° C con un pH de menos de siete se consideran ácidos, mientras que aquellos con un pH superior a siete se consideran básico (alcalino). Cuando un nivel de pH es 7.0, que se define como "neutral" a 25 ° C, ya que a este pH la concentración de H 3 O + es igual a la concentración de OH - en agua pura. pH depende formalmente a la la actividad de hidronio iones (H 3 O +), pero para soluciones muy diluidas, las molaridad de H 3 O + puede ser utilizado como un sustituto con poca pérdida de exactitud. (H + se utiliza a menudo como sinónimo de H 3 O +). Debido a pH depende de la actividad iónica, una propiedad que no se puede medir fácilmente o totalmente predicho teóricamente, es difícil determinar un valor preciso para el pH de una solución de . La lectura de pH de una solución generalmente se obtiene mediante la comparación de soluciones desconocidas a las de pH conocido, y hay varias maneras de hacerlo.
El concepto de pH se introdujo por primera vez por Danés químico SPL Sørensen en el Carlsberg Laboratorio en 1909 . El nombre de pH se ha afirmado que han venido de cualquiera de las varias fuentes, entre ellas: hydrogenii pondus, hydrogenii potentia ( Latina ), potentiel hydrogène ( Francés ), y el potencial de hidrógeno ( Inglés ).
Definición
El pH se define en la Norma Internacional ISO 31-8: operacionalmente como sigue. Para una solución X, medir primero la fuerza electromotriz E X del célula galvánica
donde
- F es la Constante de Faraday;
- R es la constante molar de los gases;
- T es la temperatura termodinámica .
Definido de esta manera, el pH es una cantidad adimensional. Valores de pH (S) para una serie de soluciones S estándar, junto con otros detalles, se dan en el correspondiente Recomendación de la IUPAC.
pH no tiene un significado fundamental como una unidad; su definición oficial es de carácter práctico. Sin embargo, en la gama restringida de diluido soluciones acuosas que tienen una cantidad-de-sustancia disuelta concentraciones menores de 0,1 mol / L, y de ser ni muy alcalina ni fuertemente ácida (2 <pH <12), la definición es tal que
donde [H +] indica la concentración de iones de hidrógeno H + de cantidad de sustancia y γ 1 denota el coeficiente de actividad de un típico univalente electrolito en la solución.
Explicación
En términos más simples, el número surge de una medida de la la actividad de hidrógeno iones (o su equivalente) en la solución. La escala del pH es una inversa logarítmica representación de protones de hidrógeno ( H +) la concentración. A diferencia de escalas lineales, que tienen una relación constante entre el elemento que se midieron (concentración de H + en este caso) y el valor informado, cada unidad de pH individuo es un factor de 10 diferente a la siguiente unidad superior o inferior. Por ejemplo, un cambio en el pH de 2 a 3 representa una disminución de 10 veces en la concentración de H +, y un cambio del 2 al 4 representa un cien (10 × 10) -fold disminución en la concentración de H +. La fórmula para el cálculo de pH es:
Donde α H + denota la actividad de los iones H +, y es adimensional. En soluciones que contienen otros iones, la actividad y la concentración generalmente no será el mismo. Actividad es una medida de la concentración efectiva de iones de hidrógeno, en lugar de la concentración real; que incluye el hecho de que otros iones que rodean los iones de hidrógeno se protegerlos y afectar a su capacidad de participar en las reacciones químicas. Estos otros iones cambian la cantidad eficaz de la concentración de iones de hidrógeno en cualquier proceso que implica H +.
En soluciones diluidas (tales como agua del grifo), la actividad es aproximadamente igual al valor numérico de la concentración del ion H +, denotado como [H +] (o más exactamente por escrito, [ H 3 O +]), medida en moles por litros (también conocido como molaridad). Por lo tanto, a menudo es conveniente definir pH como:
Para ambas definiciones, log 10 denota la base 10 logaritmo , por lo tanto, pH define una escala logarítmica de la acidez. Por ejemplo, si uno hace una limonada con una concentración de H + de 0,0050 moles por litro, su pH sería:
Una solución de pH = 8,2 tendrá un [H +] -8,2 concentración de 10 mol / L, o alrededor de 6,31 × 10 -9 mol / L. Por lo tanto, su actividad hidrógeno α H + es de alrededor de 6,31 × 10 -9. Una solución con una [H +] concentración de 4,5 × 10 -4 mol / L tendrá un valor de pH de 3,35.
En la solución a 25 ° C, un pH de 7 indica la neutralidad (es decir, el pH del agua pura), porque el agua se disocia de forma natural en H + y OH - iones con concentraciones iguales de 1 × 10 -7 mol / L. Un valor de pH inferior (por ejemplo pH 3) indica aumento de la fuerza de la acidez, y un valor de pH más alto (por ejemplo pH 11) indica aumento de la fuerza de la basicidad. Nótese, sin embargo, que el agua pura, cuando se expone a la atmósfera, se llevará en dióxido de carbono , algunos de los cuales reacciona con el agua para formar ácido carbónico y H +, lo que reduce el pH a aproximadamente 5,7.
PH neutro a 25 ° C no es exactamente 7. pH es un valor experimental, por lo que tiene un error asociado. Desde el constante de disociación del agua es (1,011 ± 0,005) × 10 -14, pH de agua a 25 ° C sería 6,998 ± 0,001. El valor es consistente, sin embargo, con pH neutro siendo 7,00 a dos cifras significativas, lo que es lo suficientemente cerca como para la mayoría de la gente asuma que es exactamente 7. El pH del agua se hace más pequeño, con temperaturas más altas. Por ejemplo, a 50 ° C, pH del agua es 6,55 ± 0,01. Esto significa que una solución diluida es neutra a 50 ° C cuando su pH es de alrededor de 6,55 y que un pH de 7.00 es básico.
La mayoría de las sustancias tienen un pH en el rango de 0 a 14, aunque extremadamente ácido o extremadamente sustancias básicas pueden tener pH menor que 0 o mayor que 14. Un ejemplo es el ácido escorrentía de minas, con un pH = -3.6. Tenga en cuenta que esto no se traduce a una concentración molar de 3,981 M; tales valores de alta actividad son el resultado de la extremadamente alto valor del coeficiente de actividad, mientras que las concentraciones están dentro de un rango "razonable". Por ejemplo, un 7,622 molal H 2 SO 4 solución tiene un pH = -3,13, la actividad de hidrógeno α H + alrededor de 1350 y actividad coeficiente γ H + = 165,4 cuando se utiliza la convención MacInnes para escalar Pitzer coeficiente de actividad iónica única.
Arbitrariamente, el pH es ![- \ Log_ {10} {([\ mbox {H} ^ +])}](../../images/122/12253.png) . Por lo tanto,
. Por lo tanto,
o, por sustitución,
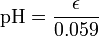 .
.
El "pH" de cualquier otra sustancia también se puede encontrar (por ejemplo, el potencial de iones de plata, o pAg +) mediante la derivación de una ecuación similar utilizando el mismo proceso. Estas otras ecuaciones para los potenciales no será el mismo, sin embargo, como el número de moles de electrones transferidos (n) será diferente para las diferentes reacciones.
Cálculo de pH para ácidos débiles y fuertes
Los valores de pH ácidos débiles y fuertes pueden aproximarse utilizando ciertas teorías e hipótesis.
Bajo la teoría de Brønsted-Lowry , ácidos fuertes o más débiles son un concepto relativo. Pero aquí definimos un ácido fuerte como una especie que es un ácido más fuerte que el ion hidronio (H 3 O +). En ese caso, la reacción de disociación (estrictamente HX + H 2 O↔H 3 O + + X - pero simplifica como HX↔H + + X -) llega a su terminación, es decir, nada de ácido sin reaccionar permanece en solución. Disolver el ácido fuerte HCl en agua, por lo tanto se puede expresar:
- HCl (ac) → H + + Cl -
Esto significa que en una solución de 0,01 mol / l de HCl que se aproxima que hay una concentración de iones de hidrógeno / L disueltos 0,01 Mol. Desde arriba, el pH es: pH = -log 10 [H +]:
- pH = -log (0.01)
que es igual a 2.
Para ácidos débiles, la reacción de disociación no va a la finalización. Un equilibrio se alcanza entre los iones de hidrógeno y el base conjugada. A continuación se muestra la reacción de equilibrio entre ácido metanoico y sus iones:
- HCOOH (aq) ⇌ H + + HCOO -
Es necesario conocer el valor de la constante de equilibrio de la reacción para cada ácido con el fin de calcular su pH. En el contexto de pH, esto se denomina el acidez constante del ácido, pero se trabajó a cabo de la misma manera (véase el equilibrio químico ):
- K a = [iones de hidrógeno] [iones de ácido] / [ácido]
Para HCOOH, K a = 1,6 × 10 -4
Al calcular el pH de un ácido débil, se asume generalmente que el agua no proporciona iones de hidrógeno. Esto simplifica el cálculo, y la concentración proporcionada por agua, 1 × 10 -7 mol / L, es generalmente insignificante.
Con una solución de 0,1 mol / l de ácido metanoico (HCOOH), la constante de acidez es igual a:
- K a = [H +] [HCOO -] / [HCOOH]
Teniendo en cuenta que una cantidad desconocida de ácido se ha disociado, [HCOOH] se reducirá en esta cantidad, mientras que [H +] y [HCOO -] serán cada aumentarse esta cantidad. Por lo tanto, [HCOOH] podrá sustituirse por 0,1 - x, y [H +] y [HCOO -] pueden estar cada uno sustituido por x, que nos da la siguiente ecuación:
La solución de este para x se obtiene 3,9 × 10 -3, que es la concentración de iones de hidrógeno después de la disociación. Por lo tanto el pH se -log (3,9 × 10 -3), o alrededor de 2,4.
Medición
| Sustancia | pH |
|---|---|
| El ácido clorhídrico , 10M | |
| Batería de plomo-ácido | |
| El ácido gástrico | |
| Jugo de limon | |
| Cola | |
| Vinagre | |
| Naranja o manzana jugo | |
| Jugo De Tomate | |
| Cerveza | |
| Lluvia Ácida | |
| Café | |
| Té o saludable piel | |
| Orina | |
| Leche | |
| Agua Pura | |
| Sana humana saliva | |
| Sangre | |
| Agua de mar | |
| Jabón de mano | |
| El amoníaco casero | |
| Lejía | |
| Lejía de Hogares |
pH se puede medir:
- por adición de una indicador de pH en la solución bajo estudio. El color del indicador varía en función del pH de la solución. El uso de indicadores, determinaciones cualitativas se pueden hacer con indicadores universales que tienen amplia variabilidad de color sobre un amplio rango de pH y determinaciones cuantitativas pueden hacerse usando indicadores que tienen una fuerte variabilidad de color sobre un pequeño intervalo de pH. Las mediciones precisas se pueden hacer en un amplio rango de pH a través de indicadores que tienen múltiples equilibrios en conjunto con métodos espectrofotométricos para determinar la abundancia relativa de cada componente dependiente del pH que componen el color de la solución, o
- mediante el uso de una medidor de pH junto con electrodos de pH selectivo ( electrodo de vidrio de pH, electrodo de hidrógeno, electrodo quinhidrona, campo iónico sensible efecto transistor y otros).
- mediante el uso de papel de pH, papel indicador que cambia de color que corresponde a un pH en una tecla de color. papel de pH es por lo general pequeñas tiras de papel (o una cinta continua que puede ser rasgado) que se ha empapado en una solución de indicador, y se utiliza para aproximaciones.
Los extremos inferior y superior de la escala de pH no se oxidan. La mitad de la escala es lo oxida, como el agua y la sangre.
Como la escala de pH es logarítmica, no se inicia en cero. Por lo tanto el más ácido de líquidos encontrados puede tener un pH tan bajo como -5. El más alcalina típicamente tiene un pH de 14. Medición de valores extremadamente bajos de pH tiene diversas complicaciones. La calibración del electrodo en tales casos se puede realizar con soluciones estándar de ácido sulfúrico concentrado cuyos valores de pH se puede calcular con el modelo de Pitzer.
Como un ejemplo de aplicación casa, la medición del valor pH se puede utilizar para cuantificar la cantidad de ácido en una piscina.
pOH
También hay pOH, en un sentido contrario de pH, que mide la concentración de iones OH -, o la basicidad. Desde auto agua ioniza, y notating [OH -] como la concentración de hidróxido de iones, tenemos
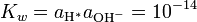 (*)
(*)
donde K w es la constante de ionización del agua.
Ahora, puesto
por identidades logarítmicas, entonces tienen la relación:
y por lo tanto
Esta fórmula es válida para la temperatura exactamente = 298,15 K (25 ° C) sólo, pero es aceptable para la mayoría de los cálculos de laboratorio.
Indicadores
Una indicador se utiliza para medir el pH de una sustancia. Indicadores comunes son papel de tornasol, fenolftaleína, naranja de metilo, rojo de fenol, bromotimol azul, verde de bromocresol y púrpura de bromocresol. Para demostrar el principio con materiales comunes de la casa, col roja, que contiene el colorante antocianina, se utiliza.
Agua de mar
En medición química pH oceanografía se complica por el propiedades químicas del agua de mar , y existen varias escalas de pH distintos.
Como parte de su definición operativa de la escala de pH, la IUPAC definir una serie de soluciones tampón a través de una gama de valores de pH (a menudo denotan con NBS o Designación NIST). Estas soluciones tienen una relativamente baja fuerza iónica (~ 0,1) en comparación con la del agua de mar (~ 0,7), y en consecuencia no se recomienda para su uso en la caracterización del pH del agua de mar (ya que las diferencias de fuerza iónica causan cambios en potencial de electrodo). Para resolver este problema, una serie alternativa de buffers basa en agua de mar artificial fue desarrollado. Esta nueva serie resuelve el problema de las diferencias de fuerza iónica entre las muestras y los tampones, y la nueva escala de pH se conoce como la escala total de, a menudo indicado como T pH.
La escala total se define utilizando un medio que contiene sulfato de iones. Estos iones experimentan protonación, H + + SO 4 2- ⇌ HSO 4 -, de manera que la escala total incluye el efecto de los dos protones (iones de hidrógeno "libres") y los iones de sulfato de hidrógeno:
- [H +] T = [H +] F + [HSO 4 -]
Una escala alternativa, la escala libre, a menudo denotado pH F, omite esta consideración y se centra únicamente en la [H +] F, en principio, por lo que es una representación más simple de la concentración de iones de hidrógeno. Analíticamente, sólo [H +] T se puede determinar, por lo que [H +] F debe ser estimada usando la [SO 4 2] y la constante de estabilidad del HSO 4 -, K S *:
- [H +] F = [H +] T - [HSO 4 -] = [H +] T (1 + [SO 4 2-] / K S *) -1
Sin embargo, es difícil estimar K * S en agua de mar, lo que limita la utilidad de la escala libre de otro modo más sencillo.
Otra escala, conocida como la escala de agua de mar, SWS pH denotado a menudo, tiene en cuenta una relación más protonación entre los iones de hidrógeno y iones fluoruro, H + + F - ⇌ HF. Resultando en la siguiente expresión para SWS [H +]:
- [H +] SWS = [H +] F + [HSO 4 -] + [HF]
Sin embargo, la ventaja de considerar esta complejidad adicional depende de la abundancia de fluoruro en el medio. En el agua de mar, por ejemplo, iones de sulfato se producen a concentraciones mucho mayores (> 400 veces) que las de fluoruro. En consecuencia, a efectos prácticos, la diferencia entre el total de agua de mar y escalas es muy pequeña.
Las tres ecuaciones siguientes resumen las tres escalas de pH:
- pH F = - log [H +] F
- pH T = - log ([H +] F + [HSO 4 -]) = - log [H +] T
- SWS pH = - log ([H +] F + [HSO 4 -] + [HF]) = - log SWS [H +]
En términos prácticos, las tres escalas de pH del agua de mar difieren en sus valores por hasta 0,12 unidades de pH, diferencias que son mucho más grande que la precisión de las mediciones de pH típicamente requerido (en particular en relación con el océano de sistema de carbonato). Puesto que omite la consideración de iones de sulfato y fluoruro, la escala libre es significativamente diferente de los dos el total de agua de mar y escalas. Debido a la falta de importancia relativa del ion fluoruro, el total de agua de mar y escalas sólo difieren ligeramente.
Fluidos corporales
| Fluido | pH |
|---|---|
| ácido gástrico | 0.7 |
| lisosoma | 5.5 |
| gránulo de cromafín | 5.5 |
| H Neutral 2 O a 37 ° C | 6.81 |
| citosol | 7.2 |
| CSF | 7.3 |
| arterial plasma sanguíneo | 7.4 |
| matriz mitocondrial | 7.5 |
| secreciones exocrinas páncreas | 8.1 |
El pH de diferente fluidos corporales varía con la función y otros factores. Mayormente se trata de un sistema estrechamente regulado para mantener el homeostasis ácido-base.

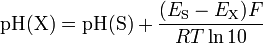
![\ Text {pH} = - \ log_ {10} \ left [\ frac {\ gamma_1 [\ text {H} ^ +])} {\ text {1 mol L} ^ {- 1}} \ right] \ pm 0.02](../../images/122/12238.png)

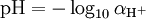
![\ Mbox {pH} \ aprox - \ log_ {10} {\ frac {[\ mathrm {H ^ +}]} {1 ~ \ mathrm {mol / L}}}](../../images/122/12251.png)

![\ Mbox {pH} = - \ log_ {10} {[{\ mbox {H} ^ +}]}](../../images/122/12254.png)