Liquide
Saviez-vous ...
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Mères SOS chaque regard après une une famille d'enfants parrainés .

| Mécanique des milieux continus |
|---|
 |
Lois
|
Mécanique des solides
|
|
Rhéologie
|
Le liquide est l'un des les quatre états fondamentaux de la matière (les autres étant solide , gaz et plasma ), et est le seul Etat avec un volume défini, mais pas de forme fixe. Un liquide est constitué de minuscules particules de vibration de la matière, tels que les atomes et molécules, maintenues ensemble par des liaisons intramoléculaires. L'eau est, de loin, le liquide le plus courant de la planète. Comme un gaz, un liquide est capable de se écouler et prendre la forme d'un récipient. Certains liquides résister à la compression, tandis que d'autres peuvent être compressés. Contrairement à un gaz, un liquide ne se disperse pas à remplir chaque espace d'un conteneur, et maintient une densité relativement constante. Une propriété caractéristique de l'état liquide est la tension de surface , conduisant à les phénomènes de mouillage.
La densité d'un liquide est habituellement voisine de celle d'un solide, et beaucoup plus élevé que dans un gaz. Par conséquent, liquide et solide sont à la fois appelé la matière condensée . D'autre part, comme des liquides et des gaz part l'aptitude à l'écoulement, ils sont tous deux appelés fluides. Bien que l'eau liquide est abondant sur Terre, cet état de la matière est en fait la moins courante dans l'univers connu, car les liquides nécessitent une gamme relativement étroite température / pression d'exister. Question la plus connue dans l'univers est sous forme gazeuse (avec des traces de matière solide détectable) que les nuages interstellaires ou sous forme de plasma à l'intérieur des étoiles.
Introduction

Le liquide est l'une des trois primaires états de la matière, avec les autres étant solide et le gaz . Un liquide est un fluide. Contrairement à un solide, les molécules dans un liquide ont une bien plus grande liberté de mouvement. Les forces qui lient les molécules dans un ensemble ne sont que temporaires solide dans un liquide, permettant à un liquide de se écouler alors que subsiste un solide rigide.
Un liquide, comme un gaz, affiche les propriétés d'un fluide. Un liquide peut se écouler, prendre la forme d'un récipient, et, se il est placé dans un récipient hermétique, distribuera pression appliquée uniformément sur toutes les surfaces dans le récipient. Contrairement à un gaz, un liquide peut pas toujours se mélanger facilement avec un autre liquide, ne sera pas toujours remplir chaque espace dans le conteneur, formant sa propre surface, et ne sera pas compresser significativement, sauf sous des pressions extrêmement élevées. Ces propriétés en font un liquide approprié pour des applications telles que hydraulique.
Particules liquides sont tenus fermement, mais pas de façon rigide. Ils sont capables de se déplacer librement autour de l'autre, ce qui entraîne un certain degré de mobilité des particules. Comme les température augmente, l'augmentation des vibrations des molécules provoque distances entre les molécules d'augmenter. Lorsqu'un liquide atteint son point d'ébullition , les forces de cohésion qui lient les molécules se brisent en étroite collaboration, et les changements de liquide à l'état gazeux (sauf surchauffe se produit). Si la température est diminuée, les distances entre les molécules deviennent plus petites. Lorsque le liquide atteint son point de congélation les molécules habituellement enfermer dans un ordre très spécifique, appelée cristallisation, et les liens entre eux deviendra plus rigide, en changeant le liquide dans son état solide (à moins que surfusion se produit).
Exemples
Seuls deux éléments sont liquides à conditions normales de température et de pression: le mercure et le brome . Quatre autres éléments ont des points de fusion légèrement supérieur à température ambiante: francium , le césium , le gallium et le rubidium . Les alliages métalliques qui sont liquides à température ambiante comprennent NaK, d'un alliage de métal de sodium-potassium, Galinstan, un liquide d'alliage fusible et certaines amalgames (alliages impliquant mercure).
Les substances pures qui sont liquides dans les conditions normales comprennent l'eau , l'éthanol et d'autres solvants organiques. L'eau liquide est d'une importance vitale dans la chimie et de la biologie; il est considéré comme une nécessité pour l'existence de la vie .
Liquides quotidiens importants comprennent aqueuses solutions comme ménage l'eau de Javel, autre des mélanges de différentes substances telles que huile minérale et essence, émulsions comme vinaigrette ou mayonnaise, suspensions comme le sang , et colloïdes comme peinture et le lait .
Beaucoup de gaz peuvent être liquéfiés par refroidissement, la production de liquides tels que l'oxygène liquide, l'azote liquide, un atome d'hydrogène liquide et hélium liquide. Pas tous les gaz peuvent être liquéfiés sous pression atmosphérique, par exemple du dioxyde de carbone ne peut être liquéfié à des pressions supérieures à 5,1 atm.
Certains matériaux ne peuvent pas être classées dans les trois états de la matière classiques; ils possèdent des propriétés solides et liquides-comme-like. Les exemples incluent des cristaux liquides utilisés dans les écrans LCD, et des membranes biologiques.
Applications
Les liquides ont une variété d'utilisations, comme les lubrifiants, les solvants et les liquides de refroidissement. Dans les systèmes hydrauliques, le liquide est utilisé pour transmettre la puissance.
En tribologie, liquides sont étudiés pour leurs propriétés lubrifiants. Des lubrifiants tels que l'huile sont choisis pour caractéristiques de viscosité et d'écoulement qui sont appropriés tout au long de la Température de fonctionnement du composant. Les huiles sont souvent utilisés dans les moteurs, boîtes de vitesses, la métallurgie, et des systèmes hydrauliques pour leurs bonnes propriétés de lubrification.
De nombreux liquides sont utilisés en tant que solvants , à dissoudre d'autres liquides ou solides. Des solutions sont trouvées dans une grande variété d'applications, y compris peintures, mastics, et les adhésifs. Naphte et l'acétone sont fréquemment utilisés dans l'industrie pour nettoyer l'huile, la graisse et le goudron de pièces et de machinerie. Les fluides corporels sont des solutions à base d'eau.
Les tensioactifs sont généralement trouvés dans des savons et détergents. Des solvants tels que l'alcool sont souvent utilisés comme antimicrobiens. On les trouve dans cosmétiques, encres et liquide lasers à colorant. Ils sont utilisés dans l'industrie alimentaire, dans des procédés tels que l'extraction de huile végétale.
Liquides ont tendance à avoir une meilleure la conductivité thermique de gaz, et la capacité d'écoulement permet un liquide approprié pour éliminer l'excès de chaleur à partir de composants mécaniques. La chaleur peut être évacuée par la canalisation du liquide à travers un Echangeur de chaleur, tel qu'un un radiateur ou de la chaleur peut être évacuée avec le liquide pendant évaporation. L'eau ou réfrigérants de glycol sont utilisés pour garder moteurs de la surchauffe. Les liquides de refroidissement utilisés dans les réacteurs nucléaires comprennent l'eau ou de liquides, tels que des métaux sodium ou de bismuth . Films de propergol liquide sont utilisés pour refroidir les chambres de poussée de roquettes. En usinage, l'eau et les huiles sont utilisées pour éliminer l'excès de chaleur générée, ce qui peut rapidement ruiner la fois la pièce et l'outillage. Pendant sueur, la sueur évacue la chaleur du corps humain par évaporation. Dans le Chauffage, ventilation et climatisation industrie (CVC), les liquides tels que l'eau sont utilisés pour transférer la chaleur d'un endroit à un autre.
Liquid est le composant principal du systèmes hydrauliques, qui tirent avantage de La loi de Pascal à fournir énergie hydraulique. Les dispositifs tels que les pompes et roues hydrauliques ont été utilisés pour modifier le mouvement du liquide dans le travail mécanique depuis les temps anciens. Les huiles sont forcés à travers pompes hydrauliques, qui transmettent cette force des vérins hydrauliques. Système hydraulique peut être trouvée dans de nombreuses applications, telles que freins automobile et transmissions, équipement lourd, et les systèmes de contrôle de l'avion. Divers presses hydrauliques sont largement utilisés dans la réparation et la fabrication, de levage, de pression, de serrage et de formage.
Les liquides sont parfois utilisés dans les appareils de mesure. Un thermomètre utilise souvent le la dilatation thermique de liquides, tels que le mercure , associée à leur capacité à se écouler pour indiquer la température. Un manomètre utilise le poids du liquide à indiquer pression d'air.
Propriétés mécaniques
Volume
Quantités de liquides sont généralement mesurés en unités de volume de . Ceux-ci comprennent le Unité SI mètre cube (m 3) et de ses divisions, en particulier le décimètre cube, plus communément appelé le litre (1 dm 3 = 1 L = 0,001 m 3), et le centimètre cube, également appelé millilitre (1 cm 3 = 1 mL = 0,001 L = 10 -6 m 3).
Le volumique d'une quantité de liquide est fixée par sa température et pression. Liquides étendre généralement lorsqu'il est chauffé et contrat lorsque refroidi. L'eau entre 0 ° C et 4 ° C est une exception notable. Liquides ont peu compressibilité: l'eau, par exemple, nécessite une pression de l'ordre de 200 bar pour augmenter sa densité par 1/1000. Dans l'étude de la dynamique des fluides, liquides sont souvent traitées comme incompressible, en particulier lorsque l'on étudie écoulement incompressible.
Pression et flottabilité
Dans un champ gravitationnel, liquides exercent la pression sur les côtés d'un récipient, ainsi que sur ne importe quoi dans le liquide lui-même. Cette pression est transmise dans tous les sens et augmente avec la profondeur. Si un liquide est au repos dans un champ gravitationnel uniforme, la pression, p, à ne importe quelle profondeur, z, est donnée par
où:
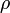 est la densité du liquide (supposée constante)
est la densité du liquide (supposée constante) 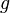 est l' accélération de la pesanteur .
est l' accélération de la pesanteur .
A noter que cette formule suppose que la pression au niveau de la surface libre est égale à zéro et que la tension superficielle effets peut être négligée.
Les objets sont immergés dans un liquide soumis au phénomène de flottabilité. (Flottabilité est également observé dans d'autres fluides, mais il est particulièrement forte dans les liquides en raison de leur haute densité.)
Surfaces

À moins que le volume d'un liquide correspond exactement au volume de son récipient, une ou plusieurs surfaces sont observées. La surface d'un liquide se comporte comme une membrane élastique, dans lequel la tension de surface affiche, permettant la formation de les gouttes et bulles. Les ondes de surface, action capillaire, mouillant, et ondulations sont d'autres conséquences de la tension de surface .
Flux
des mesures de viscosité de la résistance d'un liquide qui est soit déformé par une contrainte de cisaillement ou une contrainte en extension.
Lorsqu'un liquide est surfondue vers la de transition vitreuse, la viscosité augmente de façon spectaculaire! Le liquide devient alors un milieu viscoélastique qui montre à la fois la l'élasticité d'un solide et la fluidité d'un liquide, en fonction de l'échelle de temps de l'observation ou de la fréquence de perturbation.
Propagation du son
Dans un fluide de la seule non nulle la rigidité à la déformation volumétrique est (ne est pas un fluide à maintenir des forces de cisaillement). D'où la vitesse du son dans un fluide est donnée par 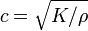 où K est le module de compressibilité du fluide, et la densité ρ. Pour donner une valeur typique, en eau douce c = 1,497 m / s à 25 ° C.
où K est le module de compressibilité du fluide, et la densité ρ. Pour donner une valeur typique, en eau douce c = 1,497 m / s à 25 ° C.
Thermodynamique
Phase transitions
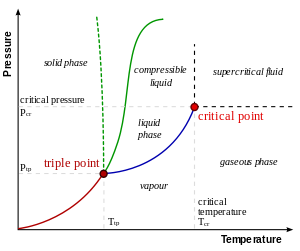
A une température inférieure au point d'ébullition , toute question sous forme liquide se évapore jusqu'à ce que la condensation de gaz ci-dessus atteindre un équilibre. À ce stade, le gaz se condense à la même vitesse que le liquide se évapore. Ainsi, un liquide ne peut exister de façon permanente si le liquide évaporé est éliminée en continu. Un liquide à son point d'ébullition se évapore plus rapidement que le gaz peut se condenser à la pression actuelle. Un liquide à ou au-dessus de son point d'ébullition est normalement bouillir, bien surchauffe peut empêcher cela dans certaines circonstances.
A une température inférieure au point de congélation d'un liquide aura tendance à cristalliser, le passage à sa forme solide. Contrairement à la transition vers le gaz, il n'y a pas d'équilibre à cette transition sous pression constante, de sorte que si surfusion se produit, le liquide sera finalement complètement cristalliser. Notez que ce ne est vrai que sous la pression constante, de sorte que par exemple l'eau et de la glace dans un récipient fermé forte pourrait parvenir à un équilibre où les deux phases coexistent. Pour le passage en face du solide au liquide, voir fusion.
Solutions
Les liquides peuvent afficher immiscibilité. Le mélange le plus familier de deux liquides non miscibles dans la vie quotidienne est le d'huile végétale et de l'eau dans Vinaigrette italienne. Un ensemble familier de liquides miscibles à l'eau et l'alcool. Les composants liquides dans un mélange peuvent souvent être séparés l'un de l'autre par distillation fractionnée.
Propriétés microscopiques
Statique facteur de structure

Dans un liquide, les atomes ne forment pas un réseau cristallin, pas plus qu'ils ne montrent toute autre forme de ordre à longue portée. Ceci est démontré par l'absence de Pics de Bragg dans X-ray et diffraction de neutrons. Dans des conditions normales, le motif de diffraction présente une symétrie circulaire, l'expression de la isotropie du liquide. En direction radiale, l'intensité de diffraction oscille doucement. Ceci est généralement décrit par la statique facteur de structure S (q), avec un nombre d'onde q = (4π / λ) sin donnée par la longueur d'onde λ de la sonde (photon ou un neutron) et le Bragg angle θ. Les oscillations de S (q) expriment l'ordre près du liquide, ce est à dire les corrélations entre un atome et quelques coquilles de près, seconde, ... voisins les plus proches.
Une description plus intuitive de ces corrélations est donnée par la fonction de distribution radiale g (r), qui est essentiellement le Transformée de Fourier S (q). Il représente une moyenne spatiale d'un instantané temporelle corrélations de paires dans le liquide.

Dispersion sonore et relaxation structurale
L'expression ci-dessus pour la vitesse du son 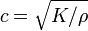 contient la vrac module K. Si K est indépendant de la fréquence, puis le liquide se comporte comme un moyenne linéaire, de sorte que le son se propage sans dissipation et sans couplage de modes. En réalité, tout liquide montre une certaine dispersion: avec une fréquence croissante, K traverse de la basse fréquence, limite de type liquide
contient la vrac module K. Si K est indépendant de la fréquence, puis le liquide se comporte comme un moyenne linéaire, de sorte que le son se propage sans dissipation et sans couplage de modes. En réalité, tout liquide montre une certaine dispersion: avec une fréquence croissante, K traverse de la basse fréquence, limite de type liquide  à la haute fréquence, limite solide comme
à la haute fréquence, limite solide comme  . Dans les liquides normales, la plupart de ces croix sur a lieu à des fréquences entre GHz et THz, parfois appelé Hypersound.
. Dans les liquides normales, la plupart de ces croix sur a lieu à des fréquences entre GHz et THz, parfois appelé Hypersound.
A des fréquences sous-GHz, un liquide normale ne peut pas soutenir des ondes de cisaillement: la limite de fréquence nulle de la module de cisaillement est 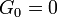 . Ce est parfois considérée comme la propriété la définition d'un liquide. Cependant, tout comme le gros module K, le module de cisaillement G est dépendante de la fréquence, et à des fréquences de Hypersound il montre une coupe similaire au-dessus de la limite liquide-like
. Ce est parfois considérée comme la propriété la définition d'un liquide. Cependant, tout comme le gros module K, le module de cisaillement G est dépendante de la fréquence, et à des fréquences de Hypersound il montre une coupe similaire au-dessus de la limite liquide-like  à un non-zéro limite solide comme,
à un non-zéro limite solide comme,  .
.
Selon le Kramers-Kronig rapport, la dispersion de la vitesse du son (donnée par la partie réelle de K ou G) va de pair avec un maximum dans l'atténuation du son (dissipation, donnée par la partie imaginaire de K ou G). Selon théorie de réponse linéaire, la transformée de Fourier de K ou G décrit la façon dont le système retourne à l'équilibre après une perturbation externe; pour cette raison, l'étape de dispersion dans la zone de GHz..THz est aussi appelée relaxation structurale. Selon le théorème de fluctuation-dissipation, la relaxation vers l'équilibre est intimement liée aux fluctuations de l'équilibre. Les fluctuations de densité associés avec les ondes sonores peuvent être observés expérimentalement par diffusion de Brillouin.
Sur surfusion un liquide vers la transition vitreuse, le crossover de type liquide aux mouvements de réponse solide comme du GHz à MHz, kHz, Hz, ...; de manière équivalente, le temps caractéristique de relaxation de structure augmente de ns à us, ms, s, ... Ce est l'explication microscopique pour le comportement viscoélastique des liquides mentionnés ci-dessus de formation de verre.
Effets de l'association
Les mécanismes de atomique / moléculaire diffusion (ou le déplacement des particules) dans les solides sont étroitement liés aux mécanismes de l'écoulement visqueux et la solidification des matériaux liquides. Les descriptions de en termes de viscosité moléculaire "espace libre" dans le liquide ont été modifiés au besoin pour tenir compte des liquides dont les molécules sont connues pour être "associée" à l'état liquide à la température ordinaire. Lorsque plusieurs molécules se combinent ensemble pour former une molécule associée, elles renferment dans un système semi-rigide une certaine quantité d'espace qui est disponible avant que l'espace libre pour les molécules mobiles. Ainsi, l'augmentation de viscosité lors du refroidissement dû à la tendance de la plupart des substances à se associer au refroidissement.
Des arguments similaires pourraient être utilisés pour décrire les effets de pression sur la viscosité, où on peut supposer que la viscosité est principalement fonction du volume pour des liquides ayant un fini compressibilité. Une augmentation de la viscosité à l'élévation de la pression est donc attendu. En outre, si le volume est dilaté par la chaleur, mais encore réduite par la pression, la viscosité reste la même.
La tendance locale à l'orientation de molécules en petits groupes prête le liquide (comme mentionné précédemment) un certain degré d'association. Cette association se traduit par une "pression interne" considérable au sein d'un liquide, qui est presque entièrement attribuable à ces molécules qui, en raison de leurs faibles vitesses temporaires (suite de la distribution de Maxwell) ont coalisés avec d'autres molécules. La pression interne entre plusieurs de ces molécules pourrait correspondre à celle entre un groupe de molécules sous forme solide.