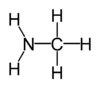
Amine
Informações de fundo
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Todas as crianças disponíveis para apadrinhamento de crianças de Crianças SOS são cuidadas em uma casa de família pela caridade. Leia mais ...

As aminas são compostos orgânicos e grupos funcionais que contêm um base de azoto átomo com um par solitário. Aminas são derivados de amoníaco , em que um ou mais de hidrogénio são substituídos por átomos orgânica substituintes tais como alquilo e grupos arilo. Os compostos com o átomo de azoto ao lado de um carbonilo da estrutura RC (= O) NR 2 são chamados amidos e tem propriedades químicas diferentes. Aminas importantes incluem aminoácidos , aminas biogênicas, trimetilamina (cheiro de peixe), e anilina; ver Categoria: As aminas para uma lista de aminas.
Introdução
Aminas alifáticas
Tal como apresentado nas imagens abaixo, as aminas primárias surgem quando um dos três átomos de hidrogénio em amoníaco é substituído por um substituinte orgânico. As aminas secundárias têm dois substituintes orgânicos ligados a N em conjunto com um H. Em aminas terciárias todos os três átomos de hidrogénio são substituídos por orgânica substituintes. É também possível ter quatro substituintes alquilo no azoto. Estes compostos têm um centro de azoto carregado, e necessariamente vir com um contra-ião negativo, por isso eles são chamados quaternário sais de amónio.
| Amina primária | Amina secundária | Amina terciária |
|---|---|---|
 |  |  |
Do mesmo modo, um composto orgânico com grupos amino múltiplos é chamado uma diamina, triamina, tetramina e assim por diante.
Aminas aromáticas
As aminas aromáticas têm o átomo de azoto ligado a um anel aromático como nas anilinas. O anel aromático diminui fortemente o basicidade da amina, dependendo dos seus substituintes. Interessantemente, a presença de um grupo amina aumenta fortemente a reactividade do anel aromático, devido a um efeito dador de electrões. Um reacção orgânico envolvendo as aminas aromáticas é a Reação Goldberg.
Convenções de Nomenclatura
- o prefixo "N" mostra a substituição no átomo de azoto
- como prefixo: "amino"
- como sufixo: "amina"
- lembre-se que os compostos químicos não são nomes próprios, caso assim inferior é indicado por toda parte.
Nomes sistemáticos de algumas aminas comuns:
| Aminas inferiores são nomeados com o sufixo amina. | Aminas mais elevadas têm o prefixo amino como um grupo funcional. |
- Aminas primárias:
- metilamina
- etanolamina ou 2-aminoetanol
- trisamina (ou, mais comumente tris) (Sua Sal de HCl é usado como um pH agente tampão em bioquímica )
- Aminas secundárias:
- dimetilamina
- metiletanolamina ou 2- (metilamino) etanol
- Aminas cíclicas:
- aziridina (anel 3-membro),
- azetidina (anel de 4 membros),
- pirrolidina (anel de 5 membros) e
- piperidina (anel de 6 membros)
- Aminas terciárias:
- trimetilamina
- metildietanolamina (MDEA)
- dimetiletanolamina (DMEA) ou 2- (dimetilamino) etanol
- bis-tris (É usado como um agente de tamponamento de pH em bioquímica)
Propriedades físicas
Propriedades gerais
- Ligação de hidrogénio que influencia significativamente as propriedades de aminas primárias e secundárias, bem como os derivados de todas as aminas protonadas. Assim, o ponto de ebulição de aminas é mais elevada do que as do correspondente fosfinas, mas geralmente mais baixos do que os dos correspondentes álcoois . Álcoois, ou alcanóis, assemelham-se aminas, mas possuem um grupo OH no lugar de NR 2. Desde oxigênio é mais eletronegativo que o nitrogênio, RO- H é tipicamente mais ácido do que o R2 N- H composto relacionado.
- Metil-, dimetil-, trimetil-, e etilamina são gases sob condições padrão, enquanto dietilamina e trietilamina são líquidos. A maioria das outras alquilaminas comum são líquidos; alta aminas de peso molecular são, é claro, de sólidos.
- Aminas gasosos possuem um cheiro característico de amônia, aminas líquidos têm um cheiro característico "suspeito".
- A maioria das aminas alifáticas exibir alguma solubilidade em água, o que reflecte a sua capacidade para formar ligações de hidrogénio. A solubilidade diminui com o aumento do número de átomos de carbono, especialmente quando o número de átomos de carbono é superior a 6.
- Aminas alifáticas exibir solubilidade significativa em orgânicos solventes , especialmente solventes orgânicos polares. As aminas primárias reagem com as cetonas tais como a acetona , e a maioria das aminas são incompatíveis com clorofórmio e tetracloreto de carbono .
- As aminas aromáticas, tais como anilina, têm seus elétrons par solitário conjugada no anel benzeno, portanto, a sua tendência para se envolver em ligações de hidrogénio é diminuída. Caso contrário, eles exibem as seguintes propriedades:
- Os pontos de ebulição são geralmente ainda elevado devido ao seu tamanho maior.
- Diminuiu a solubilidade em água, apesar de manter a sua solubilidade em solventes orgânicos adequados apenas.
- Eles são tóxicos e são facilmente absorvidos através da pele: assim perigosos.
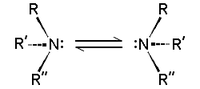
Chirality
As aminas terciárias do tipo NHRR 'e NRR'R "são quiral: o átomo de azoto suporta quatro substituintes distintas contando o par solitário. A barreira de energia para a inversão do estereocentro é relativamente baixo, por exemplo, ~ 7 kcal / mol para uma trialquilamina. A interconversão dos estereoisómeros tem sido comparado com a inversão de um guarda-chuva aberto para um vento forte. Devido a esta baixa barreira, aminas tais como NHRR 'não pode ser resolvido opticamente e NRR'R "só pode ser resolvido quando o R, R', e R" grupos são limitados em estruturas cíclicas.
Propriedades como bases
Tal como amónia, aminas actuar como bases e são razoavelmente forte (veja a tabela de exemplos de conjugado ácido K umas valores). O carácter básico de aminas depende:
- A disponibilidade do par de electrões no átomo de azoto.
- As propriedades eletrônicas dos substituintes (grupos alquilo melhorar a basicidade, os grupos arilo diminuí-lo).
- O grau de solvatação da amina protonada.
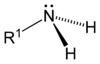
O átomo de azoto possui uma par elétron solitário que se pode ligar H + para formar uma ião de amónio R 3 NH +. O par de elétrons livres é representado neste artigo por um dois pontos acima ou ao lado do N. A água solubilidade de aminas simples é em grande parte devido à ligação de hidrogênio entre prótons nas moléculas de água e esses pares de elétrons solitários.
- Efeito indutivo de grupos alquilo
| Íons de composto | K b |
|---|---|
| Amoníaco NH3 | 1,8 · 10 -5 M |
| Metilamina CH3 NH2 | 4,4 · 10 -4 M |
| propilamina CH 3 CH 2 CH 2 NH 2 | 4,7 · 10 -4 M |
| 2-propilamina (CH 3) 2 CHNH 2 | 5.3 · 10 -4 M |
| dimetilamina (CH3) 2NH | 5,4 · 10 -4 M |
- + Eu efeito de grupos alquilo aumenta a energia do par de electrões desemparelhados, elevando assim a basicidade.
- Efeito mesomérico de sistemas aromáticos
| Íons de composto | K b |
|---|---|
| Amoníaco NH3 | 1,8 · 10 -5 M |
| Anilina C 6 H 5 NH 2 | 3,8 · 10 -10 M |
| 4-metilfenilamina 4-CH 3 C 6 H 4 NH 2 | · 1,2 10 -9 M |
- + Efeito M de anel aromático deslocalizar o par de elétrons livres no anel, resultando em diminuição da basicidade.
O grau de protonação das aminas protonadas:
| Íons de composto | O número máximo de H-bond |
|---|---|
| NH 4 + | 4 Muito solúvel em H 2 O |
| 3 + RNH | 3 |
| R 2 NH 2 + | 2 |
| R3 NH + | 1 Pelo menos solúvel em H2O |
Síntese
Existem os seguintes métodos laboratoriais para a preparação de aminas:
- via Gabriel síntese:
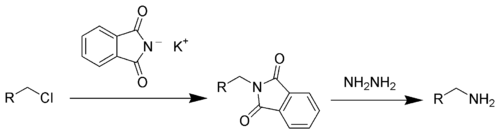
- via azidas pela Redução Staudinger.
- A partir de ácidos carboxílicos na Reacção de Schmidt.
- Aminas alílico podem ser preparados a partir de iminas na Reacção de aza-Baylis-Hillman.
- via Hofmann de amidas degradação. Esta reacção é válido para a preparação de apenas aminas primárias. Dá bons rendimentos de aminas primárias não contaminados por outras aminas.
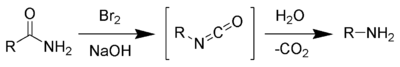
- Sais de amónio quaternário depois do tratamento com base forte submeter a chamada Hofmann Eliminação
- Redução de nitrilos, e amidas compostos de grupo nitro:

- Nitrilos são reduzidas a aminas usando hidrogénio na presença de um catalisador de níquel, apesar de condições ácidas ou alcalinas deve ser evitada para evitar a hidrólise do grupo -CN. LiAlH4 é mais comummente empregue para a redução de nitrilos em escala laboratorial. Da mesma forma, reduz-se LiAlH 4 amidas para aminas:

- A redução de compostos nitrados a aminas pode ser realizada com elementar de zinco , estanho ou ferro com um ácido .
- Substituição nucleofílica de haloalcanos. As aminas primárias podem também ser sintetizados por alkylaton de amoníaco. Haloalcanos reagir com aminas para dar uma amina substituída com alquilo correspondente, com a libertação de um ácido de halogénio. Tais reacções, que são mais úteis para os brometos e iodetos de alquilo, são raramente utilizados porque o grau de alquilação é difícil de controlar. Se a reacção de amina terciária é, uma catião amónio quaternário resulta na Menshutkin reação. Muitos sais de amónio quaternários podem ser preparados por esta via, com diversos grupos R e diversos aniões de haletos e pseudo-haletos.
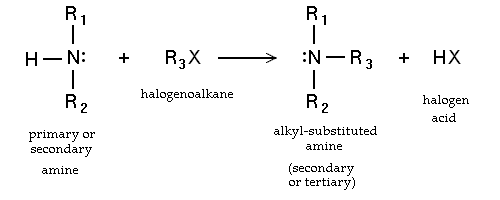
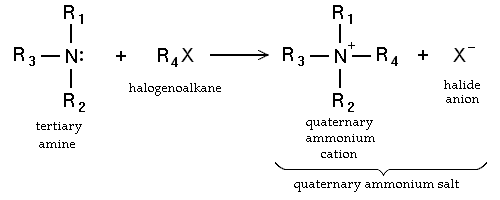
- através de halogenetos e hexamina no Reação Delepine
- aminas arilo podem ser obtidos a partir de aminas e haletos de arilo na Buchwald-Hartwig reação
- a partir de alcenos e alcinos em hidroaminação
- de rearranjo de haloaminas no Reacção Hofmann-Löffler
Reações
Aminas reagir numa variedade de formas:
- Por substituição acilo nucleofílica. E cloretos de acilo anidridos de ácido reage com aminas primárias e secundárias em frio para formar amidas do Reacção de Schotten-Baumann. As aminas terciárias não pode ser acilado, devido à ausência de um átomo de hidrogénio substituível. Com o muito menos ativa cloreto de benzoílo, ainda acilação pode ser realizada pela utilização de excesso de alcali aqeous para facilitar a reacção.

- Porque aminas são básicos, eles neutralizam os ácidos carboxílicos para formar os sais de carboxilato de amónio correspondentes. Após aquecimento a 200 ° C, os sais de aminas primárias e secundárias desidratar para formar o correspondente amidas.
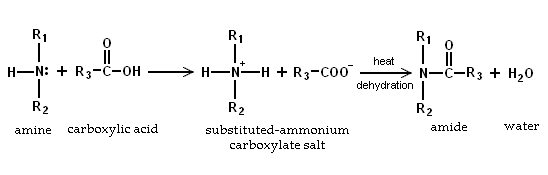
- Por formação de sal de amónio. As aminas R3N reagir com ácidos fortes, tais como ácido iodídrico, ácido bromídrico e ácido clorídrico em reacções de neutralização formando sais de amónio R 3 NH +.
- Por formação de sal de diazónio. O ácido nitroso com a fórmula HNO 2 é instável, por conseguinte, normalmente, uma mistura de NaNO2 e diluir o ácido clorídrico ou o ácido sulfúrico é utilizado para a produção de ácido nitroso indirectamente. Aminas alifáticos primários com ácido nitroso dar sais de diazónio muito instáveis que se decomponham espontaneamente por perder N 2 para formar ião carbónio. O ião carbónio prossegue para produzir uma mistura de alcenos , ou alcanóis halogenetos de alquilo, com alcanóis como o produto principal. Esta reacção é de pouca importância sintética porque o sal de diazónio formado é demasiado instável, mesmo em condições de frio.
- NaNO 2 + HCl → HNO 2 + NaCl
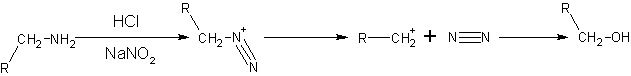
- Aminas aromáticas primárias, tais como anilina (fenilamina) forma mais estável iões de diazónio, a 0-5 ° C. Acima de 5 ° C, que irão decompor-se para dar o fenol e N 2. Sais de arenodiazónio pode ser isolado na forma cristalina, mas são geralmente utilizados em solução imediatamente após a sua preparação, devido à decomposição rápida em repouso mesmo quando frio. O sal arenodiazónio sólido é explosivo mediante choque ou aquecimento suave. Devido à sua maior estabilidade, sais de arenodiazónio sinteticamente são mais úteis do que os seus homólogos alliphatic. Uma vez que não é necessário isolar o sal diazónio, uma vez que é formado um outro reagente tal como cianeto cuproso pode simplesmente ser adicionada à mistura, e com aquecimento suave da solução, uma reacção de substituição ocorre juntamente com a libertação de azoto. Além disso, arenodiazónio iões pode também submeter-se a uma reacção de acoplamento com um composto aromático altamente activado, tal como um fenol para formar uma composto azo.
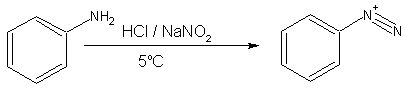
- Por formação de imina. As aminas primárias reagem com as cetonas e aldeídos para formar iminas. No caso de formaldeído (R '= H), estes produtos são tipicamente cíclico tr�eros.
- RNH2 + R '2 C = O → R' 2 C = NR + H2O
- As aminas secundárias reagem com aldeídos e cetonas para formar enaminas
- R 2 NH + R '(R "CH 2) C = O → R" CH = C (NR 2) R' + H2O
- Por a oxidação compostos nitrosos, por exemplo, com ácido peroxymonosulfuric.
- Por redução de catiões de amónio quaternário, aminas terciárias no Emde degradação.
- Por rearranjo de anilinas N-alquil-se a arilo anilinas substituídas na Hofmann-Martius rearranjo.
- aminas primárias e secundárias reagem com sais de piridínio do Reação Zincke
- Por clivagem (apenas aminas terciárias) com brometo de cianogénio na Reacção Von Braun.
A actividade biológica
Aminas têm, típico, odores desagradáveis fortes, e são tóxicos. O cheiro de amônia, peixe velho, urina, carne podre e sêmen estão compostas principalmente de aminas. Muitos tipos de atividade biológica produzir aminas por quebra de aminoácidos .
A utilização de aminas
Corantes
As aminas aromáticas primárias são utilizadas como material de partida para o fabrico de corantes azo. Ele reage com ácido nítrico (III) para formar o sal de diazónio, o qual pode sofrer uma reacção de acoplamento para formar composto azo. Tal como azo-compostos são altamente coloridos, eles são largamente utilizados nas indústrias de tingimento, tais como:
- Metil laranja
- Marrom Direto 138
- Amarelo-sol FCF
- Encarnado vivo
Drogas
- Chlorpheniramine é um anti-histamínico que ajuda a aliviar doenças alérgicas devido ao frio, febre do feno, comichão na pele, picadas de insetos e picadas.
- Clorpromazina é um tranquilizante que sedates sem induzir o sono. Ele é usado para aliviar a ansiedade, excitação, agitação ou mesmo transtorno mental.
- Efedrina e A fenilefrina, como hidrocloretos de amina, são utilizadas como descongestionantes.
- A anfetamina, Metanfetamina, e Methcathinone são aminas que estão listados como substâncias controladas pela DEA.
- Amitriptilina, A imipramina, Lofepramine e Clomipramina são tricíclico antidepressivos e aminas terciárias
- Nortriptilina, Desipramine, e Amoxapina são antidepressivos tricíclicos e aminas secundárias
- (Os tricylics são agrupados pela natureza do grupo final de amina na cadeia lateral).
Tratamento de gás
- Aquoso monoetanolamina (MEA), diglicolamina (DGA), dietanolamina (DEA), di-isopropanolamina (DIPA) e metildietanolamina (MDEA) são amplamente utilizados industrialmente para a remoção de dióxido de carbono (CO 2) e sulfeto de hidrogênio (H 2 S) a partir de fluxos de gás natural e fluxos de processo de refinaria. Eles também podem ser utilizados para remover CO2 dos gases de combustão / gases de combustão e pode ter potencial para redução de gases de efeito estufa.