
Aminoácido
Fundo para as escolas Wikipédia
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Para comparar instituições de caridade de patrocínio esta é a melhor ligação de patrocínio .
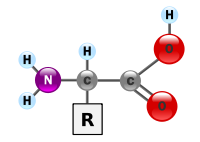
Os aminoácidos são moléculas que contêm uma amina , um grupo ácido carboxílico e um grupo de cadeia lateral que varia entre diferentes aminoácidos. Os elementos-chave de um aminoácido são carbono , hidrogênio , oxigênio e nitrogênio . Eles são particularmente importantes na bioquímica, onde o termo refere-se geralmente a ácidos alfa-amino.
Um ácido alfa-amino tem o genérico fórmula H 2 NCHRCOOH, onde R é um grupo orgânico substituinte; o grupo amino está ligado ao átomo de carbono imediatamente adjacentes ao grupo carboxilato (a α-carbono). Existem outros tipos de aminoácidos em que o grupo amino está ligado a um átomo de carbono diferente; por exemplo, em ácidos gama-amino (tal como ácido gama-amino-butírico) o átomo de carbono ao qual o grupo amino liga é separada a partir do grupo carboxilato por dois outros átomos de carbono. Os vários ácidos alfa-amino em que diferem cadeia lateral (grupo R) está ligado ao seu carbono alfa, e pode variar em tamanho de apenas um átomo de hidrogénio no átomo glicina a um grande grupo heterocíclico em triptofano.
Os aminoácidos são essenciais para a vida, e tem muitas funções no metabolismo. Uma função é particularmente importante para servir como blocos de construção de proteínas , que são simplesmente cadeias lineares de aminoácidos. Assim como as letras do alfabeto podem ser combinados para formar uma variedade quase infinita de palavras, os aminoácidos podem ser ligados entre si em diferentes sequências para formar uma vasta variedade de proteínas.
Devido ao seu papel central na bioquímica, os aminoácidos são importantes na nutrição e são normalmente utilizados em tecnologia de alimentos e indústria . Por exemplo, glutamato monossódico é um comum intensificador de sabor que dá o sabor de alimentos umami. Na indústria, aplicações incluem a produção de plásticos biodegradáveis, drogas, e Os catalisadores quirais.
História
Os primeiros aminoácidos foram descobertos no início do século 19. Em 1806, os químicos franceses Louis-Nicolas Vauquelin e Pierre Jean Robiquet isolado um composto em espargos que provou ser asparagina, o primeiro aminoácido a ser descoberto. Outro aminoácido que foi descoberta no início do século 19 foi cistina, em 1810, embora a sua monômero, cisteína, foi descoberto muito tempo depois, em 1884. E Glicina leucina também foram descobertos em torno desta vez, em 1820. O uso do termo aminoácido no idioma Inglês é de 1.898 .
Estrutura geral
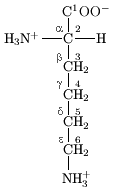
Na estrutura mostrada na parte superior da página, o símbolo R representa um cadeia lateral específica para cada aminoácido. O carbono átomo ao lado do grupo carboxilo é chamado o α-carbono e ácidos aminados com uma cadeia lateral ligada a esta de carbono são referidas como os ácidos alfa-amino. Estas são a forma mais comum encontrado na natureza. Nos ácidos alfa-amino, o α-carbono é um átomo de carbono quiral, com a excepção de glicina. Em aminoácidos que têm uma cadeia de carbono ligado ao α-carbono (tal como lisina, como mostrado à direita) são os carbonos rotulados de modo como α, β, γ, δ, e assim por diante. Em alguns aminoácidos, o grupo amina está ligado ao β ou γ-carbono, e estes são, por conseguinte, referida como ácidos aminados beta ou gama.
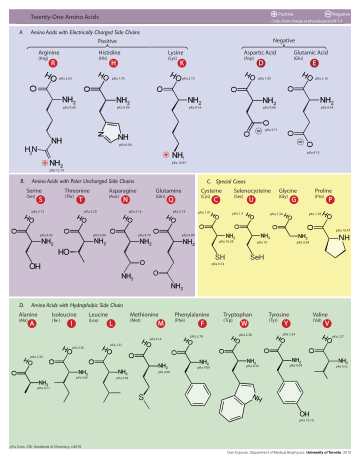
Os aminoácidos são geralmente classificados pela propriedades da sua cadeia lateral em quatro grupos. A cadeia lateral pode fazer um um aminoácido ácido fraco ou uma fraco de base, e um hidrófilo, se a cadeia lateral é polar ou um hidrófobos se for apolar. O estruturas químicas dos vinte e dois aminoácidos convencionais, juntamente com as suas propriedades químicas, são descritos mais detalhadamente no artigo sobre estes aminoácidos proteinogenic.
A frase " amino ácidos de cadeia ramificada "refere-se a BCAA ou os aminoácidos possuindo cadeias laterais alifáticas que são não-linear; estes são leucina, isoleucina, e valina. A prolina é a única aminoácido proteinogênicos cujo lado grupo liga ao grupo amino-α e, portanto, é também o único aminoácido proteinogênicos contendo uma amina secundária nesta posição. Quimicamente, a prolina é, portanto, uma iminoácido, uma vez que falta um grupo amino primário , embora ainda seja classificado como um aminoácido na nomenclatura bioquímica em curso, e pode também ser chamado uma "alfa-aminoácido N-alquilado".
Isomeria
Dos ácidos padrão α-amino, mas todos glicina pode existir em qualquer dos dois isómeros ópticos, chamados aminoácidos L ou D, que são imagens no espelho um do outro (ver também Quiralidade). Enquanto os ácidos L-amino representar todos os aminoácidos encontrados nas proteínas durante a tradução no ribossoma, ácidos D -amino são encontrados em algumas proteínas produzidas pela enzima modificações pós-tradução, após a tradução e a translocação para o retículo endoplasmático, a partir de organismos que vivem no mar exóticos tais como caracóis cone. Eles também são componentes abundantes do peptidoglycan paredes celulares de bactérias , e D-serina pode actuar como um neurotransmissor no cérebro . A convenção L e D para a configuração de aminoácidos não se refere à actividade óptica do amino ácido em si, mas sim para a actividade óptica do isómero de gliceraldeído a partir do qual esse aminoácido pode, teoricamente, ser sintetizado (D -glyceraldehyde é dextrorotary; L é -glyceraldehyde levorotary). Alternativamente, a (S) e (R) designadores são usados para indicar o absoluto estereoquímica. Quase todo o aminoácidos em proteínas são (S) no carbono α, sendo cisteína com (R) e a glicina não-quiral. A cisteína é invulgar, uma vez que tem um enxofre átomo, na segunda posição na sua cadeia lateral, que tem uma maior massa atómica do que os grupos ligados ao primeiro carbono que está ligado ao α-carbono nos outros aminoácidos padrão, assim, o (R) em vez de (S).
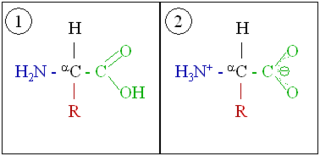
Zwiteriões
Os grupos funcionais de amina e de ácido carboxílico encontrados em aminoácidos permitir que ele tenha Propriedades anfótero. Num certo pH, conhecido como o ponto isoeléctrico, um aminoácido não tem carga global, uma vez o número de protonados grupos de amônia (cargas positivas) e grupos carboxilatos desprotonados (cargas negativas) são iguais. Os amino ácidos todos têm diferentes pontos isoeléctricos. Os iões produzidos no ponto isoeléctrico têm cargas positivas e negativas e são conhecidos como um zwitterion, que vem da palavra alemã que significa Zwitter "hermafrodita" ou "híbrido". Os aminoácidos podem existir como iões anfotéricos em sólidos e em soluções polares, tais como água, mas não na fase gasosa. Zwitteriões têm mínima solubilidade no seu ponto isoeléctrico e um aminoácido pode ser isolado por precipitando-o a partir de água por ajuste do pH ao seu ponto isoeléctrico particular.
Ocorrência e funções em bioquímica
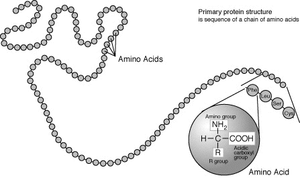
Aminoácidos standard
Os aminoácidos são as unidades estruturais que constituem as proteínas. Eles se juntam para formar curta cadeias de polímeros chamados péptidos ou cadeias mais longas ou chamada polipéptidos ou proteínas . Estes polímeros são lineares e não ramificado, com cada um dos aminoácidos na cadeia ligada a dois aminoácidos vizinhos. O processo de produção de proteínas é chamado tradução e envolve a adição passo-a-passo de aminoácidos a uma cadeia de proteína crescente pela ribozima que é chamado de ribossomo. A ordem em que são adicionados os aminoácidos é lido através do código genético de um molde de ARNm, que é um De uma cópia de RNA do organismo de genes.
Vinte e dois ácidos aminados são incorporados naturalmente em polipéptidos e são chamados aminoácidos proteinogenic ou padrão. Destes vinte e dois, vinte são codificados pelo código genético universal. Os dois restantes, selenocisteína e pirrolisina, são incorporados em proteínas por mecanismos sintéticos únicos. Selenocisteína é incorporado quando o ARNm a ser traduzido inclui um SECIS elemento, o que faz com que o códon UGA para codificar selenocisteína em vez de um códon de terminação. Pyrrolysine é utilizado por alguns metanogênico archaea em enzimas que eles usam para produzir metano . Ele é codificado para com o codão UAG, que é normalmente um codão de paragem em outros organismos.
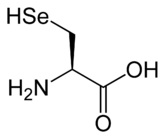
Aminoácidos não-padrão
Além dos vinte e dois aminoácidos convencionais, há um grande número de aminoácidos "não normalizado". Estes aminoácidos não padrão encontrados em proteínas são formados por modificação pós-translacional, que é a modificação após tradução na síntese de proteínas. Estas modificações são muitas vezes essencial para a função de regulação ou de uma proteína; por exemplo, a carboxilação de glutamato permite uma melhor ligação de catiões de cálcio, e o hidroxilação de prolina é crítica para a manutenção tecidos conjuntivos. Outro exemplo é a formação de no hipusina factor de iniciação da tradução ElF5A, através da modificação de um resíduo de lisina. Tais modificações também pode determinar a localização da proteína, por exemplo, a adição de grupos hidrófobos de comprimento pode causar uma proteína para se ligar a um membrana fosfolipídica.
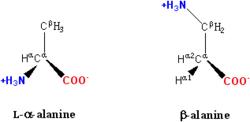
Exemplos de aminoácidos não padrão que não são encontradas em proteínas incluem lantionina, Ácido 2-aminoisobutírico, desidroalanina e o neurotransmissor ácido gama-aminobutírico. Aminoácidos não padrão geralmente ocorrem como intermediários na vias metabólicas para os aminoácidos convencionais - por exemplo e ornitina citrulina ocorrer no ciclo da uréia, parte do ácido amino catabolismo (ver abaixo). Uma rara exceção à dominância de ácidos amino-α em biologia é o ácido β-amino beta-alanina (ácido 3-aminopropanóico), que é utilizado em plantas e microrganismos na síntese de ácido pantoténico (vitamina B 5), um componente de coenzima A.
Na nutrição humana
Quando levado para o corpo humano a partir da dieta, os vinte e dois aminoácidos convencionais são utilizadas para sintetizar proteínas e outras biomoléculas ou oxidado para ureia e dióxido de carbono como uma fonte de energia. A via de oxidação começa com a remoção do grupo amino por um transaminase, o grupo amino é, então, alimentada para a ciclo da uréia. O outro produto de transamidação é um ácido ceto que entra no ciclo do ácido cítrico. Glicogênicos aminoácidos também podem ser convertidos em glicose, através gliconeogênese.
Pyrrolysine traço é restrita a vários micróbios, e apenas um organismo tem tanto Pyl e cap. Dos vinte e dois aminoácidos convencionais, oito são chamados aminoácidos essenciais, porque o corpo humano não pode sintetizá-los a partir de outros compostos ao nível necessário para o crescimento normal, assim que devem ser obtidos a partir de alimentos. No entanto, a situação é bastante complicada, pois cisteína, taurina, tirosina, e histidina arginina são aminoácidos semiessential em crianças, pois as vias metabólicas que sintetizam estes aminoácidos não estão completamente desenvolvidos. Os valores exigidos também dependem da idade e da saúde do indivíduo, por isso é difícil fazer afirmações gerais sobre a exigência dietética de alguns aminoácidos.
| Essencial | Não essencial |
|---|---|
| Isoleucina | Alanina |
| Leucina | Asparagina |
| Lisina | Ácido Aspártico |
| Metionina | Cisteína * |
| Fenilalanina | Ácido glutâmico |
| Treonina | Glutamina * |
| Triptofano | Glycine * |
| Valina | Prolina * |
| Selenocisteína * | |
| Serina * | |
| Tirosina * | |
| Arginina * | |
| Histidina * | |
| Ornithine * | |
| Taurina * |
(*) Essencial apenas em determinados casos.
Funções não-protéicos
Nos seres humanos, aminoácidos não-proteína, também têm um papel importante como intermediários metabólicos, tais como na biossíntese do neurotransmissor ácido gama-aminobutírico. Muitos aminoácidos são utilizados para sintetizar outras moléculas, por exemplo:
- O triptofano é um precursor do neurotransmissor serotonina.
- A tirosina é um precursor do neurotransmissor dopamina.
- A glicina é um precursor de porfirinas, tais como heme.
- A arginina é um precursor de óxido nítrico.
- Ornitina e S-adenosil-metionina são precursores de poliaminas.
- Aspartato, e glicina são precursores de glutamina nucleótidos.
- Fenilalanina é um precursor de várias fenilpropan�des que são importantes no metabolismo da planta.
No entanto, nem todas as funções de outros aminoácidos não padrão abundantes são conhecidos, por exemplo taurina é um aminoácido importante em tecidos musculares e cerebrais, mas apesar de muitas funções têm sido propostos, o seu papel preciso no corpo ainda não foi determinada.
Alguns aminoácidos não padrão são usadas como defesas contra herbívoros em plantas. Por exemplo canavanina é um análogo arginina que é encontrado em muitos legumes, e em especial grandes quantidades em Canavalia gladiata (feijão de espada). Este aminoácido protege as plantas de predadores, como insetos e pode causar doença em pessoas, se alguns tipos de legumes são consumidos sem transformação. O aminoácido não proteico mimosina é encontrado em outras espécies de leguminosas, particularmente Leucaena leucocephala. Este composto é um análogo tirosina e podem envenenar animais que pastam nessas plantas.
Usa em tecnologia
Os aminoácidos são usados para uma variedade de aplicações na indústria, mas a sua utilização principal é como aditivos para alimentação animal. Isto é necessário uma vez que muitos dos componentes em massa destes alimentos, tais como soja , ou têm níveis baixos ou falta alguma da aminoácidos essenciais: lisina, metionina, treonina e triptofano são mais importantes na produção destes alimentos. O indústria de alimentos também é um grande consumidor de aminoácidos, particularmente ácido glutâmico, que é utilizado como um intensificador de sabor, e Aspartame (aspartil-fenilalanina-1-metilo éster) como um baixo teor calórico adoçante artificial. O resto da produção de aminoácidos é utilizado na síntese de drogas e cosméticos.
| Derivado de aminoácido | Aplicação farmacêutica |
|---|---|
| 5-HTP (5-hidroxitriptofano) | Tratamento experimental para a depressão. |
| L-DOPA (L-di-hidroxifenilalanina) | O tratamento para a Parkinsonismo. |
| Eflornithine | Drogas que inibe ornitina descarboxilase e é utilizado no tratamento de doença do sono. |
Código genético expandido
Desde 2001, 40 aminoácidos não naturais foram adicionados a proteína através da criação de um codão único (recodificação) e um RNA de transferência correspondente: aminoacil - par ARNt-sintetase para codificar com propriedades físico-químicas e propriedades biológicas diversas, a fim de ser utilizado como uma ferramenta para explorar estrutura e função das proteínas ou para criar romance ou proteínas melhoradas.
Blocos de construção química
Os aminoácidos são importantes como low-cost matérias-primas. Estes compostos são utilizados em síntese quiral como piscina blocos de construção enantiomericamente puros.
Os aminoácidos foram investigados como precursores catalisadores quirais, por exemplo, para assimétricos de hidrogenação reações, embora não existem aplicações comerciais.
Plásticos biodegradáveis
Os aminoácidos estão a ser desenvolvidos como componentes de uma gama de polímeros biodegradáveis. Estes materiais têm aplicações como embalagens respeitadora do ambiente e na medicina em entrega da droga e a construção de implantes protéticos. Estes polímeros incluem polipéptidos, poliamidas, poliésteres, poliuretanos e polissulfuretos com aminoácidos ou fazendo parte de suas cadeias principais ou coladas como cadeias laterais. Estas modificações alteram as propriedades físicas e reactividades dos polímeros. Um exemplo interessante de tais materiais é poliaspartato, um polímero biodegradável solúvel em água que pode ter aplicações em descartável fraldas e agricultura. Devido à sua solubilidade e capacidade de quelatos de iões metálicos, poliaspartato também está a ser utilizado como um anti-biodegradável agente de descamação e um inibidor de corrosão. Além disso, o aminoácido aromático tirosina está sendo desenvolvido como um possível substituto para tóxicos fenóis , tais como bisfenol A no fabrico de policarbonatos.
Reações
Como aminoácidos têm ambos um primário de amina primária e um grupo carboxilo grupo, esses produtos químicos podem ser submetidos a maioria das reacções associadas com estes grupos funcionais. Estes incluem adição nucleófila, formação da ligação amida e formação da imina para o grupo amina e esterificação, formação da ligação amida e descarboxilação para o grupo de ácido carboxílico. As várias cadeias laterais de aminoácidos podem também sofrer reacções químicas. Os tipos de estas reacções são determinadas pelos grupos sobre estas cadeias laterais e são, portanto, diferente entre os vários tipos de aminoácidos.
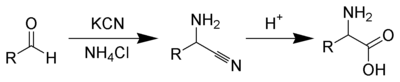
A síntese química
Existem vários métodos para sintetizar aminoácidos. Um dos métodos mais antigos, começa com o bromação na α-carbono de um ácido carboxyic. Substituição nucleofílica com amónia , em seguida, converte o brometo de alquilo para o aminoácido. Alternativamente, a A síntese de amino ácido de Strecker envolve o tratamento de um aldeído com cianeto de potássio e amónia, isto produz um nitrilo amino-α como um intermediário. A hidrólise do nitrilo no ácido proporciona então um ácido amino-α. Usando amónio ou sais de amónio nesta reacção proporciona aminoácidos não substituídos, enquanto substituindo aminas primárias e secundárias irá produzir aminoácidos substituídos. Da mesma forma, utilizando cetonas , em vez de aldeídos, dá α, aminoácidos dissubstituído-α. A síntese clássica dá misturas racémicas de ácidos amino-α como produtos, mas vários procedimentos alternativos usando auxiliares assimétricos ou catalisadores assimétricos têm sido desenvolvidos.
Atualmente, o método mais adotado é uma a síntese automatizada num suporte sólido (por exemplo, poliestireno grânulos), usando Os grupos protectores (por exemplo, Fmoc e t-Boc) e grupos de activação (por exemplo, E DCC DIC).
Formação de ligações peptídicas
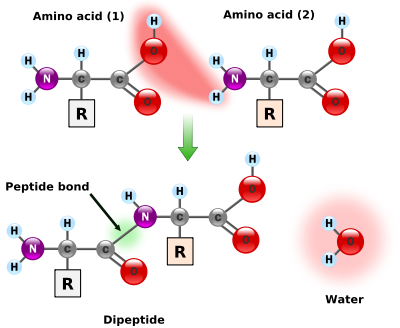
Como tanto a amina e grupos de ácido carboxílico de aminoácidos podem reagir para formar ligações amida, uma molécula de ácido amino podem reagir com uma outra e tornam-se unidas através de uma ligação amida. Este polimerização de aminoácidos é o que cria proteínas. Este reação de condensação produz o recém-formado ligação peptídica e uma molécula de água. Em células, esta reacção não ocorre directamente; em vez do aminoácido é primeiro activado por ligação a um transferir através de uma molécula de ARN éster de títulos. Este aminoacil-ARNt é produzido em uma de ATP dependente reacção levada a cabo por um aminoacil-ARNt-sintetase. Este aminoacil-ARNt, em seguida, é um substrato para a ribossoma, que catalisa o ataque do grupo amino da cadeia de proteína alongamento na ligação éster. Como um resultado deste mecanismo, todas as proteínas feitas por ribossomas são sintetizados a partir de sua extremidade N-terminal e que se deslocam para a sua extremidade C-terminal.
No entanto, nem todas as ligações peptídicas são formados desta forma. Em alguns casos, os péptidos são sintetizados por enzimas específicas. Por exemplo, o tripéptido glutationa é uma parte essencial das defesas das células contra o estresse oxidativo. Este péptido é sintetizado em duas fases a partir de aminoácidos livres. Na primeira etapa condensa sintetase gama-glutamilcisteína e cisteína ácido glutâmico através de uma ligação peptídica formada entre o grupo carboxilo da cadeia lateral do glutamato (o carbono gama desta cadeia lateral) e o grupo amino da cistea. Este dipeptídeo é então condensado com glicina por glutationa-sintetase para formar glutationa.
Em química, os péptidos são sintetizados por uma variedade de reacções. Um dos mais utilizados em a síntese de péptidos em fase sólida, o qual utiliza os derivados de oxima de aminoácidos aromáticos como unidades activados. Estes são adicionados em sequência na cadeia peptídica em crescimento, que está ligado a um suporte de resina sólida. A capacidade de sintetizar facilmente um grande número de péptidos diferentes por variação dos tipos e ordem dos aminoácidos (utilizando química combinatória) fez a síntese de péptidos particularmente importante na criação de bibliotecas de péptidos para utilização na descoberta de medicamentos através rastreio de alto rendimento.
Biossíntese e catabolismo
Em plantas, o azoto é assimilado pela primeira vez em compostos orgânicos na forma de glutamato, formados a partir de alfa-cetoglutarato e amoníaco na mitocôndria. De modo a formar outros aminoácidos, a planta utiliza transaminases para mover o grupo amino de um outro ácido carboxílico alfa-ceto. Por exemplo, converte aspartato aminotransferase e glutamato-oxaloacetato de alfa-cetoglutarato e aspartato. Outros organismos das transaminases utilizar para a síntese de aminoácidos também. Transaminases também estão envolvidas na quebra de aminoácidos. Degradar um aminoácido muitas vezes envolve a movimentação do seu grupo amino em alfa-cetoglutarato, formando glutamato. Em muitos animais vertebrados, o grupo amino é então removido através da ciclo de ureia e é excretado na forma de ureia . No entanto, a degradação do aminoácido pode produzir ácido úrico ou de amoníaco, em vez. Por exemplo, serina desidratase converte serina para piruvato e amônia.
Aminoácidos não padrão são normalmente formados através da modificação de aminoácidos padrão. Por exemplo, homocisteína é formada através do transsulfuração via ou por desmetilação de metionina através do metabolito intermediário S-adenosil-metionina, enquanto hidroxiprolina é feita por um modificação pós-tradução de prolina.
Os microrganismos e plantas podem sintetizar diversos aminoácidos incomuns. Por exemplo, alguns micróbios fazer Ácido 2-aminoisobutírico e lantionina, que é um derivado de pontes de sulfureto de alanina. Ambos estes aminoácidos são encontrados em peptídico tais como lantibióticos alameticina. Enquanto em plantas, Ácido 1-aminociclopropano-1-carboxílico é um pequeno aminoácido cíclico dissubstituída que é um intermediário chave na produção da hormona de planta de etileno .
Propriedades físico-químicas dos aminoácidos
Os 20 aminoácidos codificados directamente pelo código genético podem ser divididos em vários grupos com base nas suas propriedades. Os fatores importantes são carga, hidrofilicidade ou hidrofobicidade, tamanho e grupos funcionais. Estas propriedades são importantes para estrutura de proteína e interacções proteína-proteína. As proteínas solúveis em água tendem a ter os seus resíduos hidrofóbicos (leu, lie, Vai, Phe e Trp) enterrados no meio da proteína, enquanto que as cadeias laterais hidrofílicas são expostos ao solvente aquoso. O proteínas de membrana integrais tendem a ter anéis exteriores de exposição aminoácidos hidrofóbicos que as ancoram na bicamada lipídica. No caso parte do caminho entre esses dois extremos, alguns proteínas da membrana periféricas têm um remendo de aminoácidos hidrofóbicos na sua superfície que fecha sobre a membrana. Do mesmo modo, proteínas que têm de se ligar a moléculas carregadas positivamente têm superfícies rico com aminoácidos carregados negativamente como glutamato e aspartato, enquanto proteínas de ligação a moléculas carregadas negativamente têm superfícies rica em cadeias carregados positivamente como e lisina arginina. Existem diferentes escalas de hidrofobicidade dos resíduos de aminoácidos.
Alguns aminoácidos possuem propriedades especiais, tais como cisteína, que pode formar covalente ligações dissulfureto com outros resíduos de cisteína, prolina que formas um ciclo para o esqueleto do polipéptido, e glicina que é mais flexível do que outros aminoácidos.
Muitas proteínas passam por uma série de modificações pós-tradução, em que os grupos químicos adicionais são ligados aos aminoácidos em proteínas. Algumas modificações podem produzir hidrofóbica lipoproteínas, ou hidrófilo glicoproteínas. Este tipo de modificação reversível permitir o direccionamento de uma proteína a uma membrana. Por exemplo, a adição e remoção de ácido gordo ácido palmítico para resíduos de cisteína em algumas proteínas de sinalização faz com que as proteínas e, em seguida, para fixar separar a partir de membranas celulares.
Tabela de abreviaturas de aminoácidos padrão e propriedades
| Aminoácido | 3 letras | 1-Letra | Cadeia lateral polaridade | Cadeia lateral de carga (pH 7,4) | Índice Hidrotermais | A absorvância λ max (nm) | ε em λ max (x10 -3 M-1 cm-1) |
|---|---|---|---|---|---|---|---|
| Alanina | Ala | A | nonpolar | neutro | 1,8 | ||
| Arginina | Arg | R | polar | positivo | -4.5 | ||
| Asparagina | Asn | N | polar | neutro | -3.5 | ||
| O ácido aspártico | Áspide | D | polar | negativo | -3.5 | ||
| Cisteína | Cys | C | nonpolar | neutro | 2,5 | 250 | 0,3 |
| O ácido glutâmico | Glu | E | polar | negativo | -3.5 | ||
| Glutamina | Gln | Q | polar | neutro | -3.5 | ||
| Glycine | Gli | G | nonpolar | neutro | -0.4 | ||
| Histidina | Sua | H | polar | positivo (10%) neutra (90%) | -3.2 | 211 | 5,9 |
| Isoleucina | Ile | EU | nonpolar | neutro | 4,5 | ||
| Leucina | Leu | L | nonpolar | neutro | 3.8 | ||
| Lisina | Lys | K | polar | positivo | -3.9 | ||
| Metionina | Met | M | nonpolar | neutro | 1.9 | ||
| Fenilalanina | Phe | F | nonpolar | neutro | 2.8 | 257, 206, 188 | 0,2, 9,3, 60,0 |
| Prolina | Pró | P | nonpolar | neutro | -1.6 | ||
| Serina | Ser | S | polar | neutro | -0.8 | ||
| Treonina | Thr | T | polar | neutro | -0.7 | ||
| Triptofano | Trp | W | nonpolar | neutro | -0.9 | 280, 219 | 5,6, 47,0 |
| Tirosina | Tyr | Y | polar | neutro | -1.3 | 274, 222, 193 | 1,4, 8,0, 48,0 |
| Valina | Val | V | nonpolar | neutro | 4.2 |
Além disso, há dois aminoácidos adicionais, que são incorporados por substituindo codões de paragem:
| 21 e 22 aminoácidos | 3 letras | 1-Letra |
|---|---|---|
| Selenocisteína | Sec | U |
| Pirrolisina | Pyl | O |
Além dos códigos de aminoácidos específicos, marcadores de posição são usados em casos onde ou química A análise cristalográfica de um péptido ou proteína não pode conclusivamente determinar a identidade de um resíduo.
| Ambígua Aminoácidos | 3 letras | 1-Letra |
|---|---|---|
| Asparagina ou ácido aspártico | Asx | B |
| Glutamina ou ácido glutâmico | Glx | Z |
| Leucina ou Isoleucina | XLE | J |
| Aminoácido não especificado ou desconhecido | Xaa | X |
Unk é por vezes usado em vez de Xaa, mas é menos padrão.
Além disso, muitos aminoácidos atípicos têm um código específico. Por exemplo, várias drogas peptidicas, tais como O bortezomib ou MG132 são artificialmente sintetizado e conservam a sua grupos de protecção, que têm códigos específicos. O bortezomib é Pyz-Phe-boroLeu e é MG132 Z-Leu-Leu-Leu-al. Além disso, para auxiliar na análise da estrutura proteica, fotorreticulação análogos de aminoácidos estão disponíveis. Estes incluem photoleucine (pleu) e photomethionine (PMET).
