Bioquímica
Sobre este escolas selecção Wikipedia
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. SOS Children trabalha em 45 países africanos; você pode ajudar uma criança em África ?
Bioquímica (a partir de grego : βίος, bios, "vida" e Kēme egípcio, "Terra") é o estudo dos químicos processos em que vivem os organismos . Ele lida com a estrutura e função de componentes celulares, tais como proteínas , hidratos de carbono , lípidos , ácidos nucleicos, e outros biomoléculas. Biologia química tem como objetivo responder a muitas questões decorrentes da bioquímica utilizando ferramentas desenvolvidas dentro síntese química.
Embora haja um grande número de biomoléculas diferentes, muitos são moléculas complexas e grandes (chamados polímeros) que são compostas de subunidades de repetição similares (chamados monómeros). Cada classe de biomoléculas polimérico tem um conjunto diferente de tipos de subunidades. Por exemplo, uma proteína é um polímero constituído por 20 ou mais aminoácidos . Bioquímica estuda as propriedades químicas de moléculas biológicas importantes, como as proteínas, em especial a química de enzimática catalisada reacções .
A bioquímica da célula e o metabolismo sistema endócrino tem sido extensivamente descrita. Outras áreas da bioquímica incluem o código genético ( ADN , ARN), a síntese de proteínas, membrana celular transportes , e transdução de sinal.
Este artigo discute apenas bioquímica terrestre ( carbono - e água baseado), como todas as formas de vida que conhecemos estão em terra . Desde as formas de vida estão vivas hoje a hipótese de ter descido mais do mesmo ancestral comum, eles têm bioquímicas similares, mesmo para assuntos que parecem ser essencialmente arbitrária, tal como lateralidade de várias biomoléculas. Desconhece-se se biochemistries alternativas são possíveis ou prático.
História

Originalmente, acreditava-se que a vida não estava sujeito às leis da ciência a forma não era a vida. Pensava-se que os seres vivos só poderia produzir as moléculas da vida (dos outros, biomoléculas previamente existentes). Então, em 1828, Friedrich Wöhler publicou um artigo sobre a síntese de uréia , provando que orgânicos compostos pode ser criado artificialmente.
A madrugada da bioquímica pode ter sido a descoberta da primeira enzima, diástase (chamado hoje amilase), em 1833, por Anselme Payen. Eduard Buchner contribuiu a primeira demonstração de um processo bioquímico complexo exterior de uma célula, em 1896: fermentação alcoólica em extratos de células de levedura. Embora o termo "bioquímica" parece ter sido usado pela primeira vez em 1882, é geralmente aceite que a cunhagem formal da bioquímica ocorreu em 1903 por Carl Neuberg, um alemão químico. Anteriormente, essa área teria sido referido como química fisiológica . Desde então, bioquímica tem avançado, especialmente desde meados do século 20, com o desenvolvimento de novas técnicas, tais como cromatograf ia , Difracção de raios-X, Espectroscopia de RMN, rotulagem radioisotópica, microscopia eletrônica e simulações de dinâmica molecular. Estas técnicas permitiram a descoberta e análise detalhada de muitas moléculas e vias metabólicas da célula , tal como glicólise eo Ciclo de Krebs (ciclo de ácido cítrico).
Outro evento histórico significativo em bioquímica é a descoberta do do gene e o seu papel na transferência de informação na célula. Esta parte da bioquímica é muitas vezes chamado Biologia molecular. Na década de 1950, James D. Watson , Francis Crick , Rosalind Franklin, e Maurice Wilkins foram fundamentais para resolver a estrutura do DNA e sugerindo sua relação com a transferência genética de informações. Em 1958, George Beadle e Edward Tatum recebeu o Prêmio Nobel de trabalho em fungos que mostra que um gene produz uma enzima. Em 1988, Colin Pitchfork foi a primeira pessoa condenada por homicídio com DNA provas, o que levou a um crescimento de Ciência forense. Mais recentemente, Andrew Z. Fire and Craig C. Mello recebeu o Prêmio Nobel de 2006 pela descoberta do papel de Interferência de ARN ( ARNi), no silenciamento de expressão do gene.
Hoje, há três tipos principais de bioquímica conforme estabelecido por Michael E. Sugar. Bioquímica da planta envolve o estudo da bioquímica de organismos autotróficos, como a fotossíntese de plantas específicas e outros bioquímicos processos. Bioquímica geral engloba tanto vegetal e animal bioquímica. Bioquímica humana / médica / medicinal incide sobre a bioquímica dos seres humanos e doenças médicas.
Os hidratos de carbono
A função de hidratos de carbono inclui a armazenagem de energia e fornecimento de estrutura. Os açúcares são hidratos de carbono, mas nem todos os hidratos de carbono são os açúcares. Há mais hidratos de carbono na Terra do que qualquer outro tipo conhecido de biomoléculas.
Monossacarídeos
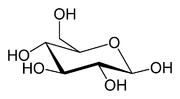
O tipo mais simples de hidratos de carbono é um monossacárido, que, entre outras propriedades contém carbono, hidrogénio e oxigénio , na sua maior parte em uma proporção de 1: 2: 1 (fórmula generalizada C n H 2 S n n, em que n é pelo menos 3). A glicose , um dos mais importantes hidratos de carbono, é um exemplo de um monossacárido. Então é frutose, o açúcar que dá frutas seu sabor doce. Alguns hidratos de carbono (especialmente depois condensação de oligo e polissacarídeos) contêm menos carbono em relação ao H e O, que ainda estão presentes em 2: 1 (H: O) ratio. Monossacáridos podem ser agrupados em aldoses (tendo um grupo aldeído na extremidade da cadeia, por exemplo, glucose) e cetoses (tendo um ceto grupo na sua cadeia, por exemplo frutose). Ambas as aldoses e cetoses ocorrer em um equilíbrio entre as formas de cadeia aberta e (começando com comprimentos de cadeia de C4) formas cíclicas. Eles são gerados por formação de ligação entre um dos grupos hidroxilo da cadeia de açúcar com o carbono do grupo aldeído ou cetona para formar um vínculo hemiacetal. Isto leva a saturado de cinco membros (em furanoses) ou seis membros (em piranoses) anéis heterocíclicos que contêm um S como heteroátomo.
Dissacarídeos
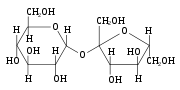
Dois monossacáridos podem ser unidos em conjunto, utilizando síntese de desidratação, em que um átomo de hidrogénio é removido da extremidade de uma molécula e um grupo hidroxilo (-OH) é removido a partir do outro; os resíduos restantes são então ligados nos sítios a partir da qual os átomos foram removidos. O H-OH ou H 2 O, em seguida, é libertado como uma molécula de água , daí o termo desidratação. A nova molécula, que consiste em dois monossacarídeos, é chamado um dissacarídeo e é conjugada entre si por uma ou glicosídica ligação éter . A reacção inversa pode também ocorrer, utilizando uma molécula de água para separar um dissacárido e quebrar a ligação glicosídica; este é denominado hidrólise. O dissacarídeo mais conhecido é a sacarose , ordinário açúcar (em contextos científicos, chamado açúcar de mesa ou açúcar de cana para diferenciá-lo de outros açúcares). A sacarose é constituído por uma molécula de glicose e uma molécula de frutose unidas. Um outro dissacárido é importante a lactose, que consiste de uma molécula de glicose e uma molécula de galactose. Como a maioria dos seres humanos de idade, a produção de lactase, a enzima que hidrolisa a lactose em glicose e galactose, normalmente diminui. Isto resulta numa deficiência de lactase, também chamado de intolerância à lactose.
Polímeros de açúcar são caracterizados por terem reduzindo ou não reduzindo extremidades. A extremidade redutora de um hidrato de carbono é um átomo de carbono que podem estar em equilíbrio com a cadeia aberta aldeído ou forma ceto. Se a junção de monómeros tem lugar a uma tal átomo de carbono, o grupo hidroxi livre do piranose ou forma furanose é trocada com uma cadeia OH-lateral de outro açúcar, produzindo uma completa acetal. Isto impede a abertura da cadeia para a forma de aldeído ou cetona e torna-se o resíduo modificado não redutor. Lactose contém uma extremidade redutora, na sua porção de glicose, enquanto que a porção galactose formar um acetal cheio com o grupo C4-OH de glicose. A sacarose não têm uma extremidade redutora por causa da formação de acetal completa entre o carbono do aldeído a glicose (C1) e o ceto carbono de frutose (C2).
Oligossacáridos e polissacáridos
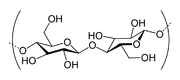
Quando um pouco (cerca de 05:57) Os monossacáridos são unidos em conjunto, que é chamado um oligosaccharide (oligo que significa "poucos"). Estas moléculas tendem a ser utilizados como marcadores e sinais, bem como ter outras utilizações.
Muitos monossacarídeos unidos fazer uma polissacarídeo. Eles podem ser unidas em uma cadeia linear longa, ou podem ser ramificados. Duas das mais comuns são polissacáridos celulose e glicogénio, tanto que consiste em repetir glicose monómeros.
- A celulose é feita por plantas e é um componente estrutural importante dos seus paredes celulares. Os seres humanos não podem fabricar nem digeri-lo.
- O glicogénio, por outro lado, é um dos animais de hidratos de carbono; seres humanos e outros animais usá-lo como uma forma de armazenamento de energia.
Proteínas

Como hidratos de carbono, algumas proteínas desempenham papéis estruturais em grande parte. Por exemplo, os movimentos das proteínas actina ea miosina, em última análise são responsáveis pela contracção do músculo esquelético. Uma propriedade é muitas proteínas têm que se ligam especificamente a uma determinada molécula ou classe de moléculas que podem ser extremamente selectiva em que eles se ligam. Os anticorpos constituem um exemplo de proteínas que se ligam a um determinado tipo de molécula. Na verdade, o ligada ao ensaio imunoenzimático (ELISA), que utiliza anticorpos, é atualmente um dos testes mais sensíveis a medicina moderna usa para detectar várias biomoléculas. Provavelmente, as proteínas mais importantes, no entanto, são a enzimas. Estas moléculas incríveis reconhecer moléculas reagentes específicos chamados substratos; que, em seguida, catalisar a reacção entre eles. Ao baixar a energia de activação , a enzima que acelera a reacção a uma taxa de 10 11 ou mais: uma reacção que normalmente levaria mais de 3000 anos para completar espontaneamente pode levar menos de um segundo, com uma enzima. A própria enzima não é utilizado no processo, e é livre para catalisar a mesma reacção com um novo conjunto de substratos. Usando vários modificadores, a actividade da enzima pode ser regulada, que permite o controle da bioquímica da célula como um todo.
Em essência, as proteínas são cadeias de aminoácidos . Um aminoácido é constituído por um átomo de carbono ligado a quatro grupos. Um deles é um amino grupo, -NH 2, e um deles é um ácido carboxílico de grupo, -COOH (embora estes existem como -NH 3 + e -COO - sob condições fisiológicas). O terceiro é um simples hidrogênio átomo. A quarta é vulgarmente designado "-R" e é diferente para cada um dos aminoácidos. Há vinte aminoácidos padrão. Algumas delas têm funções por si só ou numa forma modificada; por exemplo, funções de glutamato como um importante neurotransmissor.
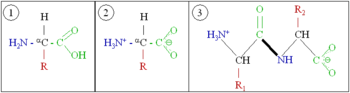
Os aminoácidos podem ser unidos através de um ligação peptídica. Nesta síntese desidratação, uma molécula de água é removido e a ligação peptídica liga o azoto do grupo amino de um aminoácido ao carbono do grupo do outro ácido carboxílico. A molécula resultante é designada por dipeptídicos, e curtos trechos de aminoácidos (normalmente, menos do que cerca de trinta) são chamados péptidos ou polipéptidos. Trechos mais longos merecer as proteínas título. Como um exemplo, o sangue importante proteína de soro albumina contém 585 resíduos de aminoácidos.
A estrutura das proteínas é tradicionalmente descrito em uma hierarquia de quatro níveis. O estrutura primária de uma proteína consiste simplesmente da sua sequência linear de aminoácidos; por exemplo, "alanina-glicina-serina-triptof ano-glutamato-asparagina-glicina-lisina- ...". A estrutura secundária refere-se a morfologia do local. Algumas combinações de aminoácidos tenderão a enrolar-se em uma bobina chamado de α-hélice ou em uma folha de uma chamada β-folha; alguns α-hélices pode ser visto no esquema de hemoglobina acima. Estrutura terciária é toda a forma tridimensional da proteína. Esta forma é determinada pela sequência de aminoácidos. Na verdade, uma única alteração poderá alterar a estrutura inteira. A cadeia alfa da hemoglobina contém 146 resíduos de aminoácidos; substituição do resíduo glutamato na posição 6 com um resíduo valina altera o comportamento de hemoglobina tanto que resulta em doença das células falciformes . Finalmente estrutura quaternária está preocupado com a estrutura de uma proteína com múltiplas subunidades peptídicas, como a hemoglobina, com as suas quatro subunidades. Nem todas as proteínas têm mais do que uma subunidade.
Proteínas ingeridas são geralmente divididos em aminoácidos individuais ou dipeptides no intestino delgado, e, em seguida, absorvido. Elas podem então ser ligados em conjunto para fazer novas proteínas. Os produtos intermediários da glicólise, o ciclo de ácido cítrico, e o via das pentoses fosfato pode ser utilizado para fazer todos os vinte aminoácidos, e a maioria das bactérias e plantas possuem todas as enzimas necessárias para a sua síntese. Os seres humanos e outros mamíferos, no entanto, só pode sintetizar metade deles. Eles não podem sintetizar isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano, e valina. Estes são o aminoácidos essenciais, uma vez que é essencial para a ingeri-los. Mamíferos possuem as enzimas para sintetizar alanina, asparagina, aspartato, cisteína, glutamato, glutamina, glicina, prolina, serina, e tirosina, os aminoácidos não essenciais. Enquanto que pode sintetizar e arginina histidina, eles não podem produzi-lo em quantidades suficientes para os animais jovens, em crescimento, e assim que estes são muitas vezes considerados aminoácidos essenciais.
Se o grupo amino é removido de um aminoácido, que deixa para trás um esqueleto de carbono chamado um α- ácido ceto. Enzimas chamadas transaminases possível transferir facilmente o grupo amino de um aminoácido (tornando-o um ácido α-ceto) para outro ácido α-ceto (tornando-se um aminoácido). Isto é importante na biossíntese de aminoácidos, como para muitas das vias, a partir de intermediários outras vias bioquímicas são convertidos para o esqueleto de ácido α-ceto, e, em seguida, um grupo amino é adicionada, muitas vezes através transaminação. Os aminoácidos podem então ser ligados em conjunto para formar uma proteína.
Um processo semelhante é usado para quebrar as proteínas. Ela é hidrolisada primeiro nos seus componentes aminoácidos. Livre de amoníaco (NH3), existindo como o ião amónio (NH4 +) em sangue, é tóxico para as formas de vida. Um método adequado para excretar deve, por conseguinte, existir. Diferentes estratégias têm evoluído em diferentes animais, dependendo das necessidades dos animais. Organismos unicelulares, é claro, simplesmente libertar o amoníaco no ambiente. Da mesma forma, peixes ósseos pode liberar a amônia na água, onde é diluído rapidamente. Em geral, os mamíferos converter a amónia em ureia, através do ciclo da uréia.
Lipids
O termo lipídica compreende um conjunto diversificado de moléculas e, em certa medida é um catchall para relativamente insolúveis em água ou compostos não polares de origem biológica, incluindo ceras, ácidos gordos , gordos de ácido derivado fosfolípidos, sphingolipids, glycolipids e terpenóides (por exemplo. retinóides e esteróides). Alguns lípidos são lineares moléculas alifáticos, enquanto outros têm estruturas de anel. Alguns são aromáticos, enquanto outros não são. Alguns são flexíveis, enquanto outros são rígidas.
A maioria dos lípidos têm alguns carácter polar para além de serem em grande parte não polar. Geralmente, a maior parte da sua estrutura é não polar ou hidrofóbica ("temente a água"), o que significa que ela não interage bem com solventes polares como água. Outra parte de sua estrutura é polar ou hidrofílico ("água-loving") e tendem a associar com solventes polares como água. Isto torna- moléculas anfifílicas (possuindo porções tanto hidrófobas e hidrófilas). No caso de colesterol, o grupo polar é um mero -OH ( hidroxilo ou álcool). No caso de fosfolípidos, os grupos polares são consideravelmente maiores e mais polar, tal como descrito abaixo.
Os lipídios são uma parte integrante da nossa dieta diária. Mais e óleos produtos lácteos que usamos para cozinhar e comer como manteiga , queijo , ghi etc, são compostos de gorduras. Os óleos vegetais são ricos em vários ácidos graxos poliinsaturados (AGPI). Alimentos contendo lipídicos sofrem digestão no interior do corpo e são divididos em ácidos gordos e glicerol, que são os produtos finais de degradação de gorduras e lípidos.
Ácidos nucleicos
Um ácido nucleico é um complexo, bioquímica de alto peso molecular- macromolécula composto de cadeias de nucleótidos que transmitem informação genética. Os ácidos nucleicos mais comuns são o ácido desoxirribonucleico (ADN) e ácido ribonucleico ( ARN). Os ácidos nucleicos são encontrados em todas as células vivas e vírus. Além do material genético da célula, os ácidos nucleicos desempenham frequentemente um papel de segundos mensageiros, bem como formando a molécula base para o trifosfato de adenosina , a molécula portadora de energia primária encontrada em todos os organismos vivos.
O ácido nucleico, assim chamado por causa de sua prevalência em celular núcleos, é o nome genérico da família de biopolímeros. Os monómeros são chamados nucleótidos, e cada consiste em três componentes: um heterocíclico azotado base (ou um ou uma purina pirimidina), um pentose açúcar , e um grupo fosfato. Diferentes tipos de ácidos nucleicos que diferem no açúcar específico encontrado na cadeia (por exemplo, DNA ou ácido desoxirribonucleico contém 2- deoxyriboses). Além disso, as bases azotadas possíveis em os dois ácidos nucleicos são diferentes: adenina, citosina, e guanina ocorrer em ambos ARN e ADN, enquanto timina ocorre apenas em ADN e uracilo ocorre no ARN.
Relação com outros "em escala molecular" ciências biológicas
Pesquisadores em bioquímica usar técnicas específicas nativas para bioquímica, mas cada vez mais se combinam estes com técnicas e idéias de genética , biologia molecular e biofísica. Nunca houve um linha-dura entre essas disciplinas em termos de conteúdo e técnica, mas os membros de cada disciplina, no passado, sido muito territorial; hoje os termos de biologia molecular e bioquímica são quase intercambiáveis. A figura seguinte é um diagrama esquemático que ilustra uma visão possível da relação entre os campos:
- A bioquímica é o estudo das substâncias químicas e processos vitais que ocorrem em que vivem os organismos . Os bioquímicos incidir fortemente sobre o papel, função e estrutura de biomoléculas. O estudo da química atrás de processos biológicos e na síntese de moléculas biologicamente activas são exemplos de bioquímica.
- Genética é o estudo do efeito das diferenças genéticas em organismos. Muitas vezes, isto pode ser inferido através da ausência de um componente normal (por exemplo, uma gene). O estudo das " mutantes "- organismos a que falta um ou mais componentes funcionais no que diz respeito ao chamado" tipo selvagem "ou normal fenótipo. Interações genéticas ( epistasis) muitas vezes pode confundir simples interpretações de tais estudos "knock-out".
- A biologia molecular é o estudo dos fundamentos moleculares do processo de replicação, transcrição e tradução da material genético. O dogma central da biologia molecular onde o material genético é transcrito em RNA e depois traduzidos para proteína, apesar de ser uma imagem simplista da biologia molecular, ainda oferece um bom ponto de partida para a compreensão do campo. Esse quadro, no entanto, está passando por uma revisão à luz de novos papéis emergentes para ARN.
- Chemical Biology procura desenvolver novas ferramentas baseadas em pequenas moléculas que permitem perturbação mínima de sistemas biológicos, proporcionando informações detalhadas sobre a sua função. Além disso, biologia química emprega sistemas biológicos para criar híbridos não-naturais entre biomoléculas e dispositivos sintéticos (por exemplo esvaziado capsids virais que podem entregar A terapia de genes ou moléculas de droga).