Toluène
À propos de ce écoles sélection Wikipedia
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet était une initiative de SOS Enfants. Pour comparer les organismes de bienfaisance de parrainage ce est le meilleur lien de parrainage .
| Toluène | |
|---|---|
 |  |
Méthylbenzène | |
Autres noms toluène | |
| Identificateurs | |
| Numéro CAS | 108-88-3 |
| PubChem | 1140 |
| ChemSpider | 1108 |
| UNII | 3FPU23BG52 |
| DrugBank | DB01900 |
| KEGG | C01455 |
| ChEBI | CHEBI: 17578 |
| ChEMBL | CHEMBL9113 |
| Numéro RTECS | XS5250000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | C 7 H 8 |
| Masse molaire | 92,14 g mol -1 |
| Apparence | Liquide incolore |
| Densité | 0,87 g / ml (20 ° C) |
| Point de fusion | -95 ° C, 178 K, -139 ° F () |
| Point d'ébullition | 111 ° C, 384 K, 232 ° F () |
| Solubilité dans l'eau | 0,47 g / L |
| Indice de réfraction (n D) | 1,497 (20 ° C) |
| Viscosité | 0,590 cP (20 ° C) |
| Structure | |
| Moment de dipôle | 0,36 Ré |
| Risques | |
| FS | MSDS externe |
| Phrases-R | R11, R38, R48 / 20, R63, R65, R67 |
| Phrases S | (S2), S36 / 37, S29, S46, S62 |
| Principal dangers | hautement inflammable |
| NFPA 704 |  3 2
0 |
| Point d'éclair | 6 ° C (43 ° F) |
| Valeur limite | M -3 50 mL, 190 mg m -3 |
| Des composés apparentés | |
| Connexe des hydrocarbures aromatiques | benzène xylène naphtaline |
| Des composés apparentés | méthylcyclohexane |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Toluène, anciennement connu sous le toluène, est un clair eau liquide insoluble dans l'odeur typique de diluants à peinture. Il se agit d'un mono-substitué benzène dérivé, à savoir une dans laquelle un seul atome d'hydrogène d'un groupe de six atomes de la molécule de benzène a été remplacé par un groupe univalent, dans ce cas, CH 3.
C'est un hydrocarbure aromatique qui est largement utilisé comme un industriel comme charge d'alimentation et un solvant . Comme autres solvants, le toluène est parfois également utilisé comme médicaments par inhalation pour ses propriétés enivrantes; Toutefois, l'inhalation de toluène a le potentiel de causer des dommages neurologiques graves. Le toluène est un solvant organique importante, mais est également capable de dissoudre un certain nombre de produits chimiques inorganiques notables tels que le soufre, l'iode, le brome, le phosphore. et d'autres substances covalentes non polaires.
Histoire
Le composé a été isolé pour la première en 1837 par un Chimiste polonaise Filip Walter travers une distillation de pin huile qui l'a nommée retinaptha. Ce nom a été remplacé peu après par le toluène par un mot dérivé de l'ancienne nom toluène, qui se réfère à baume de tolu, un extrait aromatique de l'arbre tropicale colombienne Myroxylon balsamum, dont il a également été isolé par la suite. Il a été initialement nommé par Jöns Jakob Berzelius.
Propriétés chimiques
Le toluène réagit comme une normale hydrocarbure aromatique à une substitution aromatique électrophile. Le un groupe méthyle le rend environ 25 fois plus réactif que le benzène dans de telles réactions. Il subit en douceur sulfonation pour donner acide p-toluènesulfonique, et par chloration Cl 2 en présence de FeCl 3 pour donner ortho et para isomères du chlorotoluène. Il subit nitration pour donner ortho et para isomères de nitrotoluène, mais se il est chauffé, il peut donner dinitrotoluène et, finalement, l'explosif trinitrotoluène (TNT).
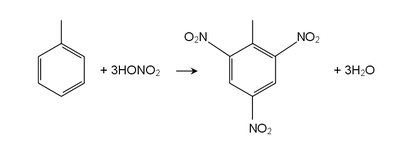
Avec d'autres réactifs méthyle la chaîne latérale peut réagir dans du toluène, subir une oxydation. La réaction avec du permanganate de potassium et de l'acide dilué (par exemple, acide sulfurique ) ou le permanganate de potassium concentré avec de l'acide sulfurique , conduit à l'acide benzoïque, tandis que la réaction avec le chlorure de chromyle conduit à benzaldéhyde ( Réaction d'Étard). L'halogénation peut être effectuée sous conditions de radicaux libres. Par exemple, N-bromosuccinimide (NBS) chauffé avec du toluène en présence de AIBN conduit à le bromure de benzyle. Le toluène peut également être traité avec élémentaire brome en présence de lumière UV (lumière solaire directe) pour donner le bromure de benzyle. Le toluène peut également être brome par traitement avec HBr et H 2 O 2 en présence de lumière.
Catalyseur d'hydrogénation du toluène à méthylcyclohexane nécessite une pression élevée d' hydrogène à aller à son terme, en raison de la stabilité du système aromatique. pK a est d'environ 45.
Production
Toluène se produit naturellement à de faibles niveaux dans le pétrole brut et est généralement produite dans les procédés de fabrication essence intermédiaire d'un reformage catalytique, dans un éthylène cracker ou de faire le coke de charbon . Séparation finale, soit par distillation ou extraction par solvant, a lieu dans l'un des nombreux procédés disponibles pour l'extraction de la Aromatiques BTX (benzène, toluène et des isomères de xylène).
Préparation
Le toluène peut être préparé industriellement en laboratoire ou par une variété de méthodes.
- De benzène ( Réaction de Friedel-Crafts)
Le benzène réagit avec du chlorure de méthyle en présence de chlorure d'aluminium anhydre pour former le toluène. La formation suit un mécanisme de réaction de substitution électrophile:
- CH 3 Cl + AlCl 3 → CH 3 + 4 + AlCl -
- C 6 H 5 CH 3 H + + + AlCl 4 - → C 6 H 5 CH 3 + HCl + AlCl 3
Les catalyseurs suivants peuvent être utilisés à la place de AlCl 3:
- AlCl 3> SbCl 3> SnCl4> BF 3> ZnCl2> HgCl 2
Notez que la réaction ne est pas très utile comme le dérivé mono-alkyle formé facilement subit une nouvelle alkylation à une plus grande vitesse encore pour produire des produits polysubstitués.
- À partir de bromobenzène ( Réaction Wurtz-Fittig)
La réaction Wurtz-Fittig est la réaction d'un halogénure d'aryle et un halogénure d'alkyle en présence de sodium métallique pour donner des composés aromatiques substitués.
Quand bromobenzène et le bromure de méthyle réagit avec du sodium métallique dans une solution d'éther anhydre, le toluène est obtenu.
- C 6 H 5 Br + CH 3 Br + 2Na → C 6 H 5 CH 3 + 2NaBr
- De l'acide toluique ( décarboxylation)
Lorsque le sel de sodium de l'acide toluique ( o-, m-, p-) est chauffé avec la chaux sodée, le toluène est obtenu.
- C 6 H 4 CH 3 COONa (en toluate de sodium) + NaOH → C 6 H 5 CH 3 (toluène) + Na 2 CO 3
- À partir de crésol
Lorsque crésol (o-, m-, p-) est distillé avec de la poussière de zinc, le toluène est obtenu.
- C 6 H 4 CH 3 OH (crésol) Zn + → C 6 H 5 CH 3 (toluène) + ZnO
- À partir de toluènesulfonique
Lorsque l'acide toluènesulfonique est traité avec de la vapeur surchauffée ou à la coque avec de l'HCl, le toluène est obtenu.
- CH 3 C 6 H 4 SO 3 H (acide toluènesulfonique) + HOH (vapeur) → C 6 H 5 CH 3 (toluène) + H 2 SO 4 ( acide sulfurique )
- À partir de toluidine
Toluidine est d'abord diazoté avec le nitrite de sodium (NaNO 2) et du HCl à basse température. Le composé de diazonium ainsi obtenu est chauffé avec alcaline chlorure stanneux (SnCl 2). Cette réaction donne le toluène.
- À partir de Réactif de Grignard
Quand le bromure de phenyl magnésium (C 6 H 5) MgBr est mis à réagir avec du bromure de méthyle, le toluène est obtenu.
Utilisations
Le toluène est un commune solvant , capable de dissoudre peintures, diluants à peinture, produits d'étanchéité de silicone, de nombreux réactifs chimiques , caoutchouc , l'encre d'impression, adhésifs (colles), laques, tanneurs, et désinfectants. Il peut également être utilisé en tant que Indicateur de fullerène, et est une matière première pour le diisocyanate de toluène (utilisé dans la fabrication de mousse de polyuréthane) et TNT. En outre, il est utilisé comme solvant pour créer une solution de nanotubes de carbone. Il est également utilisé comme un ciment pour bien polystyrène kits (par dissolution, puis la fusion des surfaces), telle qu'elle peut être appliquée très précisément à la brosse et ne contient aucune de la masse d'un adhésif.
Les utilisations industrielles de toluène comprennent désalkylation au benzène, et de la dismutation à un mélange de benzène et xylène. Quand il produit oxydé benzaldéhyde et l'acide benzoïque, deux des intermédiaires importants dans la chimie. Il est également utilisé comme source de carbone pour la fabrication à parois multiples Nanotubes de carbone. Le toluène peut être utilisé pour briser ouverte des globules rouges afin d'extraire hémoglobine dans des expériences de biochimie.
Le toluène peut être utilisé comme un booster d'octane dans carburants essence utilisés dans moteurs à combustion interne. Toluène à 86% en volume alimenté toutes les équipes de Formule 1 turbo dans les années 1980, d'abord au point par l'équipe Honda. Les 14% restants était une "charge" de n-heptane, afin de réduire l'indice d'octane pour répondre à une formule restrictions de carburant. Toluène à 100% peut être utilisé comme carburant pour les moteurs à deux temps et à quatre temps; Toutefois, en raison de la densité du carburant et d'autres facteurs, le carburant ne se vaporise pas aisément à moins préchauffée à 70 degrés Celsius (Honda accompli ceci dans leur voitures de Formule 1 en acheminant les conduites de carburant à travers le système de silencieux pour chauffer le carburant). Toluène pose également des problèmes similaires comme carburants à l'alcool, car il mange à travers les lignes de carburant en caoutchouc standard et n'a pas de propriétés lubrifiantes, comme essence standard fait, qui peut briser les pompes à carburant et causer cylindre supérieur usure de l'alésage.
En Australie, le toluène a été reconnu coupable d'avoir illégalement été combinée avec de l'essence dans les points de carburant pour la vente comme carburant pour véhicule standard. Toluène attire pas accise sur le carburant, tandis que d'autres carburants sont taxés à plus de 40%, donc les fournisseurs de carburant sont en mesure de profiter de la substitution du toluène moins cher pour l'essence. Cette substitution est susceptible d'affecter les performances du moteur et entraînent une usure supplémentaire. Le degré de substitution de toluène n'a pas été déterminée.
Le toluène est un autre dans un groupe de combustibles qui ont été récemment utilisés comme composants pour mélanges de substitution de carburéacteur. Le toluène est utilisé en tant que jet de substitution de carburant pour sa teneur en des composés aromatiques.
Le toluène a été utilisé comme réfrigérant pour ses bonnes capacités de transfert de chaleur dans les pièges de sodium froid utilisés dans les boucles du système de réacteur nucléaire.
Le toluène a également été utilisé dans le procédé de retirer la cocaïne de feuilles de coca dans la production de sirop de Coca-Cola.
Biologie
Comme dans beaucoup d'autres solvants tels que Le 1,1,1-trichloroéthane et des alkyl -benzènes , le toluène a été montré pour agir en tant que non-concurrentiel Antagoniste du récepteur NMDA et Récepteur GABA A modulateur allostérique positif. Il est abusé comme un inhalation probable en raison de la euphorique et effets dissociatifs ces actions produisent. En outre, le toluène a été montré pour afficher effets de type antidépresseur chez les rongeurs dans le test de la nage forcée (FST) et le Test de suspension caudale (TST).
Toxicologie et métabolisme
Le toluène ne devrait pas être inhalé en raison de ses effets sur la santé. Niveaux faibles à modérés peuvent provoquer de la fatigue, de la confusion, une faiblesse, des actions de type ivre, perte de mémoire, nausées, perte d'appétit, et d'entendre et la couleur la perte de vision. Ces symptômes disparaissent généralement lorsque l'exposition est arrêté. L'inhalation de niveaux élevés de toluène dans un court laps de temps peut causer des étourdissements, des nausées ou somnolence. Il peut aussi provoquer une perte de conscience et même la mort.
Le toluène est, cependant, beaucoup moins toxique que le benzène , et a, par conséquent, largement remplacé comme un solvant aromatique dans la préparation chimique. Par exemple, le benzène est un cancérogène connu, alors que le toluène a très peu de potentiel cancérogène.