
Acétylène
Contexte des écoles Wikipédia
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet a été une initiative de SOS Enfants. Parrainer un enfant de faire une réelle différence.
| Acétylène | |
|---|---|
| | |
 | |
Éthyne | |
| Identificateurs | |
| Numéro CAS | 74-86-2 |
| images de Jmol-3D | Image 1 |
SMILES
| |
| Propriétés | |
| Formule moléculaire | C 2 H 2 |
| Masse molaire | 26,0373 g / mol |
| Densité | 1,09670 kg / m³ de gaz à |
| Point de fusion | -84 ° C (189 K, subl) |
| Acidité (p K a) | 25 |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Acétylène ( systématique nom: éthyne), C 2 H 2, est un hydrocarbure appartenant au groupe de alcynes. Elle est considérée comme la plus simple des alcynes comme il se compose de deux hydrogène atomes et deux carbones atomes. L'acétylène est un insaturé composé organique parce que ses deux atomes de carbone sont triplement lié.
Le triple liaison carbone-carbone laisse les atomes de carbone avec deux orbitales sp hybrides pour la liaison sigma, en plaçant les quatre atomes dans la même ligne droite, avec des angles de liaison de CCH de 180 °.
Acétylène a été découvert en 1836 par Edmund Davy qui l'a identifié comme un «nouveau carbure d'hydrogène." Elle a été redécouverte en 1860 par le chimiste français Marcellin Berthelot, qui a inventé le nom "d'acétylène." Le lauréat du prix Nobel Gustaf Dalén a été aveuglé par une explosion acétylène.
Préparation
Les principales matières premières pour la fabrication d'acétylène sont le carbonate de calcium ( calcaire) et le charbon . Le carbonate de calcium est d'abord converti en oxyde de calcium et du charbon en coke, puis les deux sont mis à réagir les uns avec les autres pour former le carbure de calcium et l'oxyde de carbone :
- CaO + 3C → CO + CaC 2
Calcium carbure (ou acétylure de calcium) et de l'eau sont ensuite mis à réagir par une quelconque de plusieurs méthodes pour produire de l'acétylène et l'hydroxyde de calcium. Cette réaction a été découvert par Friedrich Wöhler en 1862.
- CaC 2 + 2H 2 O → Ca (OH) 2 + C 2 H 2
La synthèse de carbure de calcium nécessite une température extrêmement élevée, ~ 2000 degrés Celsius, de sorte que la réaction est effectuée dans un Four à arc électrique. Cette réaction était une partie importante de la révolution fin des années 1800 dans la chimie permis par le massif projet d'énergie hydroélectrique à Niagara Falls .
L'acétylène peut aussi être fabriquée par le partiel combustion du méthane à l'oxygène , ou par le fissuration de des hydrocarbures.
Berthelot a pu préparer de l'acétylène à partir de l'alcool méthylique , l'alcool éthylique , l'éthylène ou l'éther , quand il passait quelconque de ceux-ci sous forme de gaz ou de vapeur à travers un tube chauffé au rouge. Berthelot a également constaté l'acétylène a été formé en suscitant l'électricité à travers mélangé cyanogène et hydrogène gaz. Il a également été en mesure de former l'acétylène directement en combinant l'hydrogène pur avec du carbone à l'aide d'une décharge électrique arc de carbone.
Réactions
- Au-dessus de 400 ° C (673 K) la pyrolyse de l'acétylène va commencer, ce qui est relativement faible pour un hydrocarbure. Les principaux produits sont les dimère vinylacétylène (C 4 H 4) et le benzène . A des températures supérieures à 900 ° C (1173 K), le produit principal sera suie.
- Utilisation de l'acétylène, Berthelot fut le premier à montrer qu'une composé aliphatique pourrait former un Composé aromatique quand il chauffe l'acétylène dans un tube de verre pour produire du benzène avec de toluène . Berthelot oxydé acétylène pour donner de l'acide acétique et l'acide oxalique. Il a trouvé acétylène peut être réduit pour former de l'éthylène et de l'éthane .
- La polymérisation de l'acétylène avec Les catalyseurs de Ziegler-Natta produit films polyacétylène. Polyacétylène, une chaîne de molécules de carbone avec une alternance de liaisons simples et doubles, fut le premier semi-conducteur organique à découvrir; réaction avec l'iode produit un matériau extrêmement conducteur.
- Dans la réaction Kucherov (inventé en 1881 par le chimiste russe Mikhail Kucherov) est l'acétylène hydraté de l'acétaldéhyde avec un mercure sel tel que de mercure (II) bromure. Avant l'avènement du procédé Wacker cette réaction a été réalisée à l'échelle industrielle.
Reppe chimie
Walter Reppe découvert que l'acétylène peut réagir à des pressions élevées avec métaux lourds catalyseurs pour donner des produits chimiques à fort potentiel industriel:
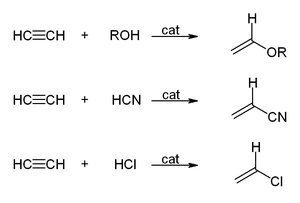
- Acétylène réagir avec des alcools , du cyanure d'hydrogène , le chlorure d'hydrogène, ou des acides carboxyliques pour donner des composés vinyliques:
- Avec aldéhydes pour donner diols éthynyle.

Ce est utilisé industriellement pour produire 1,4-butynediol à partir de formaldéhyde et de l'acétylène:
- HCCH + CH 2 O → 2 CH (OH) 2 OH CCCH
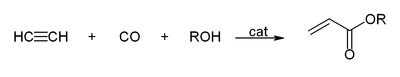
- Avec du monoxyde de carbone pour donner l'acide acrylique, les esters acryliques ou qui peut être utilisé pour produire verre acrylique.

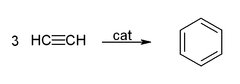
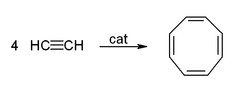
- Cyclicization pour donner du benzène et cyclooctatétraène:
Utilisations
Environ 80 pour cent de l'acétylène dans le produit annuellement aux Etats-Unis est utilisé dans la synthèse chimique. Les 20 pour cent restants sont utilisés principalement pour oxyacétylénique soudage au gaz et coupe en raison de la température élevée de la flamme; combustion de l'acétylène avec de l'oxygène produit une flamme de plus de 3300 ° C (6000 ° F), libérant 11,8 kJ / g. Oxyacétylénique est le gaz combustion de carburant commune la plus chaude. Cyanogène, un gaz plus exotiques, produit une flamme de plus de 4525 ° C (8180 ° F) quand il brûle dans l'oxygène.
L'acétylène est également utilisé dans le acétylène («carbure») lampe, une fois utilisé par les mineurs (à ne pas confondre avec le Davy lampe), sur les anciennes voitures , et encore parfois utilisé par spéléologues. Dans ce contexte, l'acétylène est généré par égouttement de l'eau de la chambre supérieure de la lampe sur le carbure de calcium (CaC 2 de) des granulés dans le culot de la lampe.
Autrefois quelques villes d'acétylène utilisés pour l'éclairage, y compris Tata en Hongrie où il a été installé sur 24 Juillet 1897 , et North Petherton, l'Angleterre en 1898.
Dans les temps modernes l'acétylène est parfois utilisé pour carburation (ce est-à durcissement) de l'acier lorsque l'objet est trop volumineux pour tenir dans un four.
L'acétylène a été proposée comme une charge d'alimentation pour le carbone fabrication moléculaire en utilisant la nanotechnologie. Comme il ne se produit pas naturellement, en utilisant l'acétylène pourrait limiter out-of-commande auto-réplication.
L'acétylène est utilisé pour volatiliser en carbone datation au radiocarbone. Le matériau carboné dans l'échantillon archéologique a réagi dans un petit four de recherche spécialisé avec le lithium métal pour former carbure de lithium (également connu sous le nom acétylure de lithium). Le carbure peut alors être mis à réagir avec de l'eau, comme d'habitude, pour former du gaz d'acétylène à être introduit dans le spectromètre de masse pour trier le rapport isotopique du carbone 14 au carbone 12.
Le Futur
L'utilisation de l'acétylène devrait se poursuivre une augmentation progressive de l'avenir que de nouvelles applications sont développées. Une nouvelle application est la conversion d'acétylène en ethylene pour la fabrication d'une variété de matières plastiques de polyéthylène. Dans le passé, une petite quantité d'acétylène avait été généré et gaspillé dans le cadre du processus de craquage à la vapeur utilisé pour fabriquer de l'éthylène. Un nouveau catalyseur développé par Phillips Petroleum permet plus de cet acétylène à convertir en éthylène pour augmenter les rendements à un coût global réduit.
Sécurité et la manipulation
Compression
En raison de la triple liaison carbone-carbone, du gaz acétylène est fondamentalement instable, et la volonté décomposer dans un exothermique réaction si comprimé dans une mesure importante. Acétylène peut exploser avec une extrême violence si la pression du gaz dépasse environ 100 kPa (≈14.5 psi) comme un gaz ou sous forme liquide ou solide, il est transporté et stocké dissous dans l'acétone ou le diméthylformamide (DMF), contenue dans un cylindre métallique avec un remplissage poreux ( Agamassan), ce qui le rend sûr à transporter et à utiliser.
Il ya des règlements stricts sur l'expédition des dangereux les bouteilles de gaz à travers le monde. L'utilisation de l'acétylène dissous diminue rapidement, en raison de sans flamme favorables soudage processus.
Les effets toxiques
L'inhalation de l'acétylène peut causer des étourdissements, des maux de tête et des nausées. Il peut également contenir des impuretés toxiques: le Spécification Commodity Compressed Gas Association pour l'acétylène a établi un système de classement pour identifier et quantifier phosphine, arsine, et teneur en sulfure d'hydrogène dans les qualités commerciales de l'acétylène afin de limiter l'exposition à ces impuretés. Le soufre, le phosphore et l'arsenic sont reports de la synthèse ingrédient coke, une forme impure de carbone et différents, les impuretés organiques pourrait se attendre du craquage thermique d'hydrocarbures la source.
Alors que les impuretés dans l'acétylène peuvent être toxiques et même mortels, l'acétylène pur est d'une très faible toxicité (sans compter les effets «stupéfiant»). Jusqu'à 80% pour cent (v / v) d'acétylène a été administré à des patients en chirurgie comme anesthésie générale. Le nom commercial pour l'acétylène était "narcylene." Il a été utilisé une bonne quantité expérimentalement en Allemagne en 1920 leurs pauvres de, peut-être sur plusieurs milliers de patients. Médicalement, l'acétylène a été considérée comme presque aussi sûr que le protoxyde d'azote et avec une puissance légèrement plus élevée, ce qui permet l'utilisation de pourcentages élevés d'oxygène dans le mélange; il est environ 50% plus puissant. Cependant, l'utilisation de mélanges d'acétylène et d'oxygène a été abandonné après plusieurs explosions de gaz à l'intérieur des poumons du patient. L'énergie de ces explosions serait devrait dépasser l'un des anesthésiques par inhalation inflammables en raison de l'instabilité de la triple liaison (cyclopropane serait presque aussi mauvais). Il a été suggéré qu'une telle explosion du thorax interne ne pouvait pas se produire avec des mélanges air (sans oxygène purifié).
Acétylène a été rarement abusé d'une manière semblable à l'abus de l'oxyde nitreux à travers les temps modernes, selon la littérature. Ces abus peuvent entraîner la mort de l'agresseur en raison de la toxicité des impuretés mentionnées ci-dessus phosphine, arsine, et sulfure d'hydrogène. Comme le gaz est chargé (absorbée) dans des réservoirs imprégnés avec de l'acétone sur une matrice solide, un peu d'acétone sort avec le gaz, contribuant davantage à les empoisonnements. Le pilote de ce comportement abusif est mieux comprise à la vue des propriétés anesthésiques de l'acétylène et les comportements addictifs.
Impuretés dans l'acétylène sont facilement détectables par l'odorat. Acétylène pur est un gaz incolore et inodore. La caractéristique de l'ail l'odeur de l'acétylène de qualité technique est attribuable à la contamination par des impuretés. Les impuretés qui peuvent être présents comprennent: sulfure de divinyle, l'ammoniac , l'oxygène , l'azote , phosphine, arsine, méthane , dioxyde de carbone , monoxyde de carbone , sulfure d'hydrogène, acétylène vinylique, divinyl acétylène, diacétylène, propadiène, hexadiène, butadiényle acétylène, et acétylène de méthyle.
Risque d'incendie
Les mélanges avec de l'air contenant entre 3% et 82% d'acétylène sont explosifs au feu. La température minimale d'inflammation est de 335 ° C. La majorité de l'énergie chimique de l'acétylène est ce qui ne est pas contenue dans la triple liaison carbone-carbone; qui est, il est supérieur à celui des trois liaisons carbone-carbone répartis, mais celui-ci est refusé en raison des espaces entre son carbone mate et tous les autres carbones même blindés en charge.
Incompatibilités
Autres significations
Parfois, les "acétylènes" pluriel peuvent se référer à la classe de composés chimiques organiques appelées alcynes qui contiennent le groupe -C = C-.
Occurrence naturelle
L'acétylène est un produit chimique modérément commune dans l'univers, souvent associée à des atmosphères des géantes gazeuses . Une curieuse découverte de l'acétylène est sur Encelade, une lune de Saturne . Acétylène naturel est censé former, à partir soit de catalyseur de décomposition d'hydrocarbures à chaînes longues ou à des températures ≥ 1770 kelvin . Étant donné que ces températures sont très peu probable sur un si petit corps lointain, cette découverte est potentiellement évocateurs de réactions catalytiques dans la lune, ce qui en fait un site prometteur pour rechercher la chimie prébiotique.

