
Benzène
Saviez-vous ...
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Benzène | |
|---|---|
 | |
Le benzène (ou 1,3,5-cyclohexatriène) | |
Autres noms Benzol | |
| Identificateurs | |
| Numéro CAS | 71-43-2 |
| Numéro RTECS | CY1400000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
| Propriétés | |
| Formule moléculaire | C 6 H 6 |
| Masse molaire | 78,1121 g / mol |
| Apparence | Liquide incolore |
| Densité | 0,8786 g / cm³, liquide |
| Point de fusion | 5,5 ° C (278,6 K) |
| Point d'ébullition | 80,1 ° C (353,2 K) |
| Solubilité dans l'eau | 1,79 g / L (25 ° C) |
| Viscosité | 0,652 cp à 20 ° C |
| Moment de dipôle | 0 Ré |
| Risques | |
| FS | MSDS externe |
| Classification UE | (F) Carc. Cat. 1 Muta. Cat. 2 Toxique (T) |
| Phrases-R | R45, R46, R11, R36 / 38, R48 / 23/24/25, R65 |
| Phrases S | S53, S45 |
| NFPA 704 |  4 3 0 |
| Point d'éclair | -11 ° C |
| Des composés apparentés | |
| Des composés apparentés | toluène borazine |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Benzène, ou Benzol (voir aussi Essence), est un organique composé chimique ayant la formule C 6 H 6. Il est parfois abrégé Ph-H. Le benzène est un incolore et très liquide inflammable avec une odeur douce et un point de fusion relativement élevé. De ce fait, son utilisation comme additif dans essence est actuellement limité, mais ce est un industriel important solvant et du précurseur pour la production de médicaments, plastiques , synthétiques caoutchouc , et des colorants. Le benzène est un constituant naturel du pétrole brut , mais il est habituellement synthétisé à partir d'autres composés présents dans le pétrole. Le benzène est un un hydrocarbure aromatique et la seconde [n] - annulène (-annulene), un hydrocarbure cyclique avec un continu pi obligataire.
Histoire
Découverte
Le mot «benzène» dérive historiquement de «benjoin de gomme", parfois appelée «benjamin» (c.-à- résine de benjoin), une résine aromatique connu pour les pharmaciens et les parfumeurs européens depuis le 15e siècle comme un produit de l'Asie sud-est. "Benjoin" est elle-même une corruption de l'expression arabe «luban jawi» ou «l'encens de Java." Un matériau acide a été dérivé de benjoin par sublimation, et nommé "fleurs de benjoin," ou l'acide benzoïque. L'hydrocarbure dérivé de l'acide benzoïque ainsi acquis le nom benzin, benzol, ou le benzène. Le benzène a été l'objet de nombreuses études scientifiques allant de Michael Faraday à Linus Pauling . Faraday abord isolé et identifié le benzène en 1825 à partir du résidu huileux dérivé de la production de gaz d'éclairage, lui donnant le nom bicarburet d'hydrogène. En 1833, Eilhard Mitscherlich produit via le distillation de benzoïque (à partir de gomme benjoin) et citron vert. Mitscherlich a donné le composé le nom benzin. En 1836, le chimiste français Auguste Laurent nommé la substance "Phene"; ce est la racine du mot phénol , qui est le benzène hydroxylé, et phényle, qui est le radical formé par abstraction d'un atome d'hydrogène à partir du benzène.
En 1845, Charles Mansfield, sous travail Août Wilhelm von Hofmann, le benzène isolé de goudron de houille. Quatre ans plus tard, Mansfield a commencé la première production à l'échelle industrielle de benzène, basé sur la méthode de goudron de houille.
Peu à peu le sens développé parmi les chimistes que les substances liées au benzène forment une famille chimique naturelle. En 1855, Août Wilhelm Hofmann a utilisé le mot " aromatique "pour désigner cette relation de famille, après une propriété caractéristique de nombre de ses membres.
formule Anneau
La formule empirique pour le benzène a longtemps été connu, mais son très la structure polyinsaturés était difficile à déterminer. Archibald Scott Couper en 1858 et Joseph Loschmidt en 1861 a suggéré structures possibles qui contenaient plusieurs doubles liaisons ou des noyaux multiples, mais l'étude des composés aromatiques en était à ses premières années, et trop peu de preuves était alors disponible pour aider les chimistes de décision sur aucune structure particulière.
En 1865, le chimiste allemand Friedrich Août Kekulé a publié un document en français (car il enseignait alors en Belgique francophone) ce qui suggère que la structure contenait un cycle à six chaînons d'atomes de carbone avec une alternance de liaisons simples et doubles. L'année suivante, il a publié un document beaucoup plus long en allemand sur le même sujet. Kekulé utilisé des preuves qui se était accumulée dans les années écoulées, à savoir qu'il ya toujours semblé être seule isomère de toute monoderivative de benzène, et qu'il ya toujours semblé être exactement trois isomères de chaque diderivative-faire valoir à l'appui de sa structure proposée. Anneau symétrique de Kekulé pourrait expliquer ces faits curieux.
La nouvelle compréhension de benzène, et donc de tous les composés aromatiques, se est avéré être si important à la fois pour la chimie pure et appliquée qu'en 1890, la Chemical Society allemande a organisé une appréciation élaborée en l'honneur de Kekulé, célébrant le vingt-cinquième anniversaire de son premier document de benzène . Voici Kekulé a parlé de la création de la théorie. Il a dit qu'il avait découvert la forme d'anneau de la molécule de benzène après avoir une rêverie ou le jour-rêve d'un serpent de saisir sa propre queue (ce est un symbole commun dans de nombreuses cultures antiques connu comme le Ouroboros). Cette vision, dit-il, lui est venue après des années d'étudier la nature des liaisons carbone-carbone. Ce était de 20 ans après avoir résolu le problème de la façon dont les atomes de carbone peuvent se lier à jusqu'à quatre autres atomes dans le même temps. Il est curieux que une représentation humoristique similaire de benzène était apparu en 1886 dans le der Berichte Durstigen Chemischen Gesellschaft (Journal de la Soif Chemical Society), une parodie de la der Deutschen Berichte Chemischen Gesellschaft, la parodie ne avait singes saisissants les uns des autres dans un cercle, plutôt que de serpents comme dans l'anecdote de Kekulé. Certains historiens ont suggéré que la parodie était un pamphlet de l'anecdote de serpent, peut-être déjà bien connu par la transmission orale, même si elle ne avait pas encore paru sur papier. D'autres ont émis l'hypothèse que l'histoire de Kekulé en 1890 était une nouvelle parodie de la parodie de singe, et était une pure invention plutôt qu'un souvenir d'un événement dans sa vie.
1890 discours de Kekulé dans lequel ces anecdotes sont apparus a été traduit en anglais. Si l'on prend l'anecdote que la mémoire d'un événement réel, les circonstances mentionnées dans l'histoire suggèrent qu'il a dû se passer au début de 1862.
La nature cyclique de benzène a finalement été confirmé par la cristallographie eminent Kathleen Lonsdale.
Structure
Benzène représente un problème particulier en ce que pour tenir compte de toutes les obligations, il doit y avoir alternance doubles liaisons de carbone:
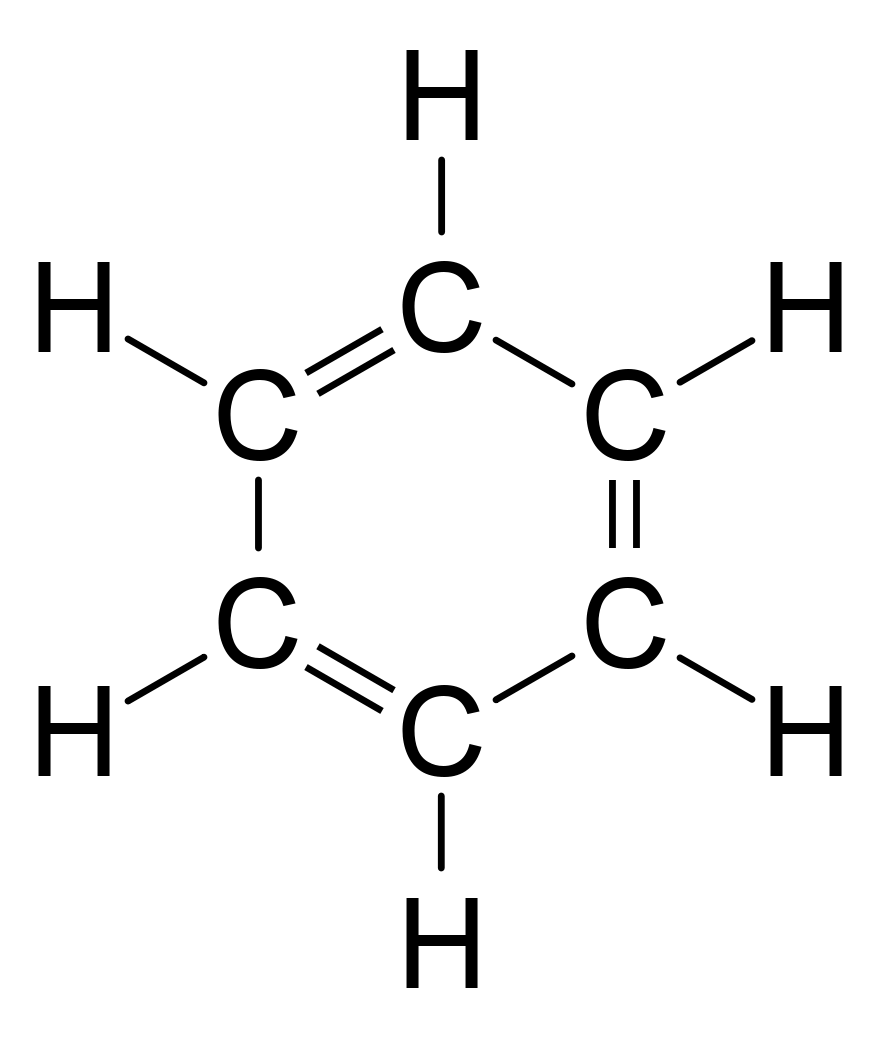
Utilisation Diffraction des rayons X, les chercheurs ont découvert que toutes les liaisons carbone-carbone dans le benzène sont de la même longueur de 140 picomètres (pm). Le C-C longueurs de liaison sont supérieures à une double liaison (135pm) mais plus courte que d'une simple liaison (147Pm). Cette distance intermédiaire se explique par électrons délocalisation: les électrons de liaison C-C sont répartis à parts égales entre chacun des six atomes de carbone. Une représentation est que la structure existe en tant que superposition de soi-disant structures de résonance, plutôt que ce soit sous forme individuelle. Cette délocalisation des électrons est connu comme aromaticité, et donne le benzène grande stabilité. Cette stabilité améliorée est la propriété fondamentale de molécules aromatiques qui les différencie des molécules qui sont non aromatique. Pour refléter la nature de la liaison délocalisée, le benzène est souvent représenté avec un cercle intérieur d'un arrangement hexagonal des atomes de carbone:
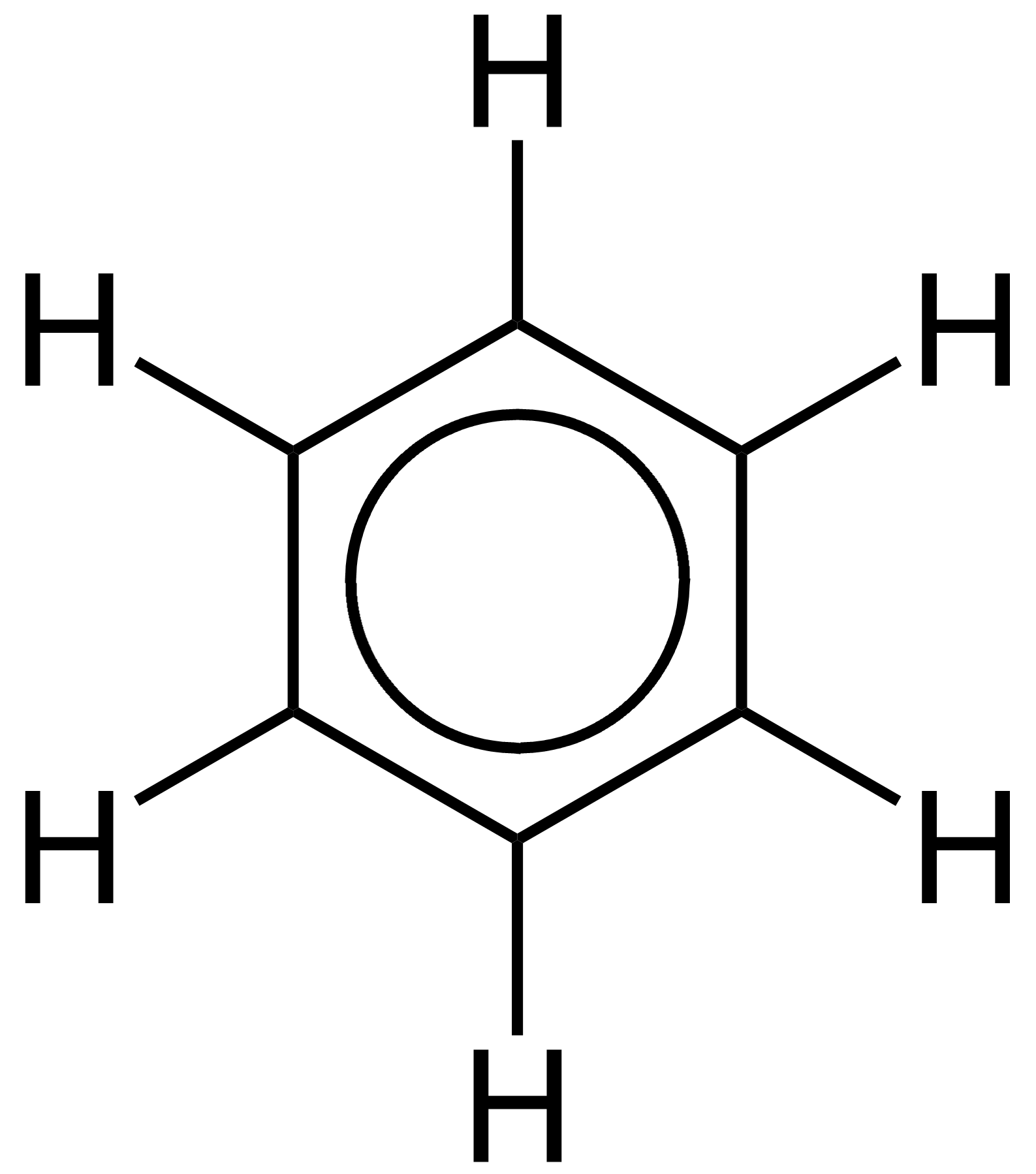
Comme il est courant dans la chimie organique, les atomes de carbone dans le schéma ci-dessus ont été laissés non marqué.
Le benzène se produit assez souvent comme un composant de molécules organiques qu'il existe un Symbole Unicode avec le code 232C pour le représenter avec trois doubles liaisons, et 23E3 pour une version délocalisée.
Les dérivés du benzène substitués
De nombreux produits chimiques importants sont dérivés du benzène, dans lequel un ou plusieurs des atomes d'hydrogène est remplacé par un autre groupe fonctionnel. Des exemples de dérivés benzéniques simples sont le phénol , le toluène , et aniline, abrégés PhOH, PhMe et PhNH 2, respectivement. Lier cycles benzéniques donne biphényle, C 6 H 5 C 6 H 5. De plus la perte de l'hydrogène donne les hydrocarbures aromatiques "condensé", tels que naphtalène et anthracène. La limite du processus de fusion du matériau est exempt d'hydrogène graphite.
En hétérocycles, atomes de carbone dans le noyau benzénique sont remplacés par d'autres éléments. Les dérivés les plus importants sont les noyaux contenant de l'azote . Le remplacement d'un CH avec N donne le composé pyridine, C 5 H 5 N. Bien que le benzène et pyridine sont structurellement apparenté, le benzène ne peut pas être converti en la pyridine. Le remplacement d'une seconde liaison CH par N donne, en fonction de l'emplacement de la deuxième N, pyridazine, pyrimidine, et pyrazine.
Production
Des traces de benzène peuvent entraîner chaque fois carbone riche en matières subissent incomplète combustion. Il est produit dans volcans et feux de forêt, et est également un composant de fumée de cigarette.
Jusqu'à la Seconde Guerre mondiale , la plupart benzène a été un sous-produit de la production de coke (ou «huile légère de four à coke") dans le acier industrie. Cependant, dans les années 1950, la demande accrue pour le benzène, en particulier de la culture plastique de l'industrie, a nécessité la production de benzène à partir de pétrole. Aujourd'hui, la plupart du benzène provient de la industrie pétrochimique, avec seulement une petite fraction étant produite à partir du charbon.
Trois procédés chimiques contribuent également à la production de benzène industrielle: reformage catalytique, le toluène hydrodésalkylation, et vapocraquage.
Reformage catalytique
Dans le reformage catalytique, un mélange de des hydrocarbures ayant des points d'ébullition entre 60-200 ° C est mélangé avec de l'hydrogène gazeux et ensuite exposées à un bifonctionnel platine chlorure ou le rhénium chlorure catalyseur à 500-525 ° C et des pressions allant de 8 à 50 atm. Dans ces conditions, hydrocarbures aliphatiques forment anneaux et perdent de l'hydrogène pour devenir hydrocarbures aromatiques. Les produits aromatiques de la réaction sont ensuite séparées du mélange réactionnel (ou reformat) par extraction à l'une quelconque d'un certain nombre de solvants , y compris le diéthylène glycol ou sulfolane, du benzène et est ensuite séparé des autres composés aromatiques par distillation. L'étape d'extraction de composés aromatiques du reformat est conçu pour produire des composés aromatiques avec des composants non aromatiques les plus bas. Les soi-disant "BTX (benzène-toluène-xylènes)" procédé consiste de ces extraction et de distillation étapes.
De même pour ce reformage catalytique, UOP et BP commercialisé un procédé de GPL (principalement du propane et butane) en aromatiques.
Toluène hydrodésalkylation
Le toluène hydrodésalkylation convertit le toluène en benzène. Dans ce processus d'hydrogène à haute intensité, le toluène est mélangée avec de l'hydrogène, puis passé sur une chrome , molybdène , ou du platine catalyseur d'oxyde à 500-600 ° C et une pression de 40 à 60 atm. Parfois, des températures plus élevées sont utilisées au lieu d'un catalyseur (à la condition réactionnelle similaire). Dans ces conditions, le toluène est soumis à une désalkylation selon la équation chimique:
- C 6 H 5 CH 3 + H 2 → C 6 H 6 + CH 4
Cette réaction irréversible se accompagne d'une réaction secondaire d'équilibre qui produit biphényle (aka diphényl) à température plus élevée: 2 C 6 H 6 H 2 ↔ + C 12 H 10
Si le flux de matières premières contient beaucoup de composants non-aromatiques (paraffines ou naphtènes), ceux-ci sont susceptibles décomposé aux hydrocarbures inférieurs tels que le méthane, ce qui augmente la consommation d'hydrogène.
Un rendement typique de réaction dépasse 95%. Parfois, xylènes et des composés aromatiques plus lourds sont utilisés à la place du toluène, avec une efficacité similaire.
Ceci est souvent appelé méthode «sur objectif" pour produire du benzène, par rapport aux procédés classiques BTX (benzène-toluène-xylène). Le processus d'hydrodésalkylation ne est pas économiquement faisable si l'écart de prix entre le benzène et le toluène est petite (ou l'écart est inférieur à environ 15% du prix du benzène).
La dismutation du toluène
Où un complexe chimique a des exigences similaires pour le benzène et xylène, puis le toluène dismutation (TDP) peut être une alternative intéressante à l'hydrodésalkylation de toluène. Grosso modo deux molécules de toluène et on fait réagir les groupes méthyle réarrangés d'une molécule de toluène à l'autre, ce qui donne une molécule de benzène et une molécule de xylène.
Étant donné que la demande de para-xylène ( p-xylène) dépasse sensiblement la demande pour d'autres isomères du xylène, un raffinement du processus de TDP appelé sélective TDP (PDTS) peut être utilisé. Dans ce procédé, le courant de xylene sortant de l'unité de TDP est d'environ 90% de paraxylène. Dans certains systèmes catalytiques actuels, même le rapport benzène-xylènes-est diminuée (plus xylènes) lorsque la demande de xylènes est plus élevé.
Le vapocraquage
Le vapocraquage est le procédé de production d' éthylène et d'autres oléfines à partir de des hydrocarbures aliphatiques. Selon la matière première utilisée pour produire les oléfines, craquage à la vapeur peut produire un sous-produit liquide riche en benzène appelé l'essence de pyrolyse. Essence de pyrolyse peut être mélangé avec d'autres hydrocarbures comme additif dans l'essence, ou par distillation (en cours BTX) pour le séparer en ses composants, y compris le benzène.
Utilisations
Les premières utilisations
Dans les 19e et début du 20ème siècles, le benzène a été utilisé comme une lotion après-rasage à cause de son odeur agréable. Avant les années 1920, le benzène a été fréquemment utilisé comme solvant industriel, en particulier pour dégraisser le métal. Comme sa toxicité est devenu évident, le benzène a été supplanté par d'autres solvants, en particulier le toluène (benzène de méthyle), qui présente des propriétés physiques similaires, mais ne est pas aussi cancérigènes.
En 1903, Ludwig Roselius popularisé l'utilisation du benzène pour décaféiner café. Cette découverte a conduit à la production de Sanka (les lettres «ka» dans le nom de la marque représentent kaffein). Ce processus a été abandonnée par la suite.
Comme additif de l'essence, du benzène augmente la indice d'octane et réduit frapper. Par conséquent, l'essence contenait souvent plusieurs pour cent de benzène avant les années 1950, lorsque remplacé le plomb tétraéthyle comme additif antidétonant la plus largement utilisée. Avec l'élimination progressive de l'essence plombée mondiale, le benzène a fait un retour comme un additif de l'essence dans certains pays. Dans le États-Unis , l'inquiétude sur ses effets négatifs sur la santé et la possibilité d'entrer dans le benzène eaux souterraines ont conduit à une réglementation stricte de la teneur en benzène de l'essence, avec des limites généralement autour de 1%. Spécifications de l'essence européennes contiennent maintenant la même limite de 1% de la teneur en benzène. L'EPA a de nouveaux règlements qui permettront de réduire la teneur en benzène de l'essence à 0,62% en 2011.
Les utilisations actuelles de benzène
Aujourd'hui le benzène est principalement utilisé comme intermédiaire pour fabriquer d'autres produits chimiques. Ses produits les plus largement produites comprennent styrène, qui est utilisé pour fabriquer des polymères et des matières plastiques, du phénol pour les résines et les adhésifs (par cumène), et cyclohexane, qui est utilisé dans la fabrication de nylon. De plus petites quantités de benzène sont utilisés pour fabriquer certains types de caoutchoucs , les lubrifiants, des colorants, des détergents, médicaments, explosifs, napalm et pesticides.
Dans la recherche en laboratoire, le toluène est maintenant souvent utilisé comme un substitut pour le benzène. Les propriétés de solvant des deux sont semblables, mais le toluène est moins toxique et a une portée plus large liquide.
Le benzène a été utilisé comme un outil de recherche de base dans une série d'expériences, y compris une analyse de gaz bidimensionnel
Réactions de benzène
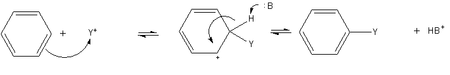
- Une substitution aromatique électrophile est un procédé général de transformation en dérivé du benzène. Le benzène est suffisamment nucléophile ce qu 'il subit une substitution par ions ou un groupe alkyle en acylium carbocations pour donner des dérivés substitués.
- Le Acylation de Friedel-Crafts est un exemple spécifique de une substitution aromatique électrophile. La réaction implique la acylation du benzène (ou plusieurs autres cycles aromatiques) avec un chlorure d'acyle au moyen d'un fort Acide de Lewis catalyseur tel que le chlorure d'aluminium ou le chlorure de fer qui agissent comme un support d'halogène.
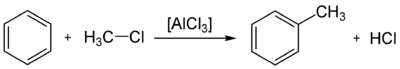
- Comme l'acylation de Friedel-Crafts, le Friedel-Crafts alkylation implique la alkylation du benzène (et de nombreux autres noyaux aromatiques) en utilisant un halogénure d'alkyle en présence d'un catalyseur acide de Lewis fort.
- sulfonation.
- Nitration: benzène subit nitration avec des ions nitronioum (NO 2 +) que l'électrophile. Ainsi, en chauffant le benzène à 50-55 ° C, avec une combinaison de sulfurique concentré et d'acide nitrique pour produire le composé électrophile, donne le nitrobenzène.
- Hydrogénation (réduction): benzène et dérivés convertissent au cyclohexane et dérivés lorsqu'ils sont traités avec de l'hydrogène à 450 K et 10 atm de pression avec un finement divisée nickel catalyseur .
- Le benzène est un excellent ligand dans le chimie organométallique des métaux à faible valence. Des exemples importants comprennent les complexes sandwich et demi-sandwich respectivement Cr (C 6 H 6) 2 et [RuCl 2 (C 6 H 6)] 2.
Effets sur la santé
L'exposition au benzène a de graves effets sur la santé. Respirer des niveaux élevés de benzène peuvent entraîner la mort , tandis que les niveaux faibles peuvent causer de la somnolence, des étourdissements, un rythme cardiaque rapide, des maux de tête , tremblements, confusion, et l'inconscience. Manger ou boire des aliments contenant des niveaux élevés de benzène peut causer des vomissements, irritation de la estomac, des étourdissements, de la somnolence, convulsions, et la mort.
Les principaux effets du benzène sont (à long terme) une exposition chronique à travers le sang . Benzène endommage les la moelle osseuse et peut causer une diminution dans les cellules rouges du sang, conduisant à l'anémie . Il peut également causer des saignements excessifs et appuyer sur la système immunitaire , augmente le risque de l'infection .
Certaines femmes qui respiraient des niveaux élevés de benzène pendant de nombreux mois avaient irrégulière menstruations et une diminution de la taille de leur ovaires. On ne sait pas si l'exposition au benzène affecte le développement foetus chez les femmes enceintes ou la fertilité chez les hommes.
Les études animales ont montré un faible poids de naissance, la formation osseuse retardée, et les dommages de la moelle osseuse lorsque les animaux enceintes respiraient benzène.
Le US Department of Health and Human Services (DHHS) classe le benzène comme un être humain cancérogène. L'exposition à long terme à des niveaux élevés de benzène dans l'air peut causer leucémie, un potentiellement mortelle cancer des organes hématopoïétiques. En particulier, La leucémie myéloïde aiguë ou leucémie aiguë non lymphocytaire (AML & LANL) peut être causée par le benzène.
Plusieurs tests peuvent déterminer l'exposition au benzène. Il existe un test pour mesurer le benzène dans l'haleine; ce test doit être effectué peu de temps après l'exposition. Le benzène peut également être mesurée dans le sang; cependant, parce que le benzène disparaît rapidement du sang, les mesures ne sont exacts que pour les expositions récentes.
Dans le corps, le benzène est métabolisé. Certains métabolites, tels que trans, l'acide trans -muconic peut être mesurée dans le l'urine. Cependant, ce test doit être effectué peu de temps après l'exposition et ne est pas un indicateur fiable de l'exposition au benzène, puisque les mêmes métabolites peuvent être présents dans l'urine provenant d'autres sources.
Le Environmental Protection Agency des États-Unis a fixé le niveau maximal admissible de benzène dans l'eau potable à 0,005 milligrammes par litre (0,005 mg / L). L'EPA exige que les déversements ou rejets accidentels dans l'environnement de 10 livres (4,5 kg) ou plus de benzène être signalé à l'EPA.
Les É.U Sécurité et administration de la santé au travail (OSHA) a fixé une limite d'exposition de 0,5 partie de benzène par million de parties d'air (0,5 ppm) dans le lieu de travail pendant une journée de travail de 8 heures, 40 heures la semaine de travail. La limite d'exposition à court terme pour le benzène dans l'air est de 5 ppm pendant 15 minutes.
Dans l'histoire récente, il ya eu de nombreux exemples des effets nocifs sur la santé de benzène et de ses dérivés. Syndrome toxique huile causé immunosuppression localisée dans Madrid en 1981 des personnes ingérant anilide contaminés l'huile de colza. Syndrome de fatigue chronique a également été fortement corrélée avec des gens qui consomment de la nourriture "dénaturé" qui utilisent des solvants pour enlever la graisse ou contiennent l'acide benzoïque.
Les travailleurs de diverses industries qui fabriquent ou utilisent du benzène peuvent être à risque d'être exposés à des niveaux élevés de ce produit chimique cancérigène. Industries qui impliquent l'utilisation du benzène comprennent le caoutchouc l'industrie, les raffineries de pétrole, les usines chimiques, les fabricants de chaussures, et essence industries connexes. En 1987, OSHA estime qu'environ 237 000 travailleurs aux États-Unis ont été potentiellement exposés au benzène, et on ne sait pas si ce nombre a considérablement changé depuis.
L'eau et la contamination des sols sont des voies importantes de préoccupation pour la transmission de contact avec le benzène. Aux États-Unis seulement, il ya environ 100 000 différents sites qui ont des sols de benzène ou de contamination des eaux souterraines. En 2005, l'approvisionnement en eau de la ville de Harbin en Chine avec une population de près de neuf millions de personnes, a été coupée à cause d'un importante exposition au benzène. Benzène fuite dans le La rivière Songhua, qui alimente en eau potable à la ville, après une explosion dans une China National Petroleum Corporation (CNPC) usine dans la ville de Jilin le 13 Novembre.
En Mars 2006, le fonctionnaire Food Standards Agency au Royaume-Uni a mené une enquête auprès de 150 marques de boissons gazeuses. Il a constaté que quatre contenaient des concentrations de benzène au-dessus de l'Organisation mondiale de la Santé limites. Les lots concernés ont été retirés de la vente. Voir benzène dans les boissons gazeuses
L'oxydation biologique et l'activité cancérogène
Une façon de comprendre les effets cancérigènes du benzène est en examinant les produits d'oxydation biologique. Benzène pur, par exemple, se oxyde dans le corps pour produire un époxyde, l'oxyde de benzène, qui ne est pas facilement éliminé et qui peut interagir avec l'ADN pour produire des mutations nuisibles. Cependant, un alkylbenzène, le toluène par exemple, subit une oxydation dans le corps pour produire de l'acide benzoïque. L'acide benzoïque est excrété plutôt facilement par le corps et ne interagit pas avec l'ADN nocivement.
Ces différences contribuent en grande partie au fait que tout le benzène est cancérogène toluène (en quantités raisonnables) ne est pas.

